‘云香’水仙NtNAC2基因的克隆及功能分析
肖瑶宇,刘 洋,李全超,李 琳,陈晓静
(福建农林大学 园艺学院,福州 350002)
植物经常遭受非生物胁迫,如高盐和干旱等,这极大地限制了生长发育,促使植物进化出一系列生理和分子机制以适应非生物胁迫[1-2]。为更好地应对逆境胁迫,以转录因子作为研究目标,通过分子育种方法来提高抗逆性成为研究热点。据报道称,大约7%的植物基因组编码序列被分配到转录因子(TF),其中NAC(NAM、ATAF、CUC)转录因子是植物特有的、数量最大的转录因子家族之一[3]。目前,已经发现在拟南芥中有117个、水稻中151个、大豆和烟草中各有152个[4-7],这些NAC转录因子有相似的结构,N端具有高度保守的DNA结合结构域,分成5个亚结构域(A~E),C端存在可变的转录激活结构域[8]。
大量研究表明,一些过表达的NAC基因可直接或间接调节相关应答基因的表达,增强转基因植物对干旱、高盐和低温胁迫的耐受性。如拟南芥ATAF1在干旱、高盐、ABA、MeJA、机械损伤和灰霉病菌侵染诱导下表达,过表达转基因株系主根缩短,从而增强耐旱性[9];水稻SNAC1分别转入水稻、小麦、棉花植株中,过表达转基因植株对外源ABA高度敏感,结实率增加,抗旱性和耐盐性都有所提高[10-12];小麦TaNAC29和鹰嘴豆CarNAC6转入拟南芥,促进侧根生长,增加存活率,从而明显提高转基因植物对盐和干旱胁迫的耐受性[13-14];小麦TaRNAC1在根中高水平表达,过表达植株在PEG处理下,生物量和谷物增多,表现出更高的脱水耐受性[15];玫瑰花瓣中RhNAC2、RhNAC3通过调控渗透相关基因表达,进而增强耐旱性[16-17];香蕉MusaSNAC1通过提高干旱胁迫下保卫细胞中的H2O2含量来诱导气孔关闭,减少水分损失,从而提高过表达株系的耐旱性[18];南瓜CmNAC1在根、茎、叶和下胚轴等不同组织部位都表达,能响应高盐、低温、干旱、ABA 和H2O2胁迫,过表达转基因拟南芥对高盐、干旱、低温胁迫的耐受性增加[19];胡杨PeNAC036能被干旱、盐诱导强烈表达,过表达转基因拟南芥蒸腾速率降低,抗旱性增强[20]。上述可见,NAC转录因子已应用于各种草本、木本植物,从而使植物对非生物胁迫的耐受性得到定向改良。中国水仙NAC转录因子的研究报道相对较少,李梦思等[21]克隆了‘云香’水仙NtNAC3153,表达分析发现NtNAC3153在ABA、高盐和高温胁迫下能被诱导,可能参与抗逆调控,尚缺乏生物学功能验证。
中国水仙作为十大传统名花之一,主要分布在福建漳州,冬季开花常作为年宵花卉,极具观赏价值和经济价值。近年来漳州城市化发展,传统农业格局发生变化,打破粮食和花卉轮作机制,分配给水仙种植面积不断减少,导致水仙花产量快速下滑, 出口额也呈下降趋势,严重制约水仙花产业的发展。水仙多为三倍体,传统杂交育种培育抗性新品种困难[22]。为解决这一困境,可采用分子育种发掘水仙抗逆相关NAC基因展开抗逆机理研究,提高抗逆性,使其能在干旱、滩涂、盐碱等贫瘠的荒地中正常生长,是水仙扩大种植面积、提高产量、提升品质的关键环节。‘云香’水仙是选育的新品种,对干旱和高盐具有很强的适应性[22]。因此选择‘云香’水仙为实验材料,通过RT-PCR克隆获得一条新的NAC基因NtNAC2,以期通过生物信息学分析、组织及逆境胁迫下表达分析,探讨NtNAC2基因的生物学功能,进一步构建载体转化烟草,在高盐、干旱胁迫条件下对NtNAC2基因进行功能初探,旨在筛选NAC候选基因,转化中国水仙,以期为提高水仙抗逆性奠定基础。
1 材料和方法
1.1 材料及其处理
供试材料为水仙新品种‘云香’,2017年10月初选取大小一致的3年生种球于4 ℃冷藏1个月,消毒处理后水培10 d,待嫩叶长至3~4 cm,滤纸吸干鳞茎球和根部表面水分后,进行不同处理。外源激素处理:分别用0.1 mmol/L ABA、0.1 mmol/L MeJA和2 mmol/L SA溶液浸泡种球根部,同时以雾喷方式喷洒嫩叶。非生物胁迫处理:分别用10 mmol/L H2O2、20% PEG6000和250 mmol/L NaCl溶液浸泡种球根部,以及置于50 ℃的高温光照培养箱。以未经处理(0 h)为对照,处理期间在特定时间点(1、3、6、12、24和48 h)分别采集根和叶。2017年10月中旬,开始水培种球至开花,期间分别采集根、叶、鳞茎等组织部位,以及花器官整个发育时期的花瓣和副冠。每个处理设定3次重复,具体取样方式参照温秀萍等[23]的方法,低温-80 ℃储存。
储存的样品加入液氮研磨匀浆处理后,用EZNA Plant RNA Kit(OMEGA)试剂盒提取样品总RNA,并通过1%琼脂糖电泳检测其完整性和纯度。用PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)反转录试剂盒去除基因组DNA污染,合成第一链cDNA。Free dH2O(TaKaRa)稀释浓度至10 μmol/L,存于-20 ℃,用于后续PCR试验。
1.2 方 法
1.2.1NtNAC2基因全长cDNA克隆及载体构建基于‘云香’水仙转录组数据中NAC序列,经NCBI Blastp筛选可能与抗性相关的NAC序列,遵循引物设计原则,用Primer 6.0和Oligo7.0软件设计2条特异性引物NtNAC2-F和NtNAC2-R(表1)。以花瓣和副冠混样cDNA为模板参照孙申申等[24]的方法克隆基因,将PCR退火温度调整为56 ℃。植物表达载体的构建采用In-Fusion HD Cloning Kit(TaKaRa)试剂盒,根据说明书参数设计2条带酶切位点的引物NtNAC2-V-F和NtNAC2-V-R(表1),以测序正确的质粒NtNAC2为模板进行RT-PCR扩增,同时在37 ℃条件下,以SpeI和AscI(NEB)双酶切pMDC140载体,电泳检测胶回收纯化后,使用5X In-Fusion HD Enzyme Premix连接得到2×35S :: NtNAC2-GUS融合蛋白。
1.2.2生物信息学分析利用VectorNTI、ProtParam、TMHMM、SignalP、NetPhos、PONDRVL3、SOPM、SWISS-MODEL、MEGA 6.0和Blastp等生物学软件及在线网站对NtNAC2蛋白的基本理化性质、跨膜区、信号肽、磷酸化位点、固有无序序列位置、二级和三级结构等进行分析,以及基于氨基酸序列的同源比对和系统进化树(NJ)的构建。
1.2.3NtNAC2基因的表达分析采用Bio-Rad CFX96荧光定量PCR仪进行qRT-PCR,分析NtNAC2在不同处理下的表达规律和不同器官、不同花发育时期的表达量。设计实时荧光定量表达检测引物NtNAC2-Q-F和NtNAC2-Q-R(表1),内参选用高度保守NtActin-F和NtActin-R,先进行PCR检测引物的准确性。qRT-PCR扩增体系参照SYBR®Premix Ex TaqTM(TaKaRa)试剂盒参数选取25 μL反应体系,反应程序:预变性95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 20 s,36个循环数。65~95 ℃每隔0.5 ℃分析溶解曲线,检测引物的专一性。以H2O为阴性对照,4孔重复,采用2-ΔΔCt法计算相对表达量,DPS V7.5软件分析数据的单因素方差,Sigmaplot软件绘图。
1.2.4NtNAC2基因转化烟草与分子检测采用农杆菌介导法[25]转化烟草,将双酶切验证及测序正确的重组质粒经冻融法转化到根癌农杆菌GV1301菌株中,侵染切成1~2 cm2烟草叶盘(组培苗龄5~6周)。暗培养3 d后置于含抗生素10 mg/L Hyg(潮霉素)的MS培养基上筛选抗性芽,选取生长良好的抗性芽转入抗生素减半的1/2 MS生根培养基诱导生根,约50 d后进行炼苗移栽。选用TransDirect Plant Tissue PCR Kit(TRAN)试剂盒提取抗性烟草植株DNA,用于PCR检测,获得的阳性植株幼叶用GUS染色,并在显微镜下观察显色结果。进一步提取阳性株系总RNA,烟草内参引物选用TbActin-F和TbActin-R(表1),RT-PCR检测NtNAC2是否过表达。
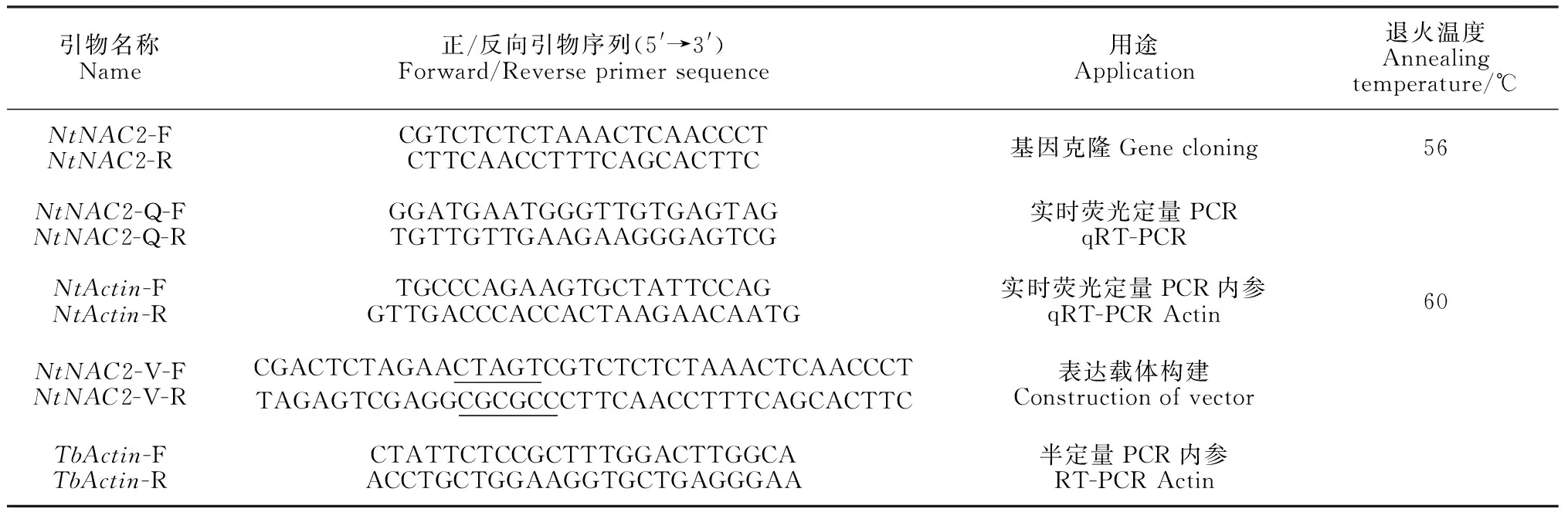
表1 引物及其序列
注:下划线为酶切位点
Note: Underlined sequences are the enzyme digest sites
1.2.5烟草种子根长试验将鉴定的T0代阳性转基因烟草于26 ℃温室中继续培养,14 h光照/10 h黑暗,70%相对湿度,每隔3 d浇水1次,每14 d补充所需养分,直至收获T1代种子,同时观察不同生长时期植株表型性状。挑选颗粒饱满的烟草种子,75%乙醇浸泡30 s,10% H2O2震荡10 min消毒处理后,将转基因T1代种子接种到含有Hyg的1/2 MS培养基,对照组野生型接种于1/2 MS培养基,培养至种子萌发。选取长势较一致的幼苗分别转移到含10μmol /L ABA、150 mmol/ L NaCl、150 mmol/L甘露醇的1/2 MS培养基中垂直培养7 d,以不添加任何物质的1/2 MS培养基为对照,每个处理均设置3个重复,观察和统计根系生长状况。
1.2.6烟草的高盐和干旱胁迫处理为进一步鉴定NtNAC2转基因烟草在非生物胁迫下的耐受性,将潮霉素筛选得到的T1代幼苗移栽至直径15 cm花盆,营养土(泥炭土∶蛭石=3∶1)培养8周后,分别进行高盐和干旱处理,以野生型植株做对照。高盐处理之前控水10 d,用400 mmol/L NaCl连续胁迫处理4周,每3 d浇灌200 mL,统计存活率,每个株系统计20株。干旱胁迫处理4周后再复水1周,观测植株表型;采集苗龄8周的嫩叶立即称重(鲜重,FW),于25 ℃室温自然干燥,每隔30 min对叶片进行称重(干重,IW),连续观测3 h,最后在80 ℃下完全干燥称量(完全干重,DW),按照下列公式计算叶片相对失水率。
2 结果与分析
2.1 NtNAC2基因的克隆及序列分析
采用RT-PCR克隆方法,以‘云香’水仙花为材料扩增NAC基因全长cDNA,琼脂糖凝胶电泳检测得到长度约为1 000 bp的目的条带(图1)。Vector NTI序列分析显示,全长1015 bp,其完整的ORF为936 bp,编码311个氨基酸多肽,命名为NtNAC2(GenBank登录号为MF417802)。
2.2 NtNAC2蛋白生物信息学分析
生物信息学分析表明,NtNAC2编码蛋白分子式为C1550H2368N422O475S21,分子量为35.19 kD,等电点为5.84,脂肪系数为54.65,总平均亲水性为-0.648,不稳定系数为32.74,推测其属于亲水性稳定蛋白。无明显跨膜和信号肽现象,推测NtNAC2不是膜蛋白且为非分泌型蛋白。丝氨酸、苏氨酸、酪氨酸磷酸化修饰位点数分别为16、12、4个,说明NtNAC2蛋白以丝氨酸修饰为主,苏氨酸或酪氨酸为辅的磷酸化修饰方式。NtNAC2蛋白C端具有较长的无序结构序列,以非折叠形式存在。蛋白二级结构主要由52.24%无规则卷曲组成,还包括21.15%α-螺旋、19.87%延伸链、6.73%β-转角结构。同源建模预测NtNAC2蛋白三级结构,与抗性相关的水稻SNAC1蛋白三级结构相似,推测NtNAC2蛋白具有相似功能,参与抗逆性调控。
在NCBI Blastp数据库中与其他植物的NAC氨基酸序列进行同源比对,结果表明,NAC蛋白氨基酸种类、长度不一致,但它们相似性较高,NtNAC2同芦笋(XP_020276002.1)、葡萄(CAN80239.1)、大豆(ALA09294.1)、拟南芥(Q9FKA0.1)和‘云香’水仙(APX42143.1)的相似性分别为70%、74%、76%、50%和58%。利用DNAMAM对NtNAC2进行多序列比对(图2),发现NtNAC2蛋白氨基端含有NAM保守结构域(8~133个氨基酸残基),由A~E等5个子域组成,表明NtNAC2是NAC转录因子家族新成员。系统进化树聚为两大类(图3),NtNAC2与Ⅰ类单子叶植物芦笋(Asparagusofficinalis)、番红花(Crocussativus)、石斛(Dendrobiumcatenatum)和桃红蝴蝶兰(Phalaenopsisequestris)等亲缘关系近,与Ⅱ类双子叶植物鹰嘴豆(Cicerarietinum)、葡萄(Vitisvinifera)、黄麻(Corchoruscapsularis)和博落回(Macleayacordata)等亲缘关系相对较远,符合植物学分类结果,同时也说明NtNAC2在进化过程中存在物种差异性。
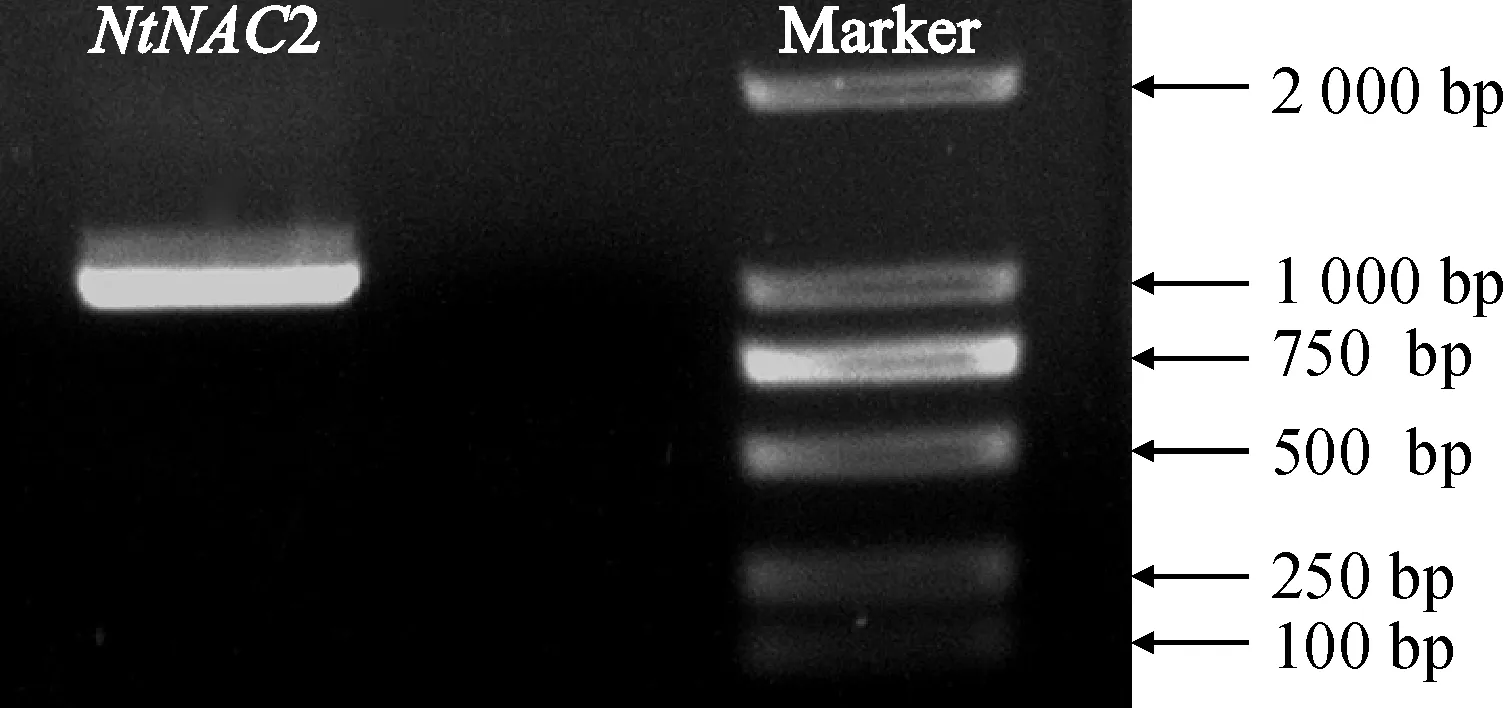
图1 ‘云香’水仙NtNAC2基因的克隆Fig.1 Cloning of NtNAC2 gene in‘Yunxiang’

AoNAM79.芦笋(XP_020276002.1);AtNAC2.拟南芥(Q9FKA0.1);NtNAC3153.‘云香’水仙(APX42143.1); A~E.NAM保守结构域图2 NtNAC2与其他NAC氨基酸序列多重比对AoNAM79.Asparagus officinalis(XP_020276002.1);AtNAC2.Arabidopsis thaliana(Q9FKA0.1);NtNAC3153.Narcissus tazetta‘Yunxiang’(APX42143.1);A-E.NAM conserved domainFig.2 Alignments of NAC domain between NtNAC2 and other NAC proteins
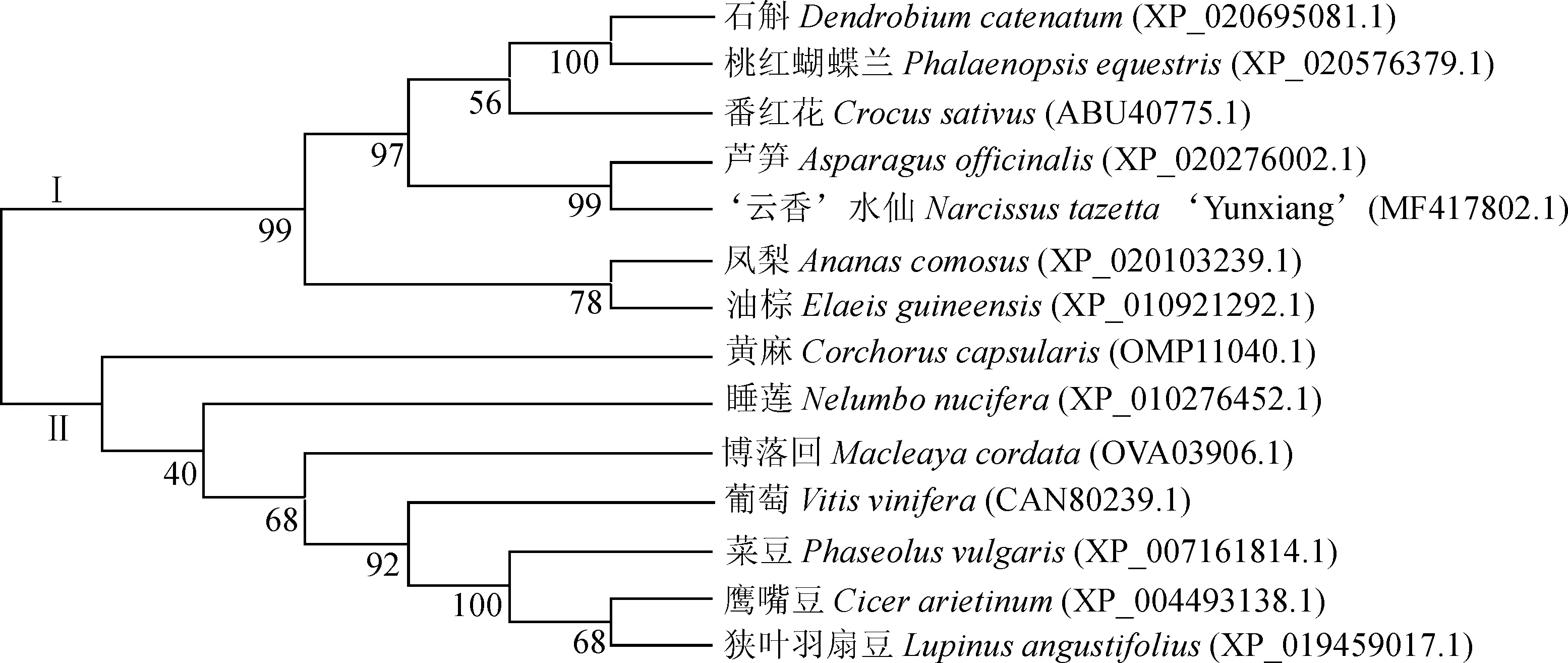
分支上的数字表示Bootstrap重复1 000次的可信度图3 NtNAC2与其他物种的NAC蛋白系统进化树The number on the branches show the reliability of the bootstrap replication 1 000Fig.3 Phylogenetic relationship of NtNAC2 with other NAC members
2.3 NtNAC2基因组织器官和时空表达分析
采用qRT-PCR技术分析发现NtNAC2基因在根和叶中高表达,显著高于鳞茎,具有一定的组织器官特异性(图4,A)。花瓣和副冠是形成水仙花最主要的器官,定量分析显示,NtNAC2在花发育阶段花瓣和副冠的表达量逐渐升高,衰败期达到峰值,分别为花苞期的27.94倍和37.24倍;同一发育阶段不同器官的表达量存在差异,花苞期到盛花期花瓣的表达量高于副冠,而衰败期相反,副冠表达量高于花瓣(图4,B)。结合水仙花开花形态学观测,发现副冠和花瓣NtNAC2的表达量与水仙花生长发育形态变化紧密相关,始花期花瓣先于副冠开放,而衰败期花瓣发生萎蔫,副冠仍然挺立(图5),推测NtNAC2可能参与‘云香’水仙花花瓣的发育,同时延缓副冠的衰老。

Ⅰ.花苞期;Ⅱ.花蕾期;Ⅲ.始花期;Ⅳ.盛花期;Ⅴ.衰败期;不同小写字母表示差异达0.05显著水平,下同图4 ‘云香’水仙NtNAC2基因在不同器官(A)和花发育时期(B)的表达分析 Ⅰ.Bud;Ⅱ.Alabastrum;Ⅲ.First flowering date;Ⅳ.Full flowering date;Ⅴ.Last flowering date;Different normal letters mean the significant difference at 0. 05 level,the same as below Fig.4 Expression of NtNAC2 in different organs (A) and flower development stages (B) of ‘Yunxiang’

图5 ‘云香’水仙花发育阶段的表型Fig.5 Phenotypic in the development tage of ‘Yunxiang’
2.4 NtNAC2基因在激素和非生物胁迫下的表达分析
为探讨NtNAC2基因是否响应激素和非生物胁迫,以未经胁迫处理(0 h)为参照,设定NtNAC2的表达量为1,qRT-PCR分析对照和不同处理下的转录水平。结果显示(图6),不同胁迫处理下,同一组织叶或根中NtNAC2的表达量随处理时间的增加不同程度显著上调;同一胁迫处理时间点,NtNAC2在根中的表达量高于叶片,除50 ℃处理6、12和24 h时根中表达量低于叶片,这可能与处理方法有关,根部浸泡在处理液中,最先且最直接感受到胁迫处理。
在ABA诱导下,1~3 h内NtNAC2的表达量急剧上升,1 h时在叶片中达到峰值,为对照的6.18倍;3 h时在根中达到峰值,为对照的15.92倍。在MeJA诱导下,NtNAC2的表达量出现下降-上升-下降的趋势,处理12 h时叶片中的表达量迅速上调为对照的4.58倍,24 h时根中表达量出现峰值为对照的7.49倍。在SA诱导下,3 h时叶和根中NtNAC2的表达峰分别为对照的1.77倍和1.88倍,上调表达量与其他胁迫处理相比较小。
在H2O2胁迫下,1 h时NtNAC2的表达量低于对照水平,12 h时在叶片达到峰值为对照的4.12倍,根中的表达峰出现较迟,48 h时上调为对照的5.92倍。在50 ℃和NaCl胁迫下,叶片和根中NtNAC2转录水平均在同一时间点达到峰值,高温处理6 h时达到峰值,分别为对照的15.48倍和8.21倍;高盐胁迫3 h达到峰值,叶片上调7.44倍,而根中上调达42.24倍。在PEG胁迫下,NtNAC2的转录水平均在3 h后出现表达峰,6 h时叶片中最高表达量为12.95倍,24 h时根中显著上调为对照的28.51倍。
上述表明,NtNAC2在叶和根中的表达受ABA、MeJA、H2O2、50 ℃、NaCl、PEG诱导,SA受诱导程度较低,且具有时空和组织表达特异性,推测NtNAC2可能在‘云香’抗逆境胁迫方面发挥重要作用,并受ABA、MeJA、SA等激素调控。
2.5 NtNAC2转基因烟草植株的鉴定
随机选择Hyg筛选出14株抗性植株,提取DNA稀释到同一浓度进行PCR扩增,有10个泳道扩增出约1 000 bp特异性条带,与目的条带重组质粒的长度一致,获得10株阳性株系(图7,A)。阳性株系GUS染色呈现蓝色,维管束部分颜色较深(图7,B),这表明‘云香’NtNAC2基因已成功导入烟草中。选取条带最明亮的7、11、12株系,3个株系重新命名为TP-1、TP-2和TP-3。以野生型烟草为对照,进一步提取总RNA进行半定量RT-PCR检测,发现NtNAC2在转基因烟草中过量表达(图8,C)。
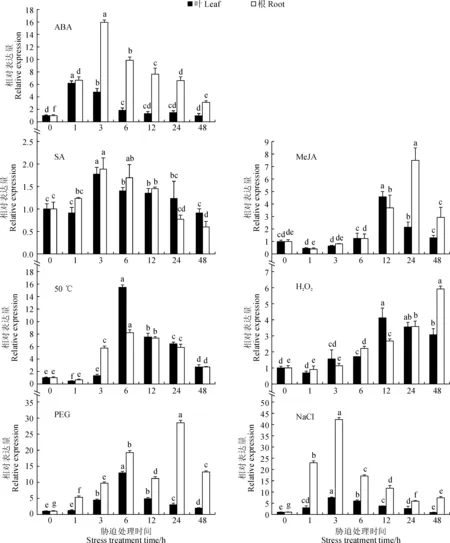
图6 NtNAC2基因在激素和非生物胁迫下的相对表达Fig.6 The relative expression of NtNAC2 gene under phytohormone and abiotic stress
2.6 NtNAC2过表达烟草在模拟逆境胁迫下的根长分析
选择野生型以及3个(TP-1、TP-2和TP-3)T1代转基因烟草株系,鉴定苗期根系的抗旱性和耐盐性。根长分析显示,在正常生长条件下(1/2 MS),野生型和转基因植株的根长没有显著性差异,转基因TP-3株系根系最长。逆境胁迫下野生型与转基因植株根长均受到不同程度的抑制,生长迟缓(图8,A)。在ABA处理下,转基因株系响应外源ABA,其中TP-3根系受抑制最严重,为野生型的0.34 倍;在NaCl和甘露醇胁迫下,转基因株系根系发育较野生型良好,而TP-3根系最长,分别为野生型的3.18倍和2.09倍(图8,B)。结果表明,过表达NtNAC2能显著提高烟草根系对ABA的敏感性,以及对干旱和高盐胁迫的耐受性。
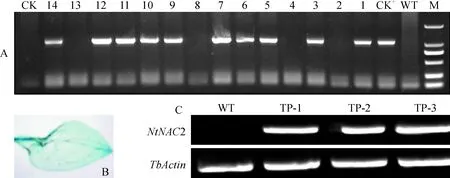
A.PCR;B.GUS染色;C.半定量RT-PCR;M.DL2000;WT.野生型;CK+.重组质粒;1~14.Hyg筛选转基因烟草植株;CK-.阴性对照(H2O);TP-1、TP-2和TP-3.代表转水仙NtNAC2基因烟草株系;下同图7 转基因烟草植株的检测A.PCR;B.GUS stain;C.Semi-quantitative RT-PCR;M.DL2000;WT.Wild tobacco;CK+.Recombinant plasmid;1~14.Screening transgenic tobacco plant by Hyg;CK-.Negative control(H2O); TP-1, TP-2 and TP-3 are NtNAC2 transgenic tobacco plants. The same as belowFig.7 Detection of the transgenic tobacco lines

A.不同胁迫处理7 d后根系的表型;B.根长图8 NtNAC2基因过表达烟草株系的根长分析A.Phenotype of roots after 7 days of different stress treatments;B.Root lengthFig.8 Assays of root length of NtNAC2 over-express transgenic tobacco lines
2.7 NtNAC2过表达烟草在干旱和高盐胁迫下的表达分析
过表达NtNAC2转基因烟草T0代在充足的水肥条件下,营养生长期间,野生型和转基因烟草没有发现差异;生殖生长期间,转基因烟草花期整体提前约1周(图9,A)。T1代转基因烟草植株经4周高盐处理,大部分植株叶片皱缩、枯黄,野生型存活率仅为33%,而转基因株系存活率仍高于60%;干旱处理4周后,土壤含水量降至7%左右,植株叶片萎蔫,转基因株系生长状态相对较好,复水1周后,野生型和转基因株系均存活,但转基因株系长势更旺盛(图9,B和C)。叶片经3 h脱水处理,失水率随测定时间延长而升高,在3 h时野生型失水率达36%,而转基因烟草失水率低于30%,其叶片失水率更低、保水性能更好(图9,D)。结果表明,过表达NtNAC2降低逆境胁迫产生的损害, 增强了烟草对盐和干旱的耐受性。
3 讨 论
NAC转录因子主要参与植物生长发育、衰老、激素信号转导和逆境胁迫响应等过程[26-27]。在本研究中,从‘云香’水仙中克隆了1个新基因NtNAC2,编码的蛋白序列由A~E等5个亚结构域组成NAM保守结构,其中子域A、C、D高度保守,而子域B、E相对变化,符合典型NAC转录因子的特点[7-8],由此推断NtNAC2是NAC转录因子家族的新成员。一些研究表明,序列相似性高的NAC可能具有相同的生物学功能,多序列比对NtNAC2与抗逆胁迫相关的‘云香’水仙NtNAC3153、拟南芥AtNAC2相似性达55%,其中‘云香’水仙NtNAC3153能被ABA、高盐和高温等诱导[21];拟南芥AtNAC2在根和花中高水平表达,能被ABA、高盐诱导上调表达,过表达促进转基因拟南芥侧根发育,从而提高耐盐性[28],推测NtNAC2可能也具有与之相似的生物学功能。
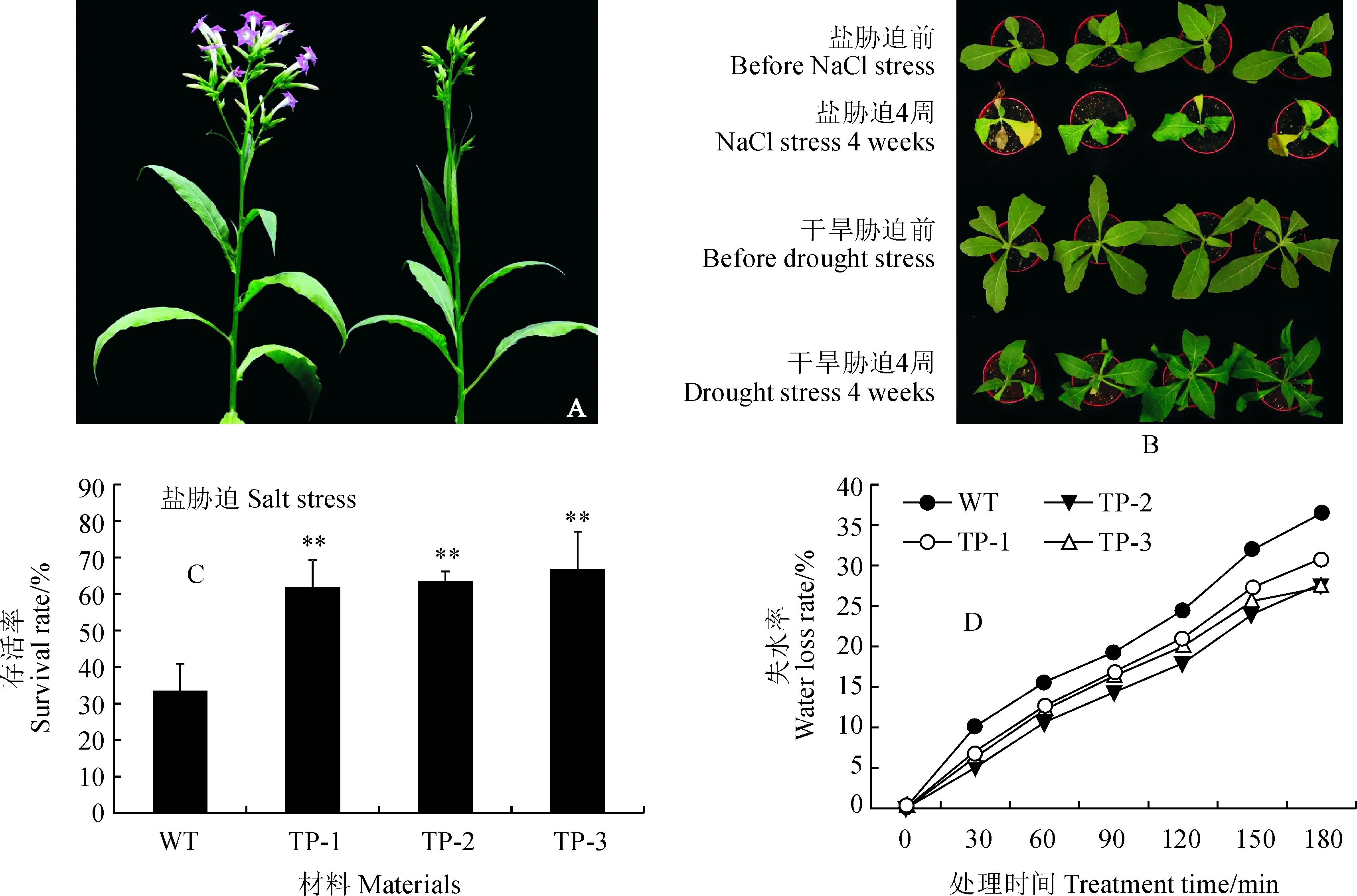
A.植株开花表型;B.干旱和高盐胁迫处理后的植株表型;C.盐胁迫后存活率;D.叶片失水率;WT.野生型;TP.过表达转基因株系;**表示转基因株系与野生型相比的极显著性差异图9 NtNAC2过表达烟草株系在盐和干旱胁迫下耐受性分析A.Phenotype of plant flowering;B.Phenotype of plants under stress treatment;C.Survival rate after salt stress;D.Leaf water loss rate WT.Wild tobacco;TP.Over-expression of transgenic lines;Asterisks indicated the significant difference from WTFig.9 Tolerance analysis of NtNAC2 over-express lines under salt and drought stress
为了进一步证明上述推测,对‘云香’水仙进行外源激素和非生物胁迫处理,发现叶和根中NtNAC2转录水平受ABA、MeJA、SA、H2O2、50 ℃、NaCl和PEG胁迫诱导上调表达,且具有时空和组织表达特异性。这类似于其他抗逆境胁迫相关NAC基因在叶和根中的表达特性。如,小麦TaNAC29经ABA、H2O2、NaCl、PEG胁迫处理后,叶和根中差异表达及上调[13,29];紫花苜蓿MsNAC2、MsNAC3在ABA、4 ℃、PEG和NaCl胁迫处理下也表现出叶、根组织特异性且诱导表达[30-31];野生大豆GsNAC20在4 ℃、干旱、盐胁迫下根和叶中转录水平差异显著[32]。上述NAC转录因子基因均已被证实为逆境响应调控基因,由此表明NtNAC2可能参与逆境响应,并可能受激素调控。
由于中国水仙遗传转化存在周期长的问题,故选择生长周期较短的模式植物烟草作为遗传转化受体,快速鉴定NtNAC2在干旱和盐胁迫下的耐受性。植物的根系主要用来吸收水分和养分,提高根系的抗旱性能更合理的分配水分,减少干旱造成的损害,提高植物在非生物胁迫下的存活率[33]。模拟逆境胁迫幼苗根系,外源ABA、NaCl和甘露醇抑制了烟草植株根系伸长,高盐和干旱胁迫苗龄4周烟草,植株叶片枯黄萎蔫,但相较于野生型的根长和表型,NtNAC2过表达烟草根长明显更长,叶片长势佳、失水率低,植株存活率高,抗旱和耐盐性明显提高。这一结果与众多的研究保持一致,如,水稻OsNAC045[34]、水稻OsNAC063[35]、小麦TaNAC47[36]、陆地棉GhSNAC3[37]、烟草NtNAC2[38]过表达促进了转基因植物的根系发育,表型性状优良,提高了对干旱、盐胁迫的耐受性。此外,正常生长条件下,NtNAC2过表达烟草花期提前1周,与小麦TaNAC2、陆地棉GhNAC79过表达转基因拟南芥植株花期提前提前3~5 d类似[39-40],该现象也与NtNAC2在花瓣和副冠中时空表达分析一致,可能参与调控烟草花发育过程,是否参与调控‘云香’水仙花期,仍有待进一步试验研究。
抗旱和耐盐是水仙分子育种的一个重要性状,开发高抗性的水仙,旨在提高经济效益。本研究证实‘云香’水仙NtNAC2是提高烟草耐受性的一个潜在优良遗传基因资源,将继续培养T1代转基因烟草至收获纯合子T3代,进一步测定生理指标评价耐受性,进而转化‘云香’水仙,深入研究该基因的功能,以期筛选高抗性的优良水仙类型。

