3种丛枝菌根真菌对任豆生长和抗旱性的影响研究
宋凤鸣 刘建华 刘登彪 史正军 王文明
(1.湖南先导洋湖再生水有限公司,湖南 长沙 410208; 2.湖南本农环境科技有限公司,湖南 长沙 410000;3.深圳市中国科学院仙湖植物园,深圳市南亚热带植物多样性重点实验室,广东 深圳 518004)
丛枝菌根真菌 (AMF) 是自然界分布最为广泛的一种内生菌根真菌,它能与地球上大约90%的陆生植物形成丛枝菌根共生体[1]。国内外学者众多研究发现,AMF不仅可以促进植物对矿质元素和水分的吸收,还能提高植物的抗逆能力,如抗旱[2]、耐盐[3]、耐寒[4]、耐酸[5]、抗重金属毒害[5-6]及抗病虫害能力[7]等。宋会兴[8]对西南地区金沙江干热河谷石灰岩土壤上所生长的植物进行丛枝菌根调查发现,有70%的被调查植物存在菌根,AMF在退化系统中可改良土壤的结构,促进植物的生长,增加植物多样性等,在荒漠、干旱区、矿区、盐碱地、草地等退化生态系统的生态恢复与重建过程中可起到显著的促进作用。
任豆 (Zeniainsignis) 学名翅荚木,豆科任豆属 (Zenia),速生阳性乔木树种,是我国华南石灰岩地区的特有树种,主要分布于我国中亚热带与南亚热带的岩溶地区,属于我国二级保护植物[9]。由于任豆萌芽性强,侧根粗壮发达,穿透能力强,可在石缝中生长;能固氮且耐干旱瘠薄,是我国南方绿化石山的优良速生树种[10]。同时任豆也是主要的用材树种,具有较高的生态效益和经济价值。
目前任豆的研究主要集中在种苗繁育[11-12]、种源差异[13]、生理生长[14-15]、营养配方施肥[16-18]、引种栽培[19]和造林技术[20-21]等方面,针对任豆的菌根接种少有研究。任豆苗期生长阶段对水分胁迫相对敏感,有研究表明,在石漠化地区采用任豆、红椿 (Toonaciliata)、紫穗槐 (Amorphafruticosa) 3种幼苗造林时,任豆幼苗的造林成活率最低[22]。因此,本研究通过任豆接种摩西球囊霉 (Glomusmosseae)、根内球囊霉 (Glomusintraradices)、幼套球囊霉 (Glomusetunicatum) 3种最常见的AMF,以期增加其苗期抗性,提高造林成活率,为以后运用到边坡修复、矿山修复等工程提供参考。
1 材料与方法
1.1 试验材料
供试宿主植物:任豆种子购买自广州田野风园林绿化有限公司。
供试菌种:摩西球囊霉 (GM)、根内球囊霉 (GI)、幼套球囊霉 (GE),购买自新疆石河子大学农学院。
土壤脲酶、磷酸酶试剂盒购买至南京建成生物工程研究所。
1.2 菌根苗模拟干旱试验方法
1.2.1任豆菌根苗生产
试验于2015年11月开展,共4个处理,分别为GM、GI、GE的单一接种,和不接种的CK;花盆规格为长 × 宽 × 高=48 cm × 30 cm × 16 cm。种植基质配比为V(泥炭)∶V(蛭石)∶V(珍珠岩)∶V(河沙)=1∶1∶1∶1,供试基质理化性质见表1。种植前盆底先加3/5体积的灭菌基质;然后加入1/5体积的菌剂 (孢子密度约为500个/100 g干土),加入10粒任豆种子并均匀铺开;最后加入1/5体积灭菌基质覆盖种子并用灭菌水浇透。CK基质为同等体积的灭菌基质不加任何菌剂,其他养护措施各处理组一致,每个处理重复6盆。培养条件为光照培养箱中,温度26 ± 2 ℃,光照/黑暗时间设置为16/8 h。处理2周后进行间苗处理,使每盆任豆苗保留3株长势一致的幼苗。任豆苗培养6个月后进行生长指标的测定和侵染率的测定。
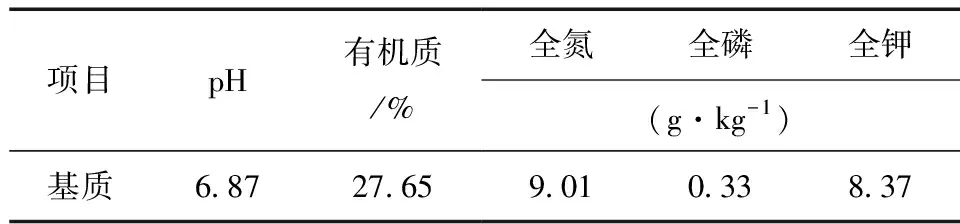
表1 供试基质理化性质Table 1 Basic physico-chemical properties of the test soils
1.2.2菌根染色与生长指标测定
菌根苗培养6个月后,每个处理取3盆进行生长指标测定;截取根系进行染色,参照杨亚宁等[23]的方法,染色完毕后,每个处理取长1 cm的根段,按公式 (1) 计算侵染率,并观察泡囊、丛枝、菌丝等结构。
侵染率=侵染数/总数×100%
(1)
1.2.3盆栽控水模拟自然干旱试验
任豆苗培养6个月后,每个处理取3盆进行自然抗旱试验,培养环境同1.2.1;试验前1 d,各处理充分浇透水;自然抗旱开始后,停止浇水,每隔7 d进行抗旱指标与光合荧光指标测定,直到有处理组叶片超过80%萎蔫时停止;盆栽控水14 d后进行复水,7 d后再测定光合荧光指标。
1.3 生长生理指标测定方法
1.3.1生长指标测定
每个处理测量株高、地径、叶绿素含量,地上部分和地下部分鲜质量,其中叶绿素含量用SPAD-502plus (柯尼卡美能达,日本) 测量。土壤酶活取各处理植物根系附近土壤用试剂盒进行土壤酶活测定,地下部分根系留作侵染测定和氮磷指标的测定[24]。
1.3.2抗旱指标测定
分别在自然抗旱处理第1天和第14天对植物叶片取样,中间不取样,以避免机械损伤对植物的影响。参照文献 [25] 方法测定叶片相对含水量、叶片相对电导率、叶片丙二醛含量和叶片可溶性糖含量。
土壤含水量测定:第1次浇透水后,等待2 h使多余的水分流出,此时连盆带土称重,记m0,并把此时的含水量作为100%;每隔1周后,连盆带土称量,记mn,n代表累计周数,按公式 (2) 进行计算,以此类推直至试验结束;称量精确至0.001 g。以土壤相对含水量在45%~55%为中度干旱胁迫,45%以下为重度干旱胁迫。
土壤相对含水量=(mn/m0)×100%
(2)
式中:n为累计周数。
1.3.3光合指标测定
参照参考文献 [26-28],用Li6400-XT (LI-COR,美国) 测定光合指标,自然抗旱处理第1、7、14、21天上午9:00 (叶片已经充分完成光适应阶段) 利用荧光叶室光源测定净光合速率 (Pn)、蒸腾速率 (Tr)、气孔导度 (Gs)、胞间CO2浓度 (Ci),光照强度设定为1 000 μmol/(m2·s) 并提前标记叶片,待仪器读数稳定后记录;每次测定前1 d晚上23点进行暗反应测定,对同一叶片进行初始荧光 (F0) 和最大荧光 (Fm) 进行测量;结合2次测量的数据,按公式 (3)~(8) 计算叶绿素荧光特征参数。
光化学最大量子效率:
Fv/Fm=(Fm-F0)/Fm
(3)
有效荧光产量:
Yield(ΔFv/Fm)=(Fm′-Fs)/Fm′
(4)
电子传递速率:
ETR=Yield×Par×0.84×0.5
(5)
光化学淬灭系数:
qP=(Fm′-Fs)/(Fm′-F0′)
(6)
非光化学淬灭系数:
NPQ=(Fm-Fm′)/Fm′
(7)
光系统II光化学量子效率:
ΦPSII=(Fm′-Fs)/Fm′
(8)
式中:F0′为光下初始荧光,Fm′为光下最大荧光,Fs为稳态荧光。
1.4 数据分析
数据收集与作图使用Excel 2013,使用SPSS 20.0对各处理获得的根系侵染率、植物生长量、植物氮磷吸收、土壤酶活、抗旱生理指标、光合和荧光参数等数据进行Duncan′s多组样本间差异显著性分析。
2 结果与分析
2.1 菌根侵染比较
从表2可知,各处理中GM的侵染效果显著高于其他处理 (P< 0.05)。GE稍差,说明经过6个月的接种培养,任豆根系与3种AMF的亲和性依次为,GM > GI > GE。
表2丛枝菌根侵染率
Table 2 Arbuscular mycorrhizal infection rate

处理侵染率/%CK0.0dGM96.7aGI83.3bGE63.3c
注:不同小写字母表示差异显著 (P< 0.05)。
如图1所示,经过对根系染色处理后,菌根组在显微镜下可看到明显的丛枝、泡囊、菌丝等显微结构,而CK在显微视野中无法找到上述结构。结合表2中各处理的侵染率,表明AMF已经成功接种并有效侵染任豆根系,并均已达到了60%以上的侵染率,而CK未受到AMF菌侵染。
2.2 菌根苗生长指标比较
由表3可知,单一接种任何一种AMF后,任豆的生长量包括株高、地径、地上部分鲜质量、地下部分鲜质量和叶绿素含量都相对比CK有明显提升。GM、GI、GE菌根处理组较CK株高增长19.0%、4.3%和2.3%,地径分别增长18.6%、4.3%和6.1%。菌根苗较CK地上部分鲜质量提高了52.8%、38.8%和31.4%,地下部分鲜质量提高了42.4%、21.7%和17.0%,叶绿素含量提高了37.5%、11.2%和10.8%。其中以GM促生效果最佳,GI与GE次之,GM、GI与CK在5个指标均表现出显著差异 (P< 0.05),GE与CK在株高指标没有显著差异,但在其他指标仍显著高于CK (P< 0.05)。由于苗龄较小,植株基本无分支,各处理冠幅无明显规律或差异。
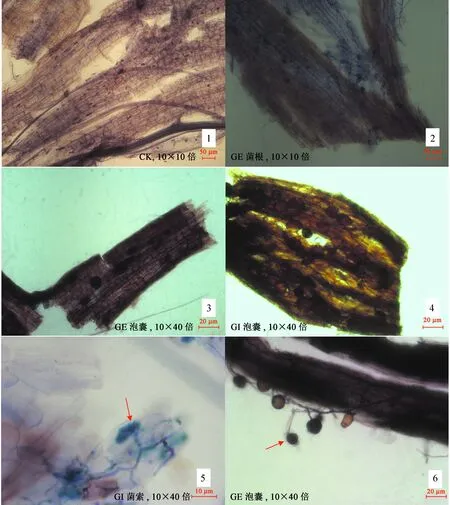
图1丛枝菌根染色显微镜观察结果
Fig.1 Arbuscular mycorrhizal staining microscopy
表3接种丛枝菌对任豆生长的影响
Table 3 Effects of inoculation with AMF onZ.insignis

处理株高/cm地径/mm地上部分鲜质量/g地下部分鲜质量/g叶绿素含量/spadCK45.75±3.61c5.37±0.31c7.08±0.89d5.12±0.48d33.59±4.54cGM56.83±1.63a6.37±0.42a10.82±0.58a7.29±0.04a46.20±3.78aGI49.78±1.35b5.60±0.82b9.83±0.27b6.23±0.38b37.34±3.39bGE48.85±2.45c5.70±0.90b9.30±0.20c5.99±0.51c37.21±3.13b
注:不同小写字母表示差异显著 (P< 0.05)。
磷酸酶是土壤中非常重要的酶类,其活性可作为评价土壤磷素生物转化方向与强度的指标。已有研究文献认为[29],土壤脲酶活性与土壤的微生物数量、有机质含量、全氮和速效磷含量呈正相关。由表4可知,不同处理土壤的磷酸酶和脲酶活性均有显著差异 (P< 0.05),土壤磷酸酶活性菌根苗较CK分别提高27.1%、30.7%、25.0%,脲酶活性分别提高52.9%、42.8%、8.9%,GM接种的处理组较CK有最大幅度的提升,GI和GE次之。地上部分和地下部分的氮、磷含量数据变化趋势也是GM > GI > GE > CK。菌根处理组与CK在地上部分和地下部分氮磷含量的差异均达到显著水平 (P< 0.05),菌根处理组较CK在地上部分氮含量提高18.4%、12.9%、3.9%,地下部分氮含量提高19.7%、13.9%、2.4%,地上部分磷含量提高70.4%、61.1%、46.3%,地下部分磷含量提高113.3%、93.3%、66.7%。土壤磷酸酶、土壤脲酶与地上部分和地下部分的氮、磷含量均呈显著正相关 (P< 0.05)。

表4 接种丛枝菌对土壤酶活和氮磷吸收的影响Table 4 Effects of inoculation with AMF on soil enzyme activities and N and P uptake
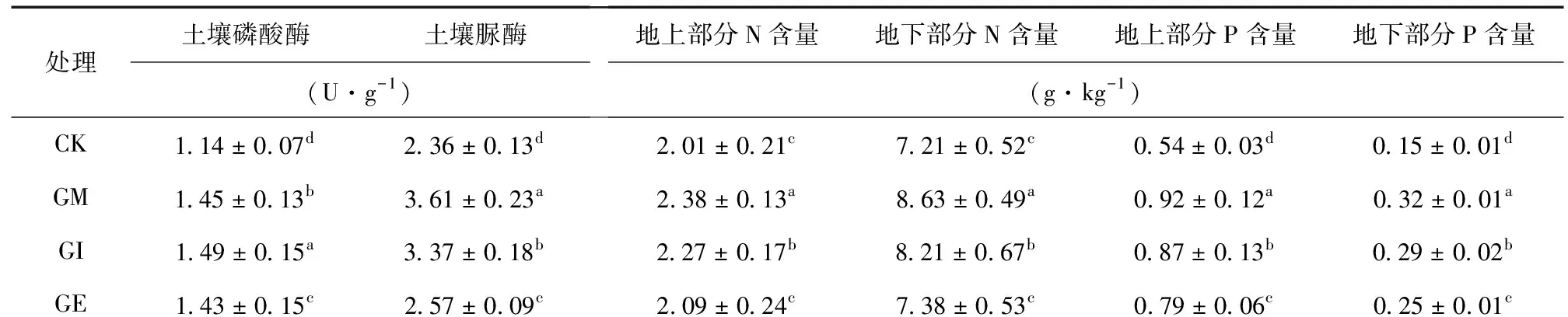
处理土壤磷酸酶土壤脲酶(U·g-1)地上部分N含量地下部分N含量地上部分P含量地下部分P含量(g·kg-1)CK1.14±0.07d2.36±0.13d2.01±0.21c7.21±0.52c0.54±0.03d0.15±0.01dGM1.45±0.13b3.61±0.23a2.38±0.13a8.63±0.49a0.92±0.12a0.32±0.01aGI1.49±0.15a3.37±0.18b2.27±0.17b8.21±0.67b0.87±0.13b0.29±0.02bGE1.43±0.15c2.57±0.09c2.09±0.24c7.38±0.53c0.79±0.06c0.25±0.01c

注:不同小写字母表示差异显著 (P< 0.05)。
2.3 自然抗旱特性比较
任豆盆栽浇透后土壤相对含水量为100%,干旱7 d后土壤相对含水量为70.98%,干旱14 d后土壤相对含水量为44.61%,此时已接近重度干旱胁迫。由表5可知,干旱胁迫前,CK和3个菌根处理组的叶片相对含水量均无显著差异,可溶性糖含量存在显著差异 (P< 0.05);GI、GE与GM、CK的相对电导率和丙二醛含量存在显著差异 (P< 0.05)。任豆自然干旱14 d以后,所有处理组较干旱胁迫开始前叶片相对含水量均表现出下降趋势,CK叶片含水量较胁迫前下降了40.64%,GM、GI、GE菌根处理组叶片含水量下降率为30.3%、39.6%和37.3%。可溶性糖含量、相对电导率、丙二醛含量均有所增加,CK可溶性糖含量较胁迫前增加了18.7%,GM、GI、GE菌根处理组叶片可溶性糖含量增加率为19.1%、43.8%和48.4%;CK和菌根苗相对电导率胁迫前后变化率分别为87.6%和30.2%、17.6%、44.9%;CK和菌根苗叶片丙二醛含量胁迫后较胁迫前增长了3.1和2.5、1.4、1.4倍。胁迫后菌根苗叶片相对含水量、可溶性糖含量显著高于CK,相对电导率、丙二醛含量显著低于CK (P< 0.05),表明接种菌根苗对任豆抗旱性有一定程度的提高。

表5 接种丛枝菌对任豆抗旱性的影响Table 5 Effects of inoculation with AMF on drought resistance of Z.insignis

处理叶片相对含水量/%胁迫前胁迫后相对电导率/%胁迫前胁迫后丙二醛含量/(μmol·g-1)胁迫前胁迫后可溶性糖含量/%胁迫前胁迫后CK83.89±3.17a49.80±1.90d17.48±1.10b32.80±0.67a2.07±0.09b8.49±0.08a1.87±0.22b2.22±0.31dGM82.68±1.77a57.79±5.41a17.92±1.52b23.33±2.00c2.04±0.11b7.05±0.70c1.99±0.19a2.37±0.37cGI83.72±1.06a50.57±0.10c19.89±0.90a23.40±2.01c2.79±0.09a6.60±0.49d1.92±0.03a2.76±0.13bGE82.89±0.87a51.98±1.18b16.81±0.86b24.37±1.19b2.98±0.19a7.22±0.65b1.90±0.04a2.82±0.31a

注:不同小写字母表示差异显著 (P< 0.05)。
光合指标能反应植物在受到胁迫的程度,间接反应出各处理组耐旱能力的差别。不同处理在不同时期的光合指标变化见图2,荧光指标变化见图3。

图2不同处理在不同时期的光合指标变化
Fig.2 Changes in photosynthetic indicators of different treatments at different periods
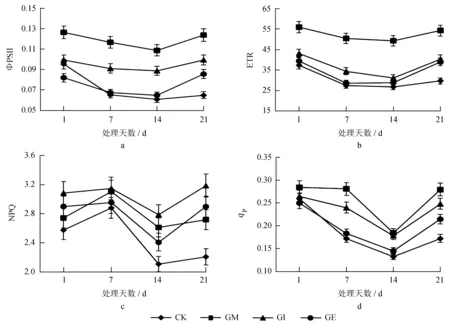
图3不同处理在不同时期的荧光指标变化
Fig.3 Fluorescence index changes in different treatments at different periods
由图2可知,干旱胁迫开始后各处理的Pn、Gs、Tr均开始下降,Ci先下降后升高,在实验处理第21 d,即复水7 d后均缓解,恢复至接近起始水平。除实验起始时外,在其他阶段各指标的测定值在不同处理组中均存在显著差异 (P< 0.05)。中度干旱时,叶片Gs、Ci浓度均下降,气孔限制引起最大光合能力下降,而重度干旱下,植物呼吸作用产生的CO2持续增加,光合消耗的CO2少,Ci浓度上升,此时非气孔限制,即胁迫导致光合器官的光合活性下降,是Pn下降的主要原因。GM、GI在同胁迫时期Pn、Ci、Gs均高于CK,蒸腾速率低于CK,表明接种AMF可在一定程度提高水分胁迫下的光合效率,减少蒸腾,提高水分利用率。
由图3可知,ETR、qP、ΦPSII在受到胁迫后均呈下降趋势,NPQ先略有升高,重度胁迫时显著下降。除个别指标在特定阶段数值接近无显著差异外,4个指标在其他阶段的测定值在不同处理组中均存在显著差异 (P< 0.05)。胁迫时间越长,各指标降幅越大,且菌根化苗的降幅逐渐小于非菌根化苗。在逆境情况下,如果过剩的光能得不到耗散就会损害光合机构,从而影响ΦPSII活性。GM和GI的ΦPSII变化较小,说明受胁迫较轻,CK变化幅度最大,受胁迫较重。qP是一个综合评定指标,数值越小代表受到胁迫越重,CK数值最小,受到的胁迫较重。
3 结论与讨论
已有不少研究表明AMF不仅能促进植株根部吸收养分元素,还可能将根部吸收的营养通过茎调节运输到叶片,以供给叶片光合代谢过程中的需要,从而影响植物体内养分元素的分配,促进木本植物幼苗苗高、地径的生长,生物量的积累以及增加单位面积叶片生物量,增大光能的捕获,降低叶面积比,从而提高幼苗抗逆性[29]。AMF对植物生长和抗性的积极影响在香椿 (Toonasinen-sis)[30]、银合欢 (Leucaenaleucocephala)、木豆 (Cajanuscajan)[31]、紫穗槐[32]、构树 (Broussonetiapapyrifera)[33]、滇柏 (Cupressusduclouxiana)、楸树 (Catalpabungee)[34]等均得到验证。本研究中接菌植物的株高、鲜质量和叶绿素含量、土壤磷酸酶和土壤脲酶活性、植物体内N、P含量均显著高于CK,再一次印证了此结论。
本研究中,在水分胁迫下,任豆菌根苗叶片相对含水量、可溶性糖含量显著高于CK,相对电导率、丙二醛含量显著低于CK,表明菌根苗在干旱胁迫下叶片持水率相对稳定,植物细胞抗膜脂氧化能力增强;细胞质膜透性未发生不可逆伤害,产生了更多的可溶性糖等物质以调节渗透压,表明接种AMF有效缓解了干旱胁迫对任豆的伤害,提高了对干旱的适应和忍耐能力。研究结果与前人利用香椿、银合欢、木豆、紫穗槐等物种接种丛枝菌得出的结论[30-32]一致。光合参数和叶绿素荧光参数的变化表明,AMF减轻了任豆叶片ΦPSII反应中心的伤害程度,提高ΦPSII光能转化效率、捕获激发能效率和电子传递效率,增强了光能和水分利用率,从而提高了幼苗的抗旱性,与构树接种丛枝菌根的研究结果[33]一致。干旱复水后,光合和叶绿素荧光相关指标表现出上升趋势,且菌根苗上升幅度更大,表明菌根苗可在相对较短时间内恢复长势。接种丛枝菌后提高任豆在逆境生理和光合生理多方面对干旱胁迫的协调能力与丛枝菌根对上述植物的影响是一致的。
同时,菌根的促生长作用、植物的抗逆生理、光合和叶绿素荧光变化也是相互影响、相辅相成。本研究中测定的指标和数据已充分反映其规律。植物通过菌根促进了根系生长,增大了根系对营养与水分的吸收面积[34],菌丝的磷酸酶活性也可增加土壤酶活,从而可以吸收较多氮磷及其他矿质营养,获得更大生物量。在水分胁迫下,生物量较大的菌根苗其水分和营养物质的积累也更多,可在土壤水分匮乏时供应一定量的营养和水分,利用营养元素合成渗透调节物质,降低叶片水势,从而使植物不容易发生萎蔫。此外菌根对营养和矿质元素的吸收也可增加叶绿素的合成,从而提高净光合速率和水分利用能力,促进叶绿素荧光的发射和多余光能的热耗散,从而避免对光合反应中心造成损伤。此外,本研究并未研究植物内源激素水平、抗氧化酶系统及其相关性,但据相关文献[35]研究结果,菌根真菌产生的植物生长调节物质可能也是提高植物抗逆性的机制之一。菌根真菌在生长过程中可产生多种内源激素,如赤霉素、吲哚乙酸等,可调节植物营养和生理,诱导增强植物抗氧化酶系统活性,以清除自由基、活性氧等,减轻细胞的过氧化伤害;调节气孔导度,提高净光合速率,从而提高对水分的利用率,更好地适应逆境胁迫。
GM、GI、GE 3种丛枝菌根中,以GM接种影响最显著,与多数研究结果[30-34]一致。同时,菌根的促生长效益、提高抗旱性的效果与菌根侵染率呈明显正相关关系,这可能是3种丛枝菌根作用效果差异的主要因素。菌根真菌与植物的亲和性决定了侵染率高低,从而影响菌根真菌发挥促生效果。故在苗木菌根化实际运用时,可优先考虑接种摩西球囊霉。但在自然生态系统中,野生菌根苗根际菌根真菌多样性较高[36-37],往往为多种AMF复合侵染,或丛枝菌与外生菌根复合侵染,本研究只单独考虑了单一接种不同AMF对任豆的影响,没有考虑不同菌种以不同比例复配后的效果,还需后续开展相关工作。

