SPF级实验小鼠4种致病菌多重PCR方法的建立及优化*
张越华 郑秀青
(厦门大学实验动物中心,厦门 361100)
实验动物广泛地应用于医学、生物、公共卫生、食品、国防和军事科学方面等领域,其质量直接影响到我们的生产和生活质量。近几年来随着实验动物的需求量与饲养规模日益扩大,检测数量也随之大大增加,任务越来越繁重[1-4]。鼠伤寒沙门氏菌(Salmonellatyphimurium,SE)、肺炎克雷伯杆菌(Klebsiellapneumoniae,KPN)、嗜肺巴斯德菌(Pasteurellapneumotropica,PP)、铜绿假单胞菌(Pseudomonasaeruginosa,PA)是造成SPF实验小鼠污染的常见致病菌,这些致病菌可引起啮齿类等哺乳动物呼吸系统的隐性感染甚至死亡,在实验动物质量检测工作中时有阳性结果的发生,对动物质量的控制造成困扰[5-6]。目前屏障环境实验动物微生物检验检疫主要依据中华人民共和国国家标准《实验动物微生物学等级及监测》(GB14922.2-2001)的检验流程进行操作,其本质上主要依靠传统的分离培养鉴定方法,不仅耗时长、花费大、特异性低,而且无法对人工难以培养的致病细菌进行检测。但PCR方法可以弥补细菌学培养的不足,并可在数小时内检测出病原菌,尤其是多重PCR方法既能节省试剂用量又能缩短检测时间。而目前,这四种SPF实验小鼠常见致病菌的检测主要依赖于单一的PCR检测[7-8],同时检测该四种病原微生物的多重PCR的方法尚未建立,本研究旨在建立一种能同时检测鼠伤寒沙门氏菌、肺炎克雷伯杆菌、嗜肺巴斯德菌、铜绿假单胞菌的多重PCR方法,为其在SPF级实验小鼠微生物检测应用中提供良好的检测手段。
1 材料与方法
1.1 材料
1.1.1供试菌株: 标准菌株:实验菌株为鼠伤寒沙门氏菌CMCCCB50115、肺炎克雷伯杆菌ATCC700603、嗜肺巴斯德菌ATCC35149、铜绿假单胞菌ATCC27853由厦门大学实验动物中心质检部保存以及提供。
1.1.2培养基及试剂: 营养肉汤购自广东环凯微生物科技有限公司;Taq DNA聚合酶、 dNTPS、DNA Marker购自宝生物工程(大连)有限公司;细菌基因组DNA提取试剂盒采购于厦门艾碧康生物科技有限公司;琼脂糖购自上海生工生物工程股份有限公司;引物由上海生工生物工程股份有限公司合成;其他试剂均为市售分析纯试剂。
1.1.3主要仪器设备: T100 Thermal Cycler PCR仪、PowerPac电泳仪(美国Bio-Rad公司),凝胶成像系统。
1.1.4实验动物: 42只18~22 g雄性SPF级KM小鼠,来源于厦门大学实验动物中心合格证号:【SCXK(闽)2013-0001】,并饲养在该中心ABSL-2生物安全实验室负压IVC中,其感染过程在生物安全柜内操作。
1.2 方法
1.2.1细菌DNA提取: 所有菌株分别接种于营养肉汤培养基中,37 ℃、150 r/min振荡培养过夜,按试剂盒说明书要求提取细菌DNA基因组,采用紫外分光光度计测定模板DNA的浓度与纯度,将获得的DNA样品于-20 ℃保存备用。
1.2.2多重PCR引物设计与合成: 选择鼠伤寒沙门氏菌invA基因、肺炎克雷伯杆菌khe基因、嗜肺巴斯德菌16SrRNA基因、铜绿假单胞菌ecfX基因作为特征靶基因,应用Primer premier 5.0及Oligo 6.0软件设计4对特异性引物,并由上海生工生物工程股份有限公司合成,其序列见表1。

表1 靶基因与引物序列Table 1 Target gene and primer sequences
1.2.3单重PCR检测方法的建立:为了确定单重PCR扩增的最佳条件及检测单基因PCR扩增的特异性,分别以4个标准菌的DNA为模板,用相应的引物进行单重PCR扩增。PCR反应体系:2 μL模板DNA,0.5 μL 50 μmol/L上、下游引物,4 μL 2.5 mmol/L dNTPs,1.5 μL 1 mol/L MgCl2,Taq酶2.5 U,5 μL 10×PCR buffer,加ddH2O至50 μL。PCR扩增程序:95 ℃预变性5 min,94 ℃变性30 s,退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。其次为了摸索不同退火温度的影响,将退火温度设定为:45.8 ℃、48.4 ℃、51.5 ℃、54.0 ℃、56.8 ℃、59.5 ℃、62.1 ℃、64.5 ℃,进行PCR反应,以确定单项PCR反应的最佳退火温度。PCR反应产物用1.5%琼脂糖凝胶电泳检测。
1.2.4多重PCR反应条件优化:以鼠伤寒沙门氏菌、肺炎克雷伯杆菌、嗜肺巴斯德菌、铜绿假单胞菌混合DNA为模板,以等量添加不同标准菌的引物对为原则,优化多重PCR的反应条件。初始反应体系为:5 μL 10×PCR buffer,1.5 μL 1 mol/L MgCl2,4 μL 2.5 mmol/L dNTPs,2.0 μmol/L 4对引物各1.0 μL,Taq酶2.5 U,加ddH2O至50 μL。对多重PCR的退火温度、引物浓度和Mg2+浓度 进行优化。PCR反应产物用1.5%琼脂糖凝胶电泳检测。
1.2.5多重PCR反应特异性试验: 分别以4种细菌基因组DNA的混合样本、单一样本及其他阴性菌的DNA样本为模板,同时加入4对引物,用优化后的反应体系及条件进行多重PCR扩增。
1.2.6多重PCR反应敏感性试验: 将提取的4种标准菌的DNA模板浓度稀释至100 ng/μL浓度。按100~10-9ng/μL梯度进行倍比稀释,以优化后的多重PCR条件进行扩增,测定多重PCR反应的灵敏性。
1.2.7多重PCR的初步应用: 42只4周龄昆明小鼠被随机分为7组(1~7),每组6只,分别腹腔注射鼠伤寒沙门氏菌(0.5 mL);铜绿假单胞菌(0.5 mL);肺炎克雷伯杆菌+嗜肺巴斯德菌+铜绿假单胞菌+鼠伤寒沙门氏菌(每种菌0.12 mL);嗜肺巴斯德菌+铜绿假单胞菌(每种菌0.25 mL);鼠伤寒沙门氏菌+铜绿假单胞菌(每种菌0.25 mL);嗜肺巴斯德菌+ 鼠伤寒沙门氏菌+肺炎克雷伯杆菌(每种菌0.17 mL);另设生理盐水(0.5 mL)作为阴性对照组。7组小鼠饲养在ABSL-2生物安全实验室负压IVC内,并在生物安全柜内进行感染操作。观察其发病及死亡情况,饲养10 d后,将7组小鼠解剖,无菌采集其肝、肺、肠等部位,并置于肉汤中进行过夜培养,所获得的菌液作为模板,按照前述提取细菌DNA,采用已优化好的多重PCR方法进行检测。
2 结果
2.1 单重PCR扩增结果
分别以SE、KPN、PP、PA的基因组DNA为模板,在不同的退火温度下进行单一PCR反应。凝胶电泳检测结果显示:在不同的退火温度下,SE、KPN、PP、PA均能扩增出相应分子量大小的目的片段(分别为284 bp、428 bp、198 bp和528 bp),且无其他非特异性条带,其中嗜肺巴斯德杆菌和绿脓杆菌在退火温度高于59.5 ℃时扩增效率降低,片段变弱;绿脓杆菌则在低于54.0 ℃扩增效率降低;而对另外两种菌的扩增效率无明显影响。因此最终确定单基因PCR扩增的最佳退火温度为 54.0~59.5 ℃(图1)。
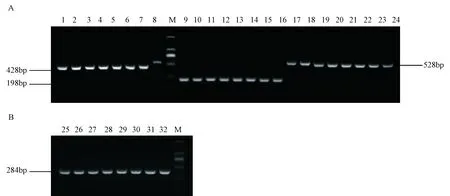
图1 单重PCR扩增及退火温度的优化注:M:DL2000 marker;1~8肺炎克雷伯杆菌;9~16嗜肺巴斯德菌;17~24绿脓杆菌;25~32鼠伤寒沙门氏菌;退火温度从1~8,9~16,17~24,25~32依次为45.8 ℃, 48.4 ℃, 51.5 ℃, 54.0 ℃, 56.8 ℃, 59.5 ℃, 62.1 ℃, 64.5 ℃Fig.1 Single PCR products and optimal annealing temperatureNote:M: DNA Marker DL2000;1-8 Klebsiella Pneumoniae;9-16 Pasteurella pneumotropica;17-24 Pseudomonas Aeruginosa;25-32 Salmonella typhimurium; Annealing temperatures were 45.8 ℃, 48.4 ℃,51.5 ℃, 54.0 ℃, 56.8 ℃, 59.5 ℃, 62.1 ℃, 64.5 ℃.
2.2 多重PCR反应条件的优化
以SE、KPN、PP、PA的混合DNA为模板进行扩增,分别对多重PCR的退火温度、引物浓度和Mg2+浓度进行优化。结果表明,退火温度在59.5~64.5 ℃时,4条目的条带均最清晰,确定为最佳温度范围(见图2);引物浓度在5~10 pmol/μL时最佳(见图3);Mg2+浓度在2~4 m mol/L时最佳(见图4)。因此,确定同时检测4种目的菌的多重PCR方法的最佳反应体系如下:10×PCR buffer 5 μL,3 μL MgCl2(1 mol/L),2 μL dNTP(2.5 mmol/L),2.0 μmol/L 4对引物各0.75 μL,Taq酶1 U,加ddH2O至50 μL。PCR反应程序:95 ℃预变性5 min,94 ℃变性30 s,62.1 ℃退火30 s,72 ℃延伸30 s,34个循环;72 ℃延伸10 min。此优化后的多重PCR反应体系在后续的特异性实验中得到进一步的验证,如图5(B)。

图2 多重PCR退火温度优化注:M:DL2000 marker;1 阴性对照;2~9退火温度依次为64.5 ℃、62.1 ℃、59.5 ℃、56.8 ℃、54.0 ℃、51.5 ℃、48.4 ℃、45.8 ℃Fig.2 The optimal annealing temperature in multiplex PCRNote:M:DNA Marker DL2000;1 Negtive control; 2-9 Annealing temperatures were 64.5 ℃, 62.1 ℃, 59.5 ℃, 56.8 ℃,54.0 ℃ 51.5 ℃, 48.4 ℃, 45.8 ℃

图3 多重PCR引物浓度优化注:M:DL2000 marker;1:阴性对照;2~8:不同引物浓度优化,引物浓度依次为35、20、15、10、8、5、2 pmol/μLFig.3 The optimal primer concentration used in multiplex PCRNote:M:DNA Marker DL2000;1:Negtive contral;2-8: Primers concentrations were 35, 20, 15, 10, 8, 5, 2 pmol/μL
2.3 多重PCR的特异性
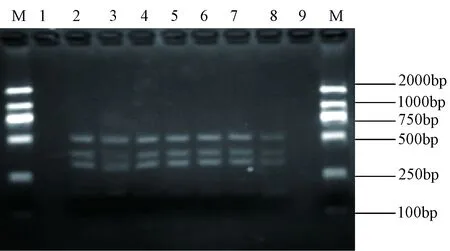
图4 多重PCR 镁离子浓度优化注: M:DL2000 marker;1:阴性对照;2~9:不同Mg2+浓度依次为5、4.5、4、3.5、3、2、1、0.5 mmol/LFig.4 The optimal Mg2+ concentration used in multiplex PCRNote:DNA Marker DL2000;1:Negtive contral;2-9: Mg2+concentration were 5, 4.5, 4, 3.5, 3, 2, 1, 0.5 mmol/L
分别对SE、KPN、PP、PA的基因组DNA混合模板、单一模板、其他阴性菌模板及空白对照进行PCR扩增,结果见图5。由图可知,所建立的PCR能有效地同时检测本研究所涉及的4种致病菌中的一种或多种,表明所建方法特异性良好。
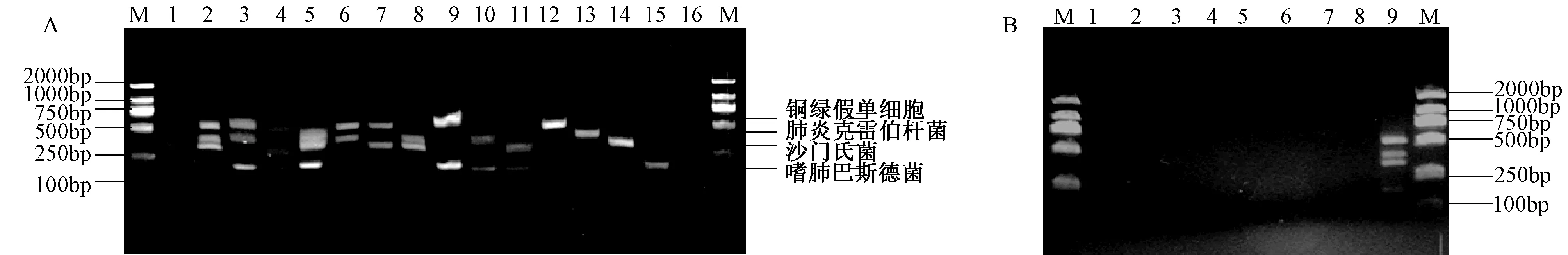
图5 多重PCR特异性试验结果 图5(A)M:DL2000 Marker;1:嗜肺巴斯德菌、鼠伤寒沙门氏菌、肺炎克雷伯杆菌、 绿脓杆菌四种菌模板;2:鼠伤寒沙门氏菌、肺炎克雷伯杆菌、绿脓杆菌三种菌模板;3:嗜肺巴斯德菌、肺炎克雷伯杆菌、 绿脓杆菌三种菌模板;4:嗜肺巴斯德菌、鼠伤寒沙门氏菌、 绿脓杆菌三种菌模板;5:嗜肺巴斯德菌、鼠伤寒沙门氏菌、肺炎克雷伯杆菌三种菌模板;6:肺炎克雷伯杆菌、 绿脓杆菌两种菌模板;7:鼠伤寒沙门氏菌、 绿脓杆菌两种菌模板;8:鼠伤寒沙门氏菌、肺炎克雷伯杆菌两种菌模板;9:嗜肺巴斯德菌、 绿脓杆菌两种菌模板;10:嗜肺巴斯德菌、肺炎克雷伯杆菌两种种菌模板;11:嗜肺巴斯德菌、鼠伤寒沙门氏菌两种菌模板;12:绿脓杆菌单模板;13:肺炎克雷伯菌单模板;14:鼠伤寒沙门氏菌单模板;15:嗜肺巴斯德菌单模板;16:阴性对照;图5(B)M:DL2000 Marker;1:金黄色葡萄球菌;2:肺炎链球菌;3:乙型溶血性链球菌;4:李斯特杆菌;5:支气管鲍特杆菌;6:鼠棒状杆菌;7:大肠埃希杆菌;8:志贺杆菌;9:嗜肺巴斯德菌、沙门氏菌、肺炎克雷伯杆菌、 绿脓杆菌Fig.5 The specificity of multiplex PCR A:DNA Marker DL2000; 1: Pasteurella pneumotropica,Salmonella typhimurium, Klebsiella Pneumoniae, Pseudomonas Aeruginosa mix template;2: Salmonella typhimurium, Klebsiella Pneumoniae, Pseudomonas Aeruginosa mix template; 3: Pasteurella pneumotropica, Klebsiella Pneumoniae, Pseudomonas Aerugino mix template; 4: Pasteurella pneumotropica, Klebsiella Pneumoniae, Pseudomonas Aeruginosa mix template;5:Pasteurella pneumotropica,Salmonella typhimurium,Klebsiella Pneumoniae mix template; 6:Klebsiella Pneumoniae,Pseudomonas Aeruginosamix template; 7:Salmonella typhimurium, Pseudomonas Aeruginosa mix template; 8:Salmonella typhimurium, Klebsiella Pneumoniae mix template;9:Pasteurella pneumotropica,Pseudomonas Aeruginosa mix template; 10:Pasteurella pneumotropica,Klebsiella Pneumoniae mix template;11: Pasteurella pneumotropica,Salmonella typhimurium mix template; 12:Pseudomonas Aeruginosa template; 13:Klebsiella Pneumoniae template;14:Salmonella Spp template; 15:Pasteurella pneumotropica template; 16:Negative control B:DNA Marker DL2000; 1:Staphylococcus aureus; 2:Streptococcus pneumonia; 3:Beta hemolytic streptococcus; 4:Liszt bacillus;5:Bordetella bronchiseptica; 6:Corynebacterium kutscheri; 7:Escherichia coli; 8:Shiga bacillus; 9: Pasteurella pneumotropica,Salmonella typhimurium, Klebsiella Pneumoniae, Pseudomonas Aeruginosa
2.4 多重PCR的敏感性
将相同浓度的4种菌混合后10倍梯度稀释,采用已经优化好的多重PCR反应体系进行扩增。结果表明,所建立的多重PCR对鼠伤寒沙门氏菌、肺炎克雷伯杆菌、嗜肺巴斯德菌、铜绿假单胞菌最低检出量分别为 10-5、10-4、10-3、10-4ng/μL,可得到多重PCR的最低检出量为10-3ng/μL,见图6。
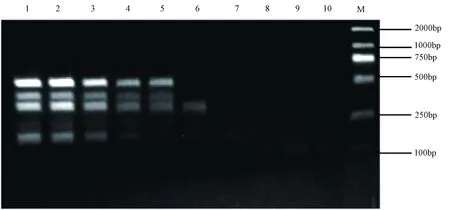
图6 多重PCR灵敏性检测注:M:DL2000 Marker;1~10依次模板浓度为:100、10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9ng/μLFig.6 The sensitivity test of the multiplex PCRNote:DNA Marker DL2000;1-10 Primer concentration were 100, 10-1, 10-2, 0-3, 10-4, 10-5, 10-6, 10-7, 10-8, 10-9ng/μL
2.5 多重PCR的初步应用
采用4种致病菌单一或者混合感染昆明小鼠,其中细菌感染组的小鼠在24~72 h内均有2~3只死亡,及时将其装入无菌封口袋后放入-20 ℃冰箱保存,而生理盐水对照组的小鼠全部存活。试验结束后将剩余存活的动物采样后处以二氧化碳安死术,无菌操作获取小鼠肝、肺、肠等组织后进行肉汤培养并提取DNA,按照已优化好的多重PCR方法进行扩增。结果如图7:每份细菌感染组的样本均扩增出了对应的特异条带,而生理盐水对照组无扩增条带,证明建立的多重PCR方法可应用于临床检测,见图7。
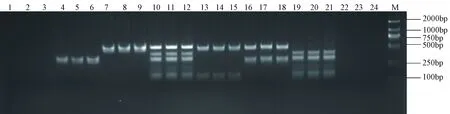
图7 人工模拟试验多重PCR检测结果注:M:DL2000 Marker;1~3、22~24: 阴性对照;4~6:鼠伤寒沙门氏菌;7~9:绿脓杆菌;10~12:嗜肺巴斯德菌、鼠伤寒沙门氏菌、肺炎克雷伯杆菌、 绿脓杆菌四种菌;13~15:嗜肺巴斯德和绿脓杆菌;16~18:鼠伤寒沙门氏菌和绿脓杆菌;19~21:嗜肺巴斯德菌、鼠伤寒沙门氏菌、肺炎克雷伯杆菌三种菌Fig.7 The artificial simulation test of the multiplex PCR assayNote:DNA Marker DL2000;1-3, 22-24: Negtive contral;4-6: Salmonella typhimurium;7-9: Pseudomonas Aeruginosa;10-12: Pasteurella pneumotropica,Salmonella typhimurium,Klebsiella Pneumoniae and Pseudomonas Aeruginosa;13-15: Pasteurella pneumotropica and Pseudomonas Aeruginosa;16-18: Salmonella typhimurium and Pseudomonas Aeruginosa;19-21: Pasteurella pneumotropica,Salmonella typhimurium and Klebsiella Pneumoniae
3 讨论
多重PCR能够在一个反应体系中同时检测多种病原微生物,以其快速、准确、低成本等优势在多个检测领域中得到广泛的应用,尤其在实验动物的微生物质量控制过程中,具有极高的应用价值。然而,多重PCR并不是单纯的混合体系反应,在检测过程中会受到多种因素的制约影响:首先,引物设计是多重PCR反应是否成功的关键[9],各引物对必须高度特异,避免非特异扩增。本研究在前人单重PCR研究的基础上,选取编码鼠伤寒沙门氏菌侵袭蛋白的invA基因[10]、编码肺炎克雷伯杆菌体外溶血酵素的khe基因[11]以及铜绿假单胞菌的内标基因Ecfx基因[12]和嗜肺巴斯德的16SrRNA基因[13]作为目的基因,在其高度保守区设计引物,建立多重PCR体系,结果显示所设计多对引物的特异性较好;其次,退火温度、引物浓度、镁离子浓度等为影响PCR的重要因素,多重PCR体系由于存在多对引物、多个模板因而更加复杂,基于此,本研究通过实验优化多重PCR反应的条件后,最终确定多重PCR的最佳退火温度为59.5 ℃,最佳引物浓度6 pmol/μL,最佳镁离子浓度3 mmol/L;此外,本实验中的多重PCR能检测沙门氏菌、肺炎克雷伯杆菌、嗜肺巴斯德菌、铜绿假单胞菌最低检出量为10-3ng/μL,说明该方法具有较高的敏感性。在实际样本检测过程中,一般采取适当的增菌来获得足量的、杂质含量少的菌量,同时降低由于检测灵敏度较高而扩增造成假阳性的可能,本实验的初步应用通过将小鼠的组织样本浸润在致病菌相应的液体培养基中进行过夜振荡增菌(约16 h)培养获得足量的菌量,以减少出现假阳性结果。
综上所述,本试验建立的多重PCR方法具有快速、准确、简便、灵敏、稳定性高等优点,具有较高的实际应用价值,为SPF级实验动物沙门氏菌、肺炎克雷伯杆菌、嗜肺巴斯德菌、铜绿假单胞菌的常规监测、感染早期诊断、新种源引进的隔离检疫等提供了新的快速检测方法。

