拟南芥突变体jar1的鉴定及其MeJA感受性分析
乔菊香 杨红玉 吴 嘉 彭 浈 沈 放 周丽娟 王云月
(1.云南农业大学植物保护学院,生物多样性与病害控制教育部重点实验室,云南 昆明 650201;2.昆明学院生命科学与技术系,云南 昆明 650214)
以茉莉酸 (JA)、茉莉酸甲酯 (MeJA) 和茉莉酸异亮氨酸 (JA-Ile) 为代表的茉莉酸类化合物是一类广泛存在于植物体内的植物激素和信号化合物[1-2]。茉莉酸类化合物在调节植物生长发育和参与植物对生物及非生物胁迫的抗性反应过程中发挥着重要作用[3-4]。茉莉酸的合成起始于亚麻酸,在随后的JA信号转导反应中,JA通过与L-异亮氨酸结合而被激活,此反应由JAR1 (JasmonateResistant1) 基因编码的JA氨基合成酶催化[5]。JAR1基因发生突变导致JA信号级联传递受阻。经甲基磺酸乙酯 (EMS) 诱变的jar1-1拟南芥突变体出现雄性育性受损,对真菌病原物、害虫和臭氧等胁迫的抗性下降[6-9 ]。在了解茉莉酸信号转导途径所调控的生物学反应机制研究中,jar1 (jasmonate-insensitivemutant1)突变体是一个重要的实验材料。T-DNA插入导致基因失活,整合的拷贝数较低,能够稳定遗传给后代,适于反向遗传学分析。本研究从拟南芥生物资源中心 (ABRC) 购买了JAR1 (At2g46370) 的T-DNA 插入突变体jar1(SALK_030821)。利用 “三引物” PCR方法,鉴定了此材料的突变位点及其纯合性。通过qRT-PCR,测定了纯合突变体jar1中JAR1基因的表达量,并通过茉莉酸敏感性试验加以验证。本研究结果为进一步了解茉莉酸信号途径的分子机制提供参考。
1 材料与方法
1.1 供试材料
野生型拟南芥 (Arabidopsisthaliana) 为Columbia (Col-0) 生态型。At2g46370的T-DNA插入突变体jar1 (SALK_030821) 的种子购买自拟南芥生物资源中心。
1.2 供试材料培养
种子用5%的次氯酸钠消毒5~10 min,无菌水冲洗3~5次,点播在MS固体培养基上,parafilm膜封口,置于4 ℃冰箱中低温春化2~3 d。移至光照12 h/d、22 ℃的光照培养箱中培养。7 d后将幼苗移栽到装有V(营养土)∶V(蛭石) 为2∶1的小盆中培养,用透明的塑料薄膜封口后放入培养室中培养,2~3 d后揭开薄膜。用于茉莉酸甲酯敏感性实验的拟南芥种子播于含有28 μmol/L茉莉酸甲酯的MS培养基上进行垂直培养,观察根的生长情况。培养室的培养条件:光照强度约50 μmol/(m2·s),光照12 h/d,相对湿度60%~70%,温度22~23 ℃。
1.3 基因组 DNA提取
本实验基因组DNA提取使用Edwards法[10]提取。从拟南芥植株上取1~2片新鲜的叶片置于1.5 mL灭菌离心管中研磨成匀浆;加入400 μL的Edwards提取液继续研磨,混匀后常温12 000 r/min离心5 min;上清液转移到新的1.5 mL灭菌离心管中,加入500 μL异丙醇混匀,-20 ℃放置5~10 min;室温12 000 r/min离心5 min;弃上清,沉淀用70%的乙醇洗1次;弃上清,室温干燥10~15 min;溶于20~50 μL的灭菌水中,-20 ℃保存备用。
1.4 纯合突变体的鉴定
以所提取植株的基因组DNA为模板,参照李敏等[11]的方法,进行 “三引物法” 的PCR扩增。PCR所用引物出自SIGnAL (http://signal.salk.edu/tdnaprimers.2.html)。SALK_030821的鉴定引物为:LP:5′-CTCGGAAATTCAAATGGATCC-3′ RP:5′-TAGAATCGGCTGCAAAGAGAC-3′;T-DNA左边界引物为LBa1:5′-TGGTTCACGTAGTGGGCCATCG-3′。引物由生工生物工程 (上海) 有限公司合成。
1.5 荧光实时定量RT-PCR
利用TRIzol法提取总RNA,用分光光度计 (BioDrop) 进行浓度和OD260/OD280,OD260/OD230的测定,并用琼脂糖凝胶电泳检测RNA样品的完整性。按照PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time) (TaKaRa) 说明书方法去除RNA样品中所含的基因组DNA以及cDNA链的合成。使用荧光定量仪eppedorf Mastercycler®ep realplex和荧光定量试剂SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus) (TaKaRa)进行荧光定量qRT-PCR检测。以ACTIN2基因作为内参,每个样品做3次重复。JAR1基因的引物序列为:5′-CGATGTCTCGACAGATCC-3′和5′-CTCGGTCTAAACAGT-TGCAG-3′;ACTIN2的引物序列为:5′-ACCGTTT-CGCTTTCCTTAGTGTTAGCT-3′和5′-AGCGAACGGATCTAGAGACTCACCTTG-3′。引物由生工生物工程 (上海) 有限公司合成。
2 结果与分析
2.1 T-DNA插入位点及其纯合性鉴定
拟南芥JAR1基因的T-DNA插入突变体jar1 (SALK_030821) 为正向插入突变体,插入位点位于第5个外显子上 (图1)。使用JAR1正向引物 (LP) 及反向引物 (RP) (图1),分别以jar1突变体和野生型植株的基因组DNA为模板,进行PCR扩增,预期条带为1 056 bp。结果显示只有野生型植物出现预期的PCR产物 (图2)。
用T-DNA的左边界引物LBa1与JAR1基因反向引物RP配对,以jar1突变体和野生型植物的基因组DNA为模板,进行PCR扩增,预期的产物为529~829 bp。结果表明,jar1突变体出现预期的DNA条带,而野生型中没有相应的DNA条带 (图2)。说明1~7号植株基因组中T-DNA插入的位点正确,且均为T-DNA插入的纯合突变体。将鉴定出的纯合突变体单株收种,扩繁保存。
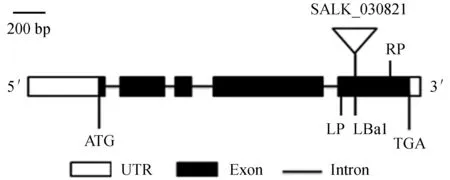
LP.T-DNA插入突变的左端引物;RP.T-DNA插入突变的右端引物;LBa1.载体特异性引物。
图1JAR1基因结构、突变及其验证引物示意
Fig.1 Sketch ofJAR1 gene structure,mutant position and its validation PCR primers

LP.T-DNA插入突变的左端引物;RP.T-DNA插入突变的右端引物;LBa1.载体特异性引物。
图2jar1突变体PCR鉴定
Fig.2 PCR detection ofjar1 mutants
2.2 纯合突变体中JAR1基因表达量分析
利用荧光实时定量qRT-PCR技术,对jar1纯合突变体植株中JAR1基因的表达量进行分析。发现jar1中JAR1基因的表达量降低至野生型植株的41.2% (图3),结果表明,T-DNA的插入导致jar1纯合突变体中JAR1基因的表达量显著下降 (P< 0.05)。

小写字母不同表示差异显著。
图3野生型和jar1突变体中JAR1基因的表达量
Fig.3 Expression ofJAR1 gene in wild type andjar1 mutant plants
2.3 突变体对茉莉酸的敏感性实验
野生型与jar1根对茉莉酸甲酯的感受性检测见图4。

大写字母不同表示差异极显著。
a.野生型幼苗在不含MeJA的MS培养基上的根生长情况;
b.野生型幼苗在含28 μmol/L MeJA的MS培养基上的根生长情况;
c.jar1幼苗在不含MeJA的MS培养基上的根生长情况;
d.jar1幼苗在含28 μmol/L MeJA的MS培养基上的根生长情况;
e.野生型与jar1突变体根生长长度。
图4野生型与jar1根对茉莉酸甲酯的感受性检测
Fig.4 Response of wild type andjar1 seedling to MeJA treatment
JAR1蛋白在植物防御生物和非生物胁迫反应过程中发挥着重要作用。JAR1基因突变后,拟南芥植株对茉莉酸的感受性降低。利用茉莉酸甲酯会抑制拟南芥根的正常生长特性[12],将拟南芥种子点播在含有MeJA的MS培养基上,以点播在不含MeJA的MS培养基上为对照。通过垂直培养,观察幼苗根的生长情况,以了解突变体对茉莉酸的响应变化。将jar1的纯合突变体和野生型种子经消毒后点播于含有28 μmol/L茉莉酸甲酯的MS培养基上,在组培室垂直培养20 d,发现野生型幼苗生长受到严重抑制,而jar1突变体幼苗的生长受抑制程度显著低于野生型的,即其根长明显长于野生型 (图4)。结果表明,JAR1基因表达量的下调导致jar1纯合突变体对茉莉酸甲酯的敏感性降低。
3 结论与讨论
通过实验,鉴定得到了拟南芥JAR1基因的T-DNA插入纯合突变体jar1。通过对其插入位点进行分析发现,T-DNA位于第5个外显子上。qRT-PCR以及茉莉酸感受性结果分析显示,纯合突变体jar1中JAR1基因的表达量降低为野生型植株的41.2%,并且突变体幼苗对茉莉酸的敏感性显著降低。
茉莉酸类化合物作为植物激素及信号分子涉及多种关键的功能,包括对病原体和昆虫的防御、防止臭氧和涝害等的损害,以及调节植物的生长发育等。JAR1基因影响茉莉酸类化合物的合成,并且其作为一个信号中间体,参与茉莉酸信号途径的调控[5]。实验中获得的拟南芥JAR1基因的突变体对MeJA的敏感性降低,表明其影响茉莉酸信号的转导。
研究发现,在根生长抑制测定中,JAR1基因的一些EMS诱变突变体,如jar1-1,jar1-8和jar1-11对MeJA表现出中等敏感性[13]。Staswick等[14]在研究突变体jar1对外源MeJA敏感性时发现,野生型植株在含有100 μmol/L的MeJA的培养基中生长9 d,根的生长受到强烈抑制,然而,同样条件下jar1突变体根的受抑制程度显著降低,说明对MeJA具有抗性。此外,在没有MeJA的情况下,突变体幼苗根的生长与野生型相当。本实验发现在不存在外源茉莉酸的情况下,jar1根的发育没有受到明显影响。当在MS培养基中加入28 μmol/L的MeJA后,其根伸长受到抑制,但与同样生长在MeJA培养基中的野生型相比较,jar1的根长显著长于野生型,此结果与Staswick等人的研究结果一致。表明JAR1不直接参与正常的根生长,但是影响对外源MeJA的敏感性。
大量的研究结果显示,插入位点位于外显子上的T-DNA插入突变体会导致目的基因表达量的下降。李琳琳等在研究拟南芥干旱敏感突变体时,通过分析拟南芥AT2G06025基因的T-DNA插入突变体发现,其插入位点位于第7个外显子上,并且在突变体中基因的表达量明显低于野生型[15]。李斯琪等通过分析拟南芥DUF647蛋白家族成员AT2G23470的T-DNA插入突变体发现,其获得的位于第2个外显子上的T-DNA插入突变体为基因表达完全缺失突变体[16]。本研究的植物材料jar1突变体的T-DNA插入位点位于第5个外显子上,影响了该基因的正常转录,导致JAR1基因的表达显著下调,最终可能导致部分翻译提前终止,从而使突变体幼苗对茉莉酸甲酯的感受性显著降低。该jar1可作为信号转导突变体用于茉莉酸信号转导途径的分析。

