重楼法定基原与其同属近缘种的多重PCR鉴别体系研究
张开元,饶文霞,尹显梅,陈 蓉,崔 欣,唐 卓*,尹鸿翔
1成都中医药大学药学院,成都 611137,2中国科学院成都生物研究所天然产物中心,成都 610041; 3成都中医药大学民族医药学院,成都 611137
中药重楼,来自百合科(Liliaceae)重楼属(ParisL.)多年生草本植物。其中,七叶一枝花(ParispolyphyllaSmith var.chinensis(Franch.)Hara)与云南重楼(P.polyphyllaSmith var.yunnanensis(Franch.)Hand.-Mazz.)的干燥根茎被历版《中国药典》作为正品收载。重楼药用历史悠久,以“蚤休”之名始载于《神农本草经》,具有清热解毒,消肿止痛,凉肝定惊之功效,可用于疔疮痈肿,咽喉肿痛,蛇虫咬伤,跌扑伤痛,惊风抽搐的治疗[1],是很多著名中成药如云南白药、宫血宁胶囊、抗病毒颗粒等的重要原料。
经过课题组前期对我国西南地区重楼人工种植基地的考察发现,由于重楼栽培正处于野生变家种的阶段,种苗的生产和贸易缺乏行业规范,来源混乱,人工栽培品种除七叶一枝花(P.polyphyllavar.chinensis)与云南重楼(P.polyphyllavar.yunnanensis)之外,还包括多叶重楼(P.polyphyllavar.polyphylla),狭叶重楼(P.polyphyllavar.stenophylla),南重楼(P.vietnamensis),五指莲(P.axialisvar.axialis),平伐重楼(P.vaniotii),球药隔重楼(P.fargesii),黑籽重楼(P.thibeticavar.thibetica),长柱重楼(P.forrestii)等多个近缘类群,品种十分混乱。而重楼以根茎入药,根据性状及显微等特征难以对正品及其近缘混用种药材进行有效区分,这给中医处方和中成药的质量控制方面带来了极大的安全隐患[2]。因此,对正品重楼及其混用近缘种进行有效区分,在药材生产和贸易中建立一种快速、准确的鉴别方法,对于重楼的用药安全、质量控制以及重楼属中濒危种群的保护都有着十分重要的意义。
随着分子生物学迅速发展,植物在DNA水平上的多样性研究取得突破性进展,用于药用植物的分子鉴定技术也日渐成熟[3]。对于重楼这一基原复杂的中药,商品药材的真伪鉴定工作既要实现药典法定种和多个混用种的区分,又要兼顾2个药典法定种的同时鉴别,另外还要避免云南重楼2个基因型导致的“假阴性”结果。然而,仅凭“1对引物”的普通PCR方法,将会需要3次PCR才能完成一份样品的鉴别,显然效率低、成本高。为了解决这一问题,本研究选择rDNA-ITS作为鉴别序列,并将3对特异性引物集成到一个PCR体系中,仅需一次PCR即可实现上述鉴定效果,从而建立了对药典法定重楼基原与其混用近缘种进行快速鉴别的多重PCR鉴别体系。
1 材料
1.1 药材样品
本次实验材料包括七叶一枝花34份,云南重楼65份,多叶重楼17份,狭叶重楼10份,南重楼8份,五指莲重楼5份,平伐重楼7份,球药隔重楼22份,黑籽重楼13份,长柱重楼3份。实验材料样本采集地等详细信息见表1。样品经成都中医药大学尹鸿翔副教授鉴定,保存于成都中医药大学民族医药学院实验室。
1.2 试剂
琼脂糖(广州赛国生物科技有限公司),Goldview I型核酸染色剂(北京索莱宝科技有限公司),EasyTaq DNA polymerase,10× EasyTaq Buffer(Mg2+plus)(北京全式金生物技术有限公司),DNAMarker -B,dNTPs Mixture Solution (生工生物工程股份有限公司),植物组DNA提取试剂盒(成都福际生物技术有限公司),α-高聚淀粉酶(思科生物科技有限公司)。

表1 实验样本信息Table 1 Sample information of Paris
续表1(Continued Tab.1)

样品名称Sample name采集地点Source部位Part份数Sample quantity样品名称Sample name采集地点Source部位Part份数Sample quantity贵州长顺叶2贵州长顺叶2∗四川石棉叶1贵州安顺叶2∗四川彭州叶2贵州六枝叶7∗球药隔重楼(Q)P.fargesii四川崇州叶6四川石棉叶4四川平武叶1四川会理叶1四川大邑叶1四川大邑叶3∗四川彭州叶7四川彭州叶3∗江西黄洋界叶1四川彭州叶3湖南双牌叶2四川盐源叶、根茎2湖北来凤叶、根茎3四川盐边叶、根茎2贵州水城叶1云南腾冲叶4黑籽重楼(HZ)P.thibetica var.thibetica四川大邑叶1云南金平叶1∗四川平武叶1云南耿马叶2∗四川安县叶2云南普洱叶2四川北川叶2云南普洱叶2∗四川彭州叶2云南宣威叶8四川崇州叶2多叶重楼(DY)P.polyphylla var.polyphylla四川崇州叶1四川峨眉山叶2四川雅安叶1甘肃文县叶1四川普格叶1长柱重楼(CZ)P.forrestii云南腾冲叶、根茎3
注:云南重楼样品有“*”标识的为基因型II,未有标识的为基因型I。
Note:P.polyphyllavar.yunnanensissamples of genotype II were marked with "*",while samples of genotype I were unmarked.
1.3 仪器
Legend Micro 21R 离心机(美国 Thermo),BSA124S 分析天平(Sartorius科学仪器有限公司),MK-10干式恒温器(杭州奥盛仪器有限公司),PCR仪(杭州博日科技有限公司),DDY-12电泳系统(北京六一仪器厂),激光成像仪Typhoon 7000(通用电气医疗集团生命科技部),微量紫外-分光光度仪(Thermo Nanodrop 2000)。
2 方法
2.1 基因组DNA提取
叶片样品硅胶干燥,取30 mg,用植物组DNA提取试剂盒提取总DNA。根茎样品研粉,过3号筛,取20 mg粉末,按照植物组DNA提取试剂盒说明书进行改进,加蛋白酶的同时添加20 μL的75% α-高聚淀粉酶提取总DNA,-4 ℃保存。DNA提取物用通用引物ITS-4/ITS-L[4]进行PCR扩增,扩增产物取7.5 μL,采用3%的琼脂糖凝胶电泳成像和微量紫外-分光光度仪验证DNA质量。通用引物序列见表2。
2.2 ITS测序及特异性引物设计与筛选
在多重PCR鉴别体系中,多对特异性引物的设计是最为关键的技术环节。用通用引物ITS-4/ITS-L对提取的重楼样品DNA模板进行ITS序列扩增,每个样品平行扩增3次,扩增产物送成都擎科梓熙生物科技有限公司进行测序。用Megalign软件对测序结果进行序列校对与分析,找出具有稳定差异的SNP位点,用Pirmer permier 5.0软件在七叶一枝花和云南重楼的特有SNP位点区域分别设计特异性引物,并用设计的引物对重楼样品DNA模板进行PCR扩增,筛选出特异性好,能够准确区分两个法定品种并能有效鉴别其他常见伪品的引物。
2.3 重楼多重PCR扩增体系的建立
PCR反应体系总体积25 μL,其中包括10×EasyTaq Buffer 2.5 μL,dNTPs mixture 280 μM,引物对H-F/H-R用量0.15/0.2 μM,引物对YN-IF2/YN-IR2用量0.25/0.15 μM,引物对YN-IIF3/YN-IIR21用量0.2/0.25 μM,EasyTaq DNA polymerase 1.5 U,模板DNA 30 ng,无菌双蒸水补充体系至25 μL。PCR反应参数:94 ℃预变性5 min,94 ℃变性30 s,64 ℃退火30 s,72 ℃延伸30 s,27个循环后,72 ℃延伸5 min,12 ℃保存。PCR 扩增反应结束后,取PCR反应产物7.5 μL,加6×Loading buffer混匀后,于Goldview I染色的3%的琼脂糖凝胶电泳检测,220 V电压下电泳20 min,凝胶成像系统下观察并拍照保存。
3 结果
3.1 模板质量
采用通用引物ITS对本实验所有的模板DNA进行扩增,均得到约700 bp左右的扩增条带,表明本实验的模板DNA质量符合PCR扩增要求。
3.2 法定基原重楼ITS序列的SNP位点分析及引物设计
在对65份不同产地的云南重楼样本的ITS序列进行分析时,发现依据SNP位点可以划分为2种基因型,二者在SNP上的多样性表现为40个位点,分别编号为:YN-I 和YN-II,基因型具体划分标准见表3。其中,YN-I型样本有35份,YN- II型样本有30份,为了避免漏检其中之一基因型,出现云南重楼检测的假阴性,需要同时设计两个引物对。设计并命名鉴别七叶一枝花的特异性引物对H-F/H-R,鉴别云南重楼基因型I、II的特异性引物对YN-IF2/YN-IR2,YN-IIF3/YN-IIR21。引物序列由擎科梓熙生物科技有限公司合成。三对特异性引物序列见表2。

表2 引物序列表Table 2 Primers used in this study

表3 云南重楼两类基因型的SNP位点特征Table 3 SNP site characteristics in two genotypes of P.polyphylla var.yunnanensis
3.3 多重PCR反应体系的建立及优化
3.3.1 最适引物浓度的考察
设置三对特异性引物H-F/H-R,YN-IF2/YN-IR2,YN-IIF3/YN-IIR21的不同浓度比例,见表4。考察不同引物浓度对PCR扩增反应的影响,筛选最适引物浓度。通过调整引物用量,在保证特异性条带亮度的同时削弱非特异性条带,并综合考虑节约引物用量,选择引物浓度比例E。保证七叶一枝花在210 bp有一条明亮条带,云南重楼基因型I(YN-I)在248 bp有一条明亮条带,云南重楼基因型II(YN-II)在149 bp有一条明亮条带,见图1。

表4 引物浓度优化条件Table 4 Optimal conditions of specific primers’ concentration
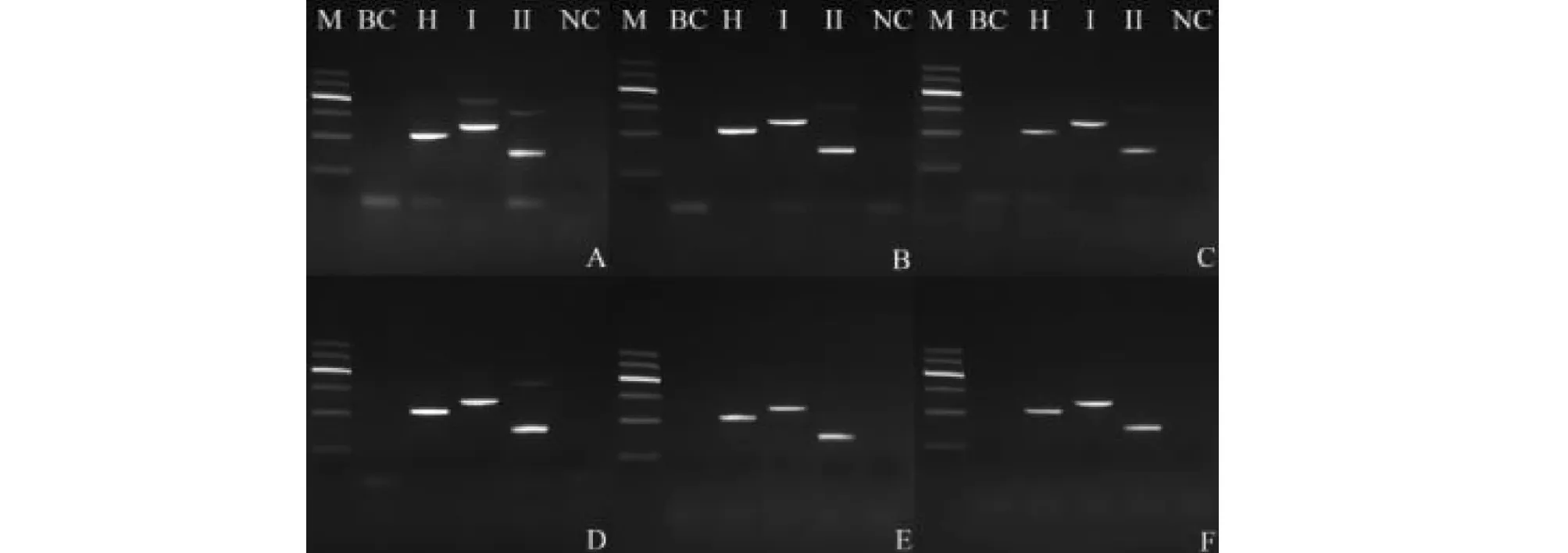
图1 多重PCR体系引物浓度考察电泳图Fig.1 Agarose gel electrophoresis of primers concentration investigation注:M:DNA Marker,从上至下依次为:600 bp、500 bp、400 bp、300 bp、200 bp、100 bp;BC为空白对照,H为七叶一枝花,I为云南重楼(基因型YN-I),II为云南重楼(基因型YN-II),NC为近缘种多叶重楼阴性对照,下同。图A、B、C、D、E、F中三引物对浓度比即为文中所述。Note:M:DNA Marker,from top to bottom,the following is:600 bp,500 bp,400 bp,300 bp,200 bp and 100 bp;BC is Blank control,H is P.polyphylla var. chinensis,I is P.polyphylla var.yunnanensis (YN-I),II is P.polyphylla var.yunnanensis (YN-II),NC is P.polyphylla var.polyphylla as the negative control,similarly hereinafter.The concentration of three specific primer pairs in figure A,B,C,D,E and F are as described in the article.
3.3.2 最适dNTP浓度的考察
dNTP浓度分别设置为120、200、280、400 μM,考察不同dNTP浓度对PCR扩增反应的影响,筛选最适dNTP浓度(图2)。结果表明,dNTP随浓度的增加,对多重PCR反应具有抑制作用。当dNTP浓度为120至280 μM时,可逐渐抑制非特异性条带的产生;当浓度高于280 μM时,则会开始对特异性鉴别条带产生抑制。因此,本研究选择dNTP浓度为280 μM。
3.3.3 最适Taq酶用量的考察
25μL体系中Taq酶用量分别设置为0.5、1.5、2.5、3.5 U,考察不同Taq酶用量对PCR扩增反应的影响,筛选最适Taq酶用量(图3)。结果表明,0.5至3.5 U的Taq酶均可扩增出特异性条带,当用量达到1.5 U以上时,三条特异性条带亮度较高,为了弱化非特异性条带的扩增,本研究选择Taq酶用量为1.5 U。

图2 多重PCR体系dNTP浓度考察电泳图Fig.2 Agarose gel electrophoresis of dNTP concentration investigation注:图A、B、C、D中dNTP浓度依次为120、200、280、400 μMNote:The concentration of dNTP in figure A,B,C and D are 120,200,280 and 400 μM

图3 多重PCR体系Taq酶用量考察电泳图Fig.3 Agarose gel electrophoresis of Taq polymerase dosage investigation注:图A、B、C、D中Taq酶用量依次为0.5、1.5、2.5、3.5 UNote:The dosage of Taq polymerase in figure A,B,C and D are 0.5,1.5,2.5 and 3.5 U
3.3.4 最适退火温度的考察
分别设置退火温度为60、62.4、64.3、66 ℃,考察不同退火温度对PCR扩增反应的影响,筛选最适退火温度(图4)。结果显示,温度的升高可提高反应的特异性,但当退火温度高达66 ℃时,特异性鉴别条带亮度较弱,YN-I的特异性条带甚至几乎无法扩增。因此,综合考虑退火温度对三对特异性引物扩增效率的影响,选择64 ℃为本体系的退火温度。

图4 多重PCR体系退火温度考察电泳图Fig.4 Agarose gel electrophoresis of annealing temperature investigation注:图A、B、C、D中退火温度依次为60、62.4、64.3、66 ℃Note:The annealing temperature in figure A,B,C and D are 60,62.4,64.3 and 66 ℃
3.3.5 最适循环数的考察
分别选用26、27、28、30和32个循环进行考察,考察不同循环数对PCR扩增反应的影响,筛选最适扩增循环次数(图5)。结果表明,26至32循环时均能扩增出三者的特异性鉴别条带。为保证结果的准确性及避免因循环数过多导致可能的非特异性条带扩增,选择为27个循环进行PCR反应。
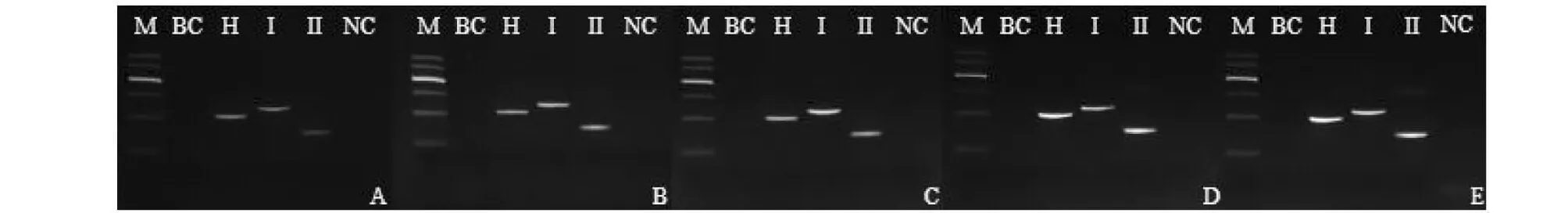
图5 多重PCR体系循环数考察电泳图Fig.5 Agarose gel electrophoresis of cycles investigation注:图A、B、C、D、E中循环数依次为26、27、28、30、32Note:The cycles in figure A,B,C,D and E are 26,27,28,30 and 32
3.3.6 模板量的考察
对反应体系中模板DNA的用量进行了考察,分别设置10、30、60、90 ng的模板DNA用量(图6)。结果表明,模板量在10~90 ng时均能扩增出特异性条带,且随着模板DNA的增加,扩增条带的亮度呈递增趋势。
具体优化结果见表5。

图6 多重PCR体系模板量考察电泳图Fig.6 Agarose gel electrophoresis of template quantity investigation注:图A、B、C中样品分别为H、I、II,每幅图中模板量依次为10、30、60、90 ngNote:The samples in figure A,B and C are H,I and II.The template quantities in each figure are 10,30,60 and 90 ng
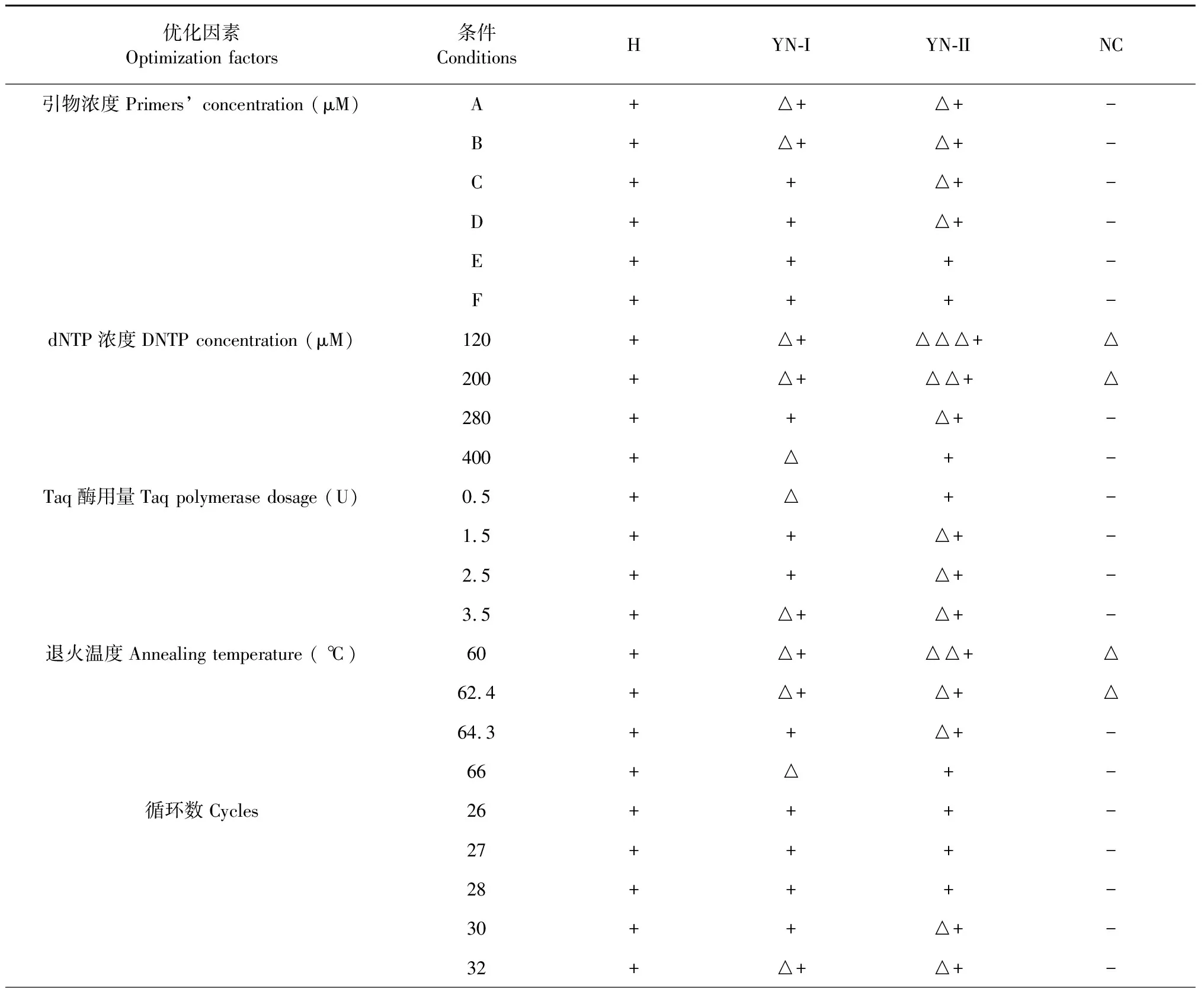
表5 多重PCR体系的优化Table 5 Optimization of multiplex PCR identification system
续表5(Continued Tab.5)

优化因素Optimization factors条件ConditionsHYN-IYN-IINC模板量Template quantity (ng)10+++-30+++-60+++-90+++-
注:“+”一条亮带,“△”一条暗带,“-”无条带。
Note:“+” one bright band,”△” one dark band,”-” no band.
3.4 多重PCR特异性鉴别结果
采用上述所确定的最佳反应体系和反应参数,用法定基原种及8种常见的同属近缘人工栽培品种对所建立的多重PCR鉴别体系进行方法适用性验证(图7)。结果显示七叶一枝花样本可扩增出片段大小为210 bp的特异性片段,云南重楼种下的两类基因型(YN-I 、YN-II)样本可分别扩增出248 bp和149 bp的特异性片段,同时得到了阳性鉴定,而其他同属近缘种无任何片段,避免了干扰,易于直观、准确的鉴别。

图7 法定基原种及其常见的8种同属近缘人工栽培种的多重PCR鉴别电泳图Fig.7 Agarose gel electrophoresis of legal origins and their 8 closely related species from cultivated investigation注:M:DNA Marker,BC为空白对照,H为七叶一枝花,I为云南重楼(YN-I),II为云南重楼(YN-II),DY为多叶重楼,XY为狭叶重楼,N为南重楼,WZL为五指莲,PF为平伐重楼,Q为球药隔重楼,HZ为黑籽重楼,CZ为长柱重楼。Note:M:DNA Marker,BC is Blank control,H is P.polyphylla var. chinensis,I is P.polyphylla var.yunnanensis (YN-I),II is P.polyphylla var.yunnanensis (YN-II),DY is P.polyphylla var.polyphylla,XY is P.polyphylla var.stenophylla,N is P.vietnamensis,WZL is P.axialis var. axialis,PF is P.vaniotii,Q is P.fargesii,HZ is P.thibetica var.thibetica,CZ is P.forrestii.
4 讨论
在多重PCR技术的适用性方面,该技术能够实现在单个反应管中一次性检测多个靶标的目的,相比普通PCR单个反应管中只能通过一对特异性引物检测单个靶标的反应更加高效、经济、快捷,在农作物[5-7]、动物[8,9]、微生物[10,11]和肿瘤细胞[12,13]等的鉴别中应用广泛,也逐渐应用到金钱白花蛇[14]、人参、西洋参、三七[15,16]等中药材的鉴别中。在靶序列的选择方面,朱英杰[17]等用6种DNA 条形码候选序列对重楼属11个物种不同序列的鉴定能力进行评价,发现ITS2序列与其他 DNA 条形码候选序列相比具有明显的优势。姜黎[4]等对重楼属8个物种4条DNA条形码候选序列进行考察,认为ITS序列能够鉴定重楼与其常见近缘种及饮片,显示ITS序列适宜作为重楼属下鉴定的靶序列。
在对65份云南重楼样品进行测序时发现,云南重楼序列的种内差异较大,根据ITS序列的SNP可分为两种类型。这也符合陈士林[18]《中药DNA条形码分子鉴定》中对4条长度为231bp的云南重楼DNA条形码ITS2参考序列对比发现有27个变异位点的表述。因此,本研究首次提出云南重楼应该区分为两类基因型:YN-I和YN-II,为了兼顾两类基因型的云南重楼药材的鉴别,避免假阴性结果,分别对两类基因型的云南重楼设计特异性引物。
建立多重PCR扩增体系,引物的设计至关重要,尤其是同属近缘种之间变异位点少,保证引物的特异性及引物之间相互不干扰是鉴别成功的关键[19]。本研究的引物的设计将针对重楼的法定基原七叶一枝花及两种基因型的云南重楼分别设计三对特异性引物。为了保证引物特异性,本研究把引物YN-IIR21的5′端第八位和第十二位引入了错配,将原本的核苷酸G和T突变为核苷酸T和A,把引物H-F的3′端第二位的核苷酸G突变为A,把引物H-R的3′端第二位的核苷酸T突变为A,并且所有特异性引物的Tm值相差在4以内,以保证扩增效率一致。另外,相对于单一引物对PCR体系,在建立多重PCR扩增体系时,不同引物对的浓度比是影响多重PCR 特异性和稳定性的关键因素,引物对之间存在相互竞争和互配关系,适宜的浓度比是多重PCR体系能稳定扩增的关键因素[20]。在多基原中药品种重楼同属近缘种繁多的情况下,确定多重引物的浓度是本研究成功的重点及难点,本方法是经过多次试验和条件优化而确定最佳反应体系。
为了保证样品基原的正确,本实验在原植物形态学鉴定的基础之上,对各样本ITS序列的单一PCR扩增产物进行回收测序,并进行Genebank数据库同源性比对分析,从而保证了样品基原的准确性,为实验结果的可靠性奠定了基础。
同属近缘种的混用情况一直是影响中药材质量的一个重要因素,由于其外观性状及显微结构相似,化学成分交叉重叠,导致鉴定困难[19],重楼作为典型的“同属多基原”品种更是如此。本实验首次建立了重楼药典法定基原与其同属近缘种的多重PCR鉴别体系,该方法特异性高,适用性强,只通过一次PCR扩增即可准确、快速、可靠地鉴别七叶一枝花和云南重楼这两种药典法定重楼基原,并且能兼顾两类基因型云南重楼药材,避免假阴性,在重楼药材和饮片的真伪鉴别,重楼人工栽培的种子种苗质量控制中值得推广和应用。

