核桃青皮化学成分及其抗肿瘤活性研究
殷田田,石伟峰,闫福林*
1新乡医学院三全学院药学院,新乡 453003; 2河南中杰药业有限公司,新乡 453000
核桃青皮,又称青龙衣,为胡桃科植物核桃(JuglansregiaL.)和核桃楸(J.mandshuricaMaxim.)的未成熟果皮[1]。我国核桃资源丰富,除河南外,在河北、山东、东北等省份都有分布。核桃青皮辛、苦、涩、有毒、微寒,具有清热、解毒、治痢、明目、抗肿瘤等作用,因而具有较大的医药应用价值[2]。但迄今为止,国内外学者对核桃青皮有效成分的系统研究不多,往往更关注经济价值最高的果实部分,而核桃外面的果皮部分常被忽略,核桃成熟期间,大量青皮常作为垃圾被堆放在地头,造成环境污染及资源浪费。如能搞清楚核桃青皮的化学成分,加以综合开发利用,不仅可以保护环境,还可以增加经济收入[3]。为了进一步了解不同产地的核桃青皮的化学成分,探讨其药用价值,本实验对采自河南省洛阳市嵩县车村镇的核桃青皮的化学成分进行研究,从中分离得到13个化合物,分别鉴定为:3,5-二甲氧基-4-羟基-苯甲酸-7-O-β-D-葡萄糖苷(1)、myricananinF(2)、β-谷甾醇(3)、齐墩果酸(4)、核桃酮(5)、积雪草酸(6)、常春藤皂苷元(7)、β-胡萝卜苷(8)、 (4R)-4,8-二羟基-α-四氢萘酮-4-O-β-D-吡喃葡萄糖苷(9)、3β,23-二羟基-12-烯-28-乌苏酸(10)、熊果酸(11)、丁香酸(12)、JuglanosideB(13)。其中,化合物1、2、6、7、9、10为首次从该植物中分离得到,且该六种化合物也均为首次从该属植物中分离得到。
采用MTT染色法,将化合物1~6、9、11、13分别与人肝癌细胞(HepG2),人食管癌细胞(Eca109),人乳腺癌细胞(MCF-7),人结肠癌细胞(HCT-116)进行体外肿瘤细胞抑制测试。实验结果表明:化合物4对人肝癌细胞(HepG-2)的增殖显示了较强的生长抑制活性,化合物9对人乳腺癌细胞(MCF-7)的增殖具有一定的生长抑制活性。
1 仪器与材料
1.1 仪器
Bruker-400型核磁共振波谱仪(Bruker公司,德国);HP-5988A GC/MS 质谱仪(HP公司,美国);X-4型数显显微熔点仪测定(北京光电设备厂)。
1.2 试剂
Sephadex LH-20(Pharmacia公司,美国);MCI GEL CHP20/P120(Mitsubishi Chemical公司,日本);柱层析用硅胶(200~300目)及薄层层析用硅胶GF254(10~40 μm)(青岛海洋化工厂);所用试剂均为分析纯(天津市科密欧化学试剂有限公司)。细胞株:人肝癌细胞(HepG2)、人食管癌细胞(Eca109)、人乳腺癌细胞(MCF-7)、人结肠癌细胞(HCT-116)(中科院上海细胞库)。
1.3 植物来源
实验用核桃青皮于2013年6月采自河南省洛阳市嵩县车村镇,由新乡医学院药学院中药学教研室吴娇副教授鉴定,样本存放于新乡医学院药学院天然药物化学研究室。
2 实验内容
2.1 提取与分离
取核桃青皮17 kg(干重),阴干粉碎后,用甲醇在常温下对其进行浸泡,总共4次,每次浸泡6天,过滤后的滤液进行减压蒸馏得甲醇提取物浸膏,加水悬浮后分别用乙酸乙酯和正丁醇对其进行多次萃取,萃取液减压浓缩得乙酸乙酯部分浸膏(207.7 g)和正丁醇部分浸膏(82.1 g)。
乙酸乙酯部分浸膏用硅胶(3 500 g,200~300目)柱层析,以氯仿-甲醇(1∶0→0∶1)进行梯度洗脱,将洗脱液通过薄层色谱检识合并后,得到5个部分(FrI-FrⅤ)。FrI通过硅胶柱色谱,用石油醚-乙酸乙酯(15∶1→0∶1)为洗脱剂进行梯度洗脱,重复进行硅胶柱层析及重结晶得到化合物12(72 mg)。FrII通过硅胶柱色谱,用石油醚-乙酸乙酯(30∶1→0∶1)进行梯度洗脱,重复进行柱层析和纯化得到化合物2(17 mg)、3(254 mg)、4(150 mg)、5(105 mg)。FrⅢ先用大孔吸附树脂处理,以甲醇-水体系洗脱,得到的浸膏经硅胶柱层析,以氯仿-异丙醇(25∶1→0∶1)为洗脱系统反复进行硅胶柱层析及凝胶柱层析得到化合物6(36 mg)、7(20 mg)、10(21 mg)。FrⅣ通过硅胶柱色谱,用氯仿-甲醇(30∶1→0∶1)进行梯度洗脱,重复进行柱层析和纯化得到化合物8(245 mg)。FrⅤ通过硅胶柱色谱,用氯仿-甲醇(25∶1→0∶1)进行梯度洗脱,重复进行柱层析、重结晶、凝胶柱层析得到化合物11(34 mg)。
正丁醇部分浸膏用硅胶 (1 500 g,200~300目)柱层析,以氯仿-甲醇 (30∶1→0∶1)进行梯度洗脱,得到3个部分(Fr A-C)。Fr A以氯仿-甲醇(10∶1→0∶1)为洗脱系统经反复硅胶柱层析及纯化得到化合物1(11 mg)。Fr B先用氯仿-甲醇(10∶1→0∶1)进行梯度洗脱,然后用MCI-GEL CHP 20/P 120反相柱色谱,以甲醇/水(10% →40%)为洗脱剂进行梯度洗脱,最后用葡聚糖凝胶柱Sephadex LH-20,以甲醇/水(10%、15%、20%)为洗脱剂进行梯度洗脱,最终得到化合物13(40 mg)。Fr C通过硅胶柱色谱,用氯仿-甲醇(20∶1→ 0∶1)进行梯度洗脱,重复进行硅胶柱层析、凝胶柱层析,最终得到化合物9(34 mg)。
2.2 体外抗肿瘤活性测定
采用MTT法对人肝癌细胞(HepG2),人食管癌细胞(Eca109),人乳腺癌细胞(MCF-7),人结肠癌细胞(HCT-116)进行化合物体外肿瘤细胞抑制测试。将HepG2,Eca109,MCF-7,HCT116细胞培养于含有10%胎牛血清的1640培养基,在37 ℃,5% CO2条件下培养24 h。各细胞均按每1 mL 1×104 个铺于96孔板。实验组细胞分别用不同浓度的不同化合物处理(150 μL/孔),而对照组只用DEME培养基处理(150 μL/孔)。每孔加入5 mg/mL 的MTT溶液15 μL,继续孵育4 h,弃去培养基,每孔加入DMSO 150 μL,振荡10 min,于490 nm处测定OD值,计算IC50值。
3 实验结果
3.1 结构鉴定
化合物1无色针状晶体(CH3OH),分子式C15H20O10,mp.160~161 ℃;1H NMR (400 MHz,CD3OD)δ:7.38(2H,s,H-2,6),3.87(6H,s,3,5-OMe),5.66(1H,d,J=7.74 Hz,H-1′),3.36~3.50(4H,m,H-2′~5′),3.83(1H,dd,J=12.0,2.3 Hz,H-6′a),3.66(1H,dd,J=12.0,4.3 Hz,H-6′b);13C NMR (100 MHz,CD3OD)δ:120.7 (C-1),108.6 (C-2),148.9(C-3),142.4(C-4),148.9(C-5),108.6(C-6),166.7(C-7),96.2(C-1′),74.1(C-2′),78.9(C-3′),71.4(C-4′),78.1(C-5′),62.3(C-6′),56.9(3,5 × -OMe)。以上数据与文献[4]报道基本一致,可以鉴定该化合物为3,5-二甲氧基-4-羟基-苯甲酸-7-O-β-D-葡萄糖苷。
化合物2白色无定形粉末,分子式C20H24O4, mp.196~198 ℃;HR-ESI-MS:m/z351.156 8 [M+Na]+(calculated for 351.156 7);1H NMR (400 MHz,CDCl3)δ:6.67(1H,s,H-5),2.90~2.97(1H,m,Ha-7),2.47~2.54(1H,m,Hb-7),1.83~2.01(1H,m,Ha-8),1.83~2.01(1H,m,Hb-8),1.66~1.73(1H,m,Ha-9),1.53~1.59(1H,m,Hb-9),4.11 (1H,t,J= 9.6 Hz,H-10),1.83~2.01(1H,m,Ha-11),1.53~1.59(1H,m,Hb-11),2.90~2.97(1H,m,Ha-12),2.90~2.97(1H,m,Hb-12),2.28~2.35(1H,m,Ha-13),1.66~1.73(1H,m,Hb-13),7.10(1H,d,J=8.3 Hz,H-15),6.91(1H,d,J= 8.3 Hz,H-16),7.19(1H,s,H-18),6.81(1H,s,H-19),3.92(MeO-,s,C-4);13C NMR (100 MHz,CDCl3)δ:124.7(C-1),125.1(C-2),139.2(C-3),146.8(C-4),110.4(C-5),131.6(C-6),30.7(C-7),26.8(C-8),23.0(C-9),69.0(C-10),39.7(C-11),27.2(C-12),35.1(C-13),131.0(C-14),130.3(C-15),117.3(C-16),151.8(C-17),133.7(C-18),126.4(C-19),56.5(MeO-,C-4)。以上数据与文献[5]报道基本一致,可以鉴定该化合物为myricananinF。
化合物3无色针状结晶(石油醚),mp.139~140 ℃,分子式C29H50O;Liebermann-Burchard反应呈现阳性,Molish反应呈现阴性;1H NMR (400 MHz,CDCl3)δ:5.36(1H,d,J= 5.2 Hz,H-6),3.55(1H,m,H-3),1.02(3H,s,Me-19),0.93(3H,d,J= 6.3 Hz,Me-21),0.85 (3H,d,J= 2.0 Hz,Me-29),0.83(3H,d,J=6.6 Hz,Me-27),0.83(3H,s,Me-26),0.69(3H,s,Me-18);13C NMR (100 MHz,CDCl3)δ:37.6(C-1),32.1(C-2),72.4(C-3),42.7(C-4),141.0(C-5),121.9(C-6),32.0(C-7),32.1(C-8),50.4(C-9),37.0(C-10),21.5(C-11),40.0(C-12),42.4(C-13),57.0(C-14),24.6(C-15),28.5(C-16),56.4(C-17),12.3(C-18),19.2(C-19),36.4(C-20),19.5(C-21),34.2(C-22),26.3(C-23),46.0(C-24),29.5(C-25),19.0(C-26),19.8(C-27),23.3(C-28),12.3(C-29)。以上数据与文献[6]报道基本一致,因此鉴定该化合物为β-谷甾醇。
化合物4白色粉末,mp.279~280 ℃,分子式C30H48O3;Liebermann-Burchard反应呈现阳性;1H NMR(400 MHz,C5D5N)δ:0.91,0.93,1.06,1.07,1.08,1.15,1.29(each 3H,s,7-CH3),3.38(1H,dd,J=10.6,4.0 Hz,H-3),5.44(1H,m,H-12),2.98(1H,dd,J=13.6,4.0 Hz,H-18);13C NMR(100 MHz,C5D5N)δ:38.9(C-1),28.0(C-2),78.1(C-3),39.3(C-4),55.8(C-5),18.7(C-6),33.2(C-7),39.7(C-8),48.1(C-9),37.3(C-10),23.7(C-11),122.5(C-12),144.8(C-13),42.1(C-14),28.3(C-15),23.7(C-16),46.6(C-17),42.0(C-18),46.4(C-19),30.9(C-20),34.2(C-21),33.2(C-22),28.7(C-23),16.5(C-24),15.5(C-25),17.4(C-26),26.1(C-27),180.2(C-28),33.2(C-29),23.8(C-30)。以上波谱数据与文献[7]报道基本一致,因此鉴定该化合物为齐墩果酸。
化合物5无色针状结晶(CHCl3),紫外光365 nm下有荧光斑点,mp.73~74 ℃,分子式C10H10O3。1H NMR (400 MHz,CDCl3)δ:12.5(1H,s,OH-8),7.48(1H,t,J=8.0,H-6),7.01(1H,d,J=7.6 Hz,H-5),6.90(1H,d,J=8.4 Hz,H-7),4.89(1H,dd,J=7.2,4.0 Hz),2.98(1H,ddd,J=18.0,8.3,4.8 Hz,H-2a),2.64(1H,ddd,J=18.0,8.3,4.8 Hz,H-2b),2.33(1H,m,H-3a),2.16(1H,m,H-3b);13C NMR (100 MHz,CDCl3)δ:204.6(C-1),34.7(C-2),31.4(C-3),67.8(C-4),117.6(C-5),137.2(C-6),117.9(C-7),162.8(C-8),146.1(C-9),115.4(C-10)。以上波谱数据与文献[8]报道基本一致,因此鉴定该化合物为核桃酮。
化合物6白色粉末,mp.327~328 ℃,分子式C30H48O5; Liebermann-Burchard反应呈现阳性;1H NMR (400 MHz,C5D5N)δ:5.49(1H,t,J=4.0 Hz,H-12),4.26(1H,d,J=4.0 Hz,H-2),4.26(1H,d,J=4.0 Hz,H-3),4.22(1H,d,J=10.6 Hz,Ha-23),3.72(1H,d,J=10.6 Hz,Hb-23),1.16(3H,s,Me-25 ),1.10(3H,s,Me-24 ),1.09(3H,s,Me-26),1.08(3H,s,Me-27),0.99(3H,d,J=6.2 Hz,H-30),0.97(3H,d,J=6.2 Hz,H-29);13C NMR (100 MHz,C5D5N)δ:48.2(C-1),66.7(C-2),78.5(C-3),44.0(C-4),48.3(C-5),18.8(C-6),33.5(C-7),40.4(C-8),48.2(C-9),38.6(C-10),24.2(C-11),125.9(C-12),139.6(C-13),42.9(C-14),29.0(C-15),25.2(C-16),48.4(C-17),53.8(C-18),39.8(C-19),39.7(C-20),31.4(C-21),37.8(C-22),69.2(C-23),14.8(C-24),17.9(C-25),17.8(C-26),24.1(C-27),180.3(C-28),17.8(C-29),21.7(C-30)。以上波谱数据与文献[9]报道基本一致,因此鉴定该化合物为积雪草酸。
化合物7白色无定形粉末,分子式 C30H48O4,mp.331~333 ℃;Liebermann-Burchard反应呈现阳性;1H NMR (400 MHz,C5D5N)δ:4.25(1H,d,J=10.5 Hz,H-3),3.31(1H,dd,J= 13.0,3.9 Hz,H-5),5.49(1H,brs,H-12),3.30(1H,dd,J= 13.1,4.2 Hz,H-18),4.25(1H,d,J=10.3 Hz,H-23α),3.73(1H,d,J=10.3 Hz,H-23β),1.25(3H,s,H-24),1.05(3H,s,H-25),1.03(3H,s,H-26),1.02(3H,s,H-27),1.00(3H,s,H-29),0.94(3H,s,H-30);13C NMR (100 MHz,C5D5N)δ:39.1(C-1),28.0(C-2),73.7(C-3),43.2(C-4),48.9(C-5),18.9(C-6),33.6(C-7),40.1(C-8),48.5(C-9),37.6(C-10),24.2(C-11),122.9(C-12),145.2(C-13),42.5(C-14),28.7(C-15),24.1(C-16),47.0(C-17),42.3(C-18),46.8(C-19),31.3(C-20),34.5(C-21),33.5(C-22),68.2(C-23),13.5(C-24),16.3(C-25),17.8(C-26),26.5(C-27),180.6(C-28),33.3(C-29),24.0(C-30)。以上数据与文献[10]报道基本一致,故鉴定此化合物为常春藤皂苷元。
化合物8白色粉末,分子式 C35H60O6,mp.295~296 ℃;Liebermann-Burchard反应呈现阳性;1H NMR (400 MHz,C5D5N)δ:5.33 (1H,t,J=2.6 Hz,H-6),5.07 (1H,d,J=7.8 Hz,H-1′),4.56 (2H,dd,J=2.5,11.6 Hz,H-6′),4.40(1H,dd,J=5.5,12.0 Hz,H-4′),0.96(3H,d,J=6.6 Hz,CH3-21),0.92(3H,s,CH3-18),0.88(6H,d,J=1.9 Hz,CH3-26,27),0.86(3H,t,J=6.9 Hz,CH3-29),0.67(3H,s,CH3-19);13C NMR (100 MHz ,C5D5N)δ:38.0(C-1),30.9(C-2),79.0(C-3),40.5(C-4),141.4(C-5),122.5(C-6),32.8(C-7),32.8(C-8),50.9(C-9),37.5(C-10),21.9(C-11),40.5(C-12),42.9(C-13),57.3(C-14),25.1(C-15),28.9(C-16),56.9(C-17),19.5(C-18),12.5(C-19),36.9(C-20),19.9(C-21),34.9(C-22),27.0(C-23),46.5(C-24),29.9(C-25),20.5(C-26),19.9(C-27),23.9(C-28),12.8(C-29),103.2(C-1′),75.8(C-2′),79.1(C-3′),72.2(C-4′),78.6(C-5′),63.3(C-6′)。以上数据与文献[11]报道基本一致,故鉴定此化合物为β-胡萝卜苷。
化合物9白色粉末,紫外光365 nm下有荧光斑点,分子式C16H20O8, mp.120~122 ℃;HR-ESI-MSm/z:363.1060[M+Na]+(calculated for 363.1050[M+Na]+);1H NMR (400 MHz,CD3OD)δ:3.02(1H,m,Hβ-2),2.54(1H,m,Hα-2),2.32(2H,m,H-3),5.13(1H,m,H-4),7.48(1H,d,J=7.4 Hz,H-5),7.42(1H,t,J=8.0 Hz,H-6),7.00(1H,dd,J=8.3,1.0 Hz,H-7),5.00(1H, d,J= 7.8 Hz,H-1′),4.08(1H,m,H-2′),4.24(1H,m,H-3′),4.24(1H,m,H-4′),4.00(1H,m,H-5′),4.29(2H,d,J=7.4 Hz,H-6′),12.80(br s,-OH);13C NMR (100 MHz,C5D5N)δ:205.3(C-1),34.7(C-2),30.4(C-3),73.8(C-4),119.7(C-5),136.8(C-6),117.8(C-7),163.1(C-8),143.9(C-4a),116.2(C-8a),103.5(C-1′),75.3(C-2′),78.6(C-3′),71.6(C-4′),78.6(C-5′),62.8(C-6′)。以上数据与文献[12]报道基本一致,故鉴定此化合物为(4R)-4,8-二羟基-α-四氢萘酮-4-O-β-D-吡喃葡萄糖苷。
化合物10白色粉末,分子式C30H48O4,mp.283~285 ℃;Liebermann-Burchard反应呈现阳性;1H NMR(400 MHz,C5D5N)δ:5.35(1H,t,J=3.5 Hz,H-12),4.02(1H,d,J=10.6 Hz,Ha-23),3.60(1H,d,J= 10.6 Hz,Hb-23),3.59(1H,m,H-3),1.40,1.35,1.15,1.13(each 3H,s,4×-Me),1.08(3H,d,J= 2.8 Hz,H-30),1.06(3H,d,J=6.5 Hz,H-29);13C NMR (100 MHz,C5D5N)δ:39.3(C-1),26.5(C-2),73.7(C-3),43.9(C-4),48.4(C-5),18.8(C-6),33.3(C-7),40.3(C-8),48.9(C-9),37.5(C-10),24.3(C-11),126.0(C-12),139.6(C-13),43.2(C-14),27.9(C-15),24.3(C-16),48.4(C-17),53.9(C-18),39.3(C-19),31.3(C-20),37.5(C-21),33.3(C-22),65.2(C-23),13.5(C-24),16.5(C-25),17.8(C-26),24.3(C-27),180.3(C-28),17.8(C-29),21.8(C-30)。以上数据与文献[13]报道基本一致,故鉴定此化合物为 3β,23-二羟基-12-烯-28-乌苏酸。
化合物11无色针晶(CH3OH),分子式C30H48O3,mp.258~260 ℃;Liebermann-Burchard反应呈现阳性;1H NMR(400 MHz,C5D5N)δ:3.36(1H,dd,J= 10.6,5.6 Hz,H-3),5.45(1H,brs,H-12),1.02(3H,s,H-23),0.85(3H,s,H-24),0.88(3H,s,H-25),1.16(3H,s,H-26),1.30(3H,s,H-27),0.92(3H,s,H-29),1.01(3H,s,H-30);13C NMR (100 MHz,C5D5N)δ:39.4(C-1),28.5(C-2),78.9(C-3),39.4(C-4),55.5(C-5),18.5(C-6),33.5(C-7),40.2(C-8),47.8(C-9),39.0(C-10),23.3(C-11),125.5(C-12),138.7(C-13),42.2(C-14),28.5(C-15),24.3(C-16),48.0(C-17),53.0(C-18),40.9(C-19),38.9(C-20),31.0(C-21),37.1(C-22),28.5(C-23),15.6(C-24),16.1(C-25),17.3(C-26),23.6(C-27),180.3(C-28),17.3(C-29),21.5(C-30)。以上数据与文献[14,15]报道基本一致,故鉴定此化合物为熊果酸。
化合物12无色针状结晶(CO(CH3)2),紫外光365 nm下有荧光斑点,分子式 C9H10O5,mp.207~208 ℃;1H NMR (400 MHz,CO(CD3)2)δ:8.02(4-OH),7.30(2H,s,H-2,6),3.87(6H,s,3,5-OMe);13C-NMR (100 MHz,CO(CD3)2)δ:121.0(C-1),107.6(C-2,6),148.0(C-3,5),141.1(C-4),167.2(-COOH),56.3(3,5-OMe)。以上数据与文献[16]报道基本一致,故鉴定此化合物为丁香酸。
化合物13白色无定形粉末,紫外光365 nm下有荧光斑点;分子式C16H20O8,mp.157~158 ℃;1H NMR (400 MHz,CD3OD)δ:3.14(1H,m,Ha-2),2.49(1H,m,Hb-2),2.20(1H,m,Ha-3),2.57(1H,m,Hb-3),5.42(1H,t,J=3.2 Hz,H-4),7.11(1H,dd,J=7.9,1.1 Hz,H-6),7.29(1H,t,J=7.9 Hz,H-7),7.49(1H,dd,J=7.9,1.1 Hz,H-8),4.62(1H,d,J=7.9 Hz,H-1′),3.20(1H,dd,J=8.7,7.9 Hz,H-2′),3.36(1H,H-3′),3.37(1H,H-4′),3.36(1H,H-5′),3.72(1H,dd,J=12.2,2.9 Hz,Ha-6′),3.93(1H,d,J=11.9 Hz,Hb-6′);13C NMR(100 MHz,CD3OD)δ:201.1(C-1),34.1(C-2),30.2(C-3),69.9(C-4),157.1(C-5),122.1(C-6),130.6(C-7),119.0(C-8),134.6(C-9),129.9(C-10),104.0(C-1′),75.5(C-2′),78.2(C-3′),71.7(C-4′),78.2(C-5′),62.8(C-6′)。以上数据与文献[17]报道基本一致,故鉴定此化合物为JuglanosideB。
3.2 体外抗肿瘤活性结果
由表1可知,化合物4对人肝癌细胞(HepG2)的增殖显示了较强的生长抑制活性,化合物9对人乳腺癌细胞(MCF-7)的增殖具有一定的生长抑制活性,其他化合物则无明显的细胞毒性。
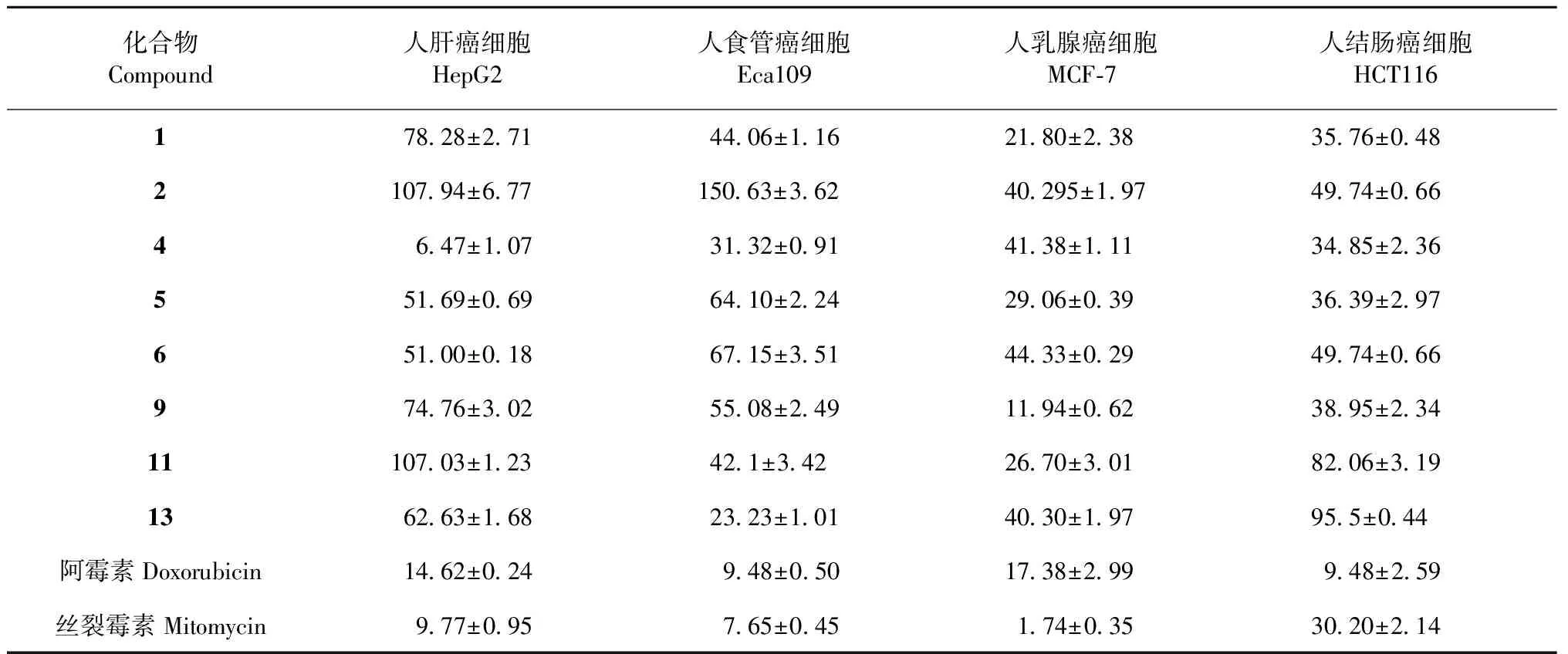
表1 化合物的抗肿瘤活性( IC50 )Table 1 In vitro antitumor activity of compounds ( IC50 )

