白兰花挥发油化学成分及其抑菌拒食活性研究
侯冠雄,王永江,张周鑫,颜一军,马亚团,朱艳玲,黄胜雄*
1云南中医学院中药学院,昆明 650500;2中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,昆明 650201;3昆明医科大学海源学院,昆明 650106;
白兰(MicheliaalbaDC.),又名黄桷兰、白缅桂、把兰等,属木兰科含笑属的常绿乔木,原产于印度尼西亚的瓜哇岛,现已广泛分布于我国的西部和东南部[1]。白兰不但树形好,花期长,叶色浓绿,且白兰花、叶、茎中都含有挥发性芳香物质,少有病虫害侵扰,四季呈香,是珍贵的观赏性芳香植物。白兰花性温,味苦辛,具有止咳、化浊的功效,民间用作驱蚊防虫剂。白兰花洁白清香,可提制成白兰花浸膏,供高档化妆品作为香精之用,还是我国熏制花茶的重要原料之一[2]。鲜叶可提取香油,又称“白兰叶油”,其对慢性支气管炎有很好的功效,且根皮可入药,用于治疗便秘[3]。
现如今,已有大量国内外学者对白兰花挥发油成分进行了研究[4-9],大都是采用溶剂萃取和固相微萃取等方法,并结合GC-MS分析白兰花挥发油成分。白兰具有抗癌和皮肤保护的药理作用[10],但对其抗虫和抑菌活性研究相对甚少[11],本文将对此方面进行研究探讨,涉及的供试菌为4株细菌,4株真菌;供试虫为粘虫(Mythimnaseparata)[12-16]。粘虫属鳞翅目,夜蛾科,又名行军虫或剃枝虫,危害玉米、小麦和水稻等主要粮食作物以及其它100多种作物,其可将作物的叶片吃光并能咬断麦穗或谷穗,使作物严重减产,甚至绝产,损害农民利益。本文研究发现白兰挥发油对水稻黄单胞菌和水稻纹枯病菌抑制效果较好,并且对粘虫(M.separata)也有一定抑制作用,这为白兰花挥发油的综合利用提供了理论基础。
1 材料与方法
1.1 材料
1.1.1 供试材料与取样方法
供试材料:白兰花,2016年采自四川省邛崃市孔明乡,该植物由中国科学院昆明植物研究所吴之坤高级工程师鉴定。标本(KIB1201)保存于中国科学院昆明植物研究所植物化学与西部植物资源可持续利用国家重点实验室。
受试昆虫:粘虫Mythimnaseparata(Walker)幼虫,从济源白云实业有限公司购入。本实验选取健康,大小一致,发育正常的2~3龄粘虫幼虫。
1.1.2 菌种及培养基
菌株:大肠杆菌(EscherichiacoliATCC 8099)、金黄色葡萄球菌(StaphylococcusaureusATCC 6538)和枯草芽孢杆菌(BacillussubtilisATCC 6633)购买自ATCC菌种库;水稻黄单胞菌(Xanthomonasoryzaepv.oryzaeRS105)、白色念珠菌(Candidaalbicans)、大豆根腐致病菌(Fusariumoxysporum)、玉米弯孢致病菌(Curvularialunata(Walk) Boed)和水稻纹枯病菌(Rhizoctoniasolani)由西北农林科技大学马亚团老师提供。菌株目前保藏于植物化学与西部植物资源可持续利用国家重点实验室。
PDA培养基:200.0 g去皮土豆切碎后,加入1.0 L自来水,煮沸30 min,四层纱布过滤后,滤液加入技术琼脂粉20.0 g,右旋葡萄糖20.0 g,定容至1.0 L,自然pH。
LB培养基:胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,氯化钠 10.0 g/L,技术琼脂粉20.0 g/L,pH = 7.4。
1.1.3 实验试剂与仪器条件
主要仪器:电热套(北京中兴伟业仪器有限公司,中国),恒温水浴锅(上海申生科技有限公司,中国),德国科恩KERN ABS系列万分之一分析天平,YXQ-LS-18SI 高压蒸汽灭菌锅(上海博迅实业有限公司医疗设备厂,中国),使用的挥发油提取器,圆底烧瓶,冷凝管的厂家均为中国四川蜀玻(集团)有限责任公司。使用的试剂丙酮、甲醇、无水硫酸钠均为分析纯,由中国天津市大茂化学试剂厂生产。气相色谱质谱联用仪器为美国Agilent Technologies公司HP6890GC/5973MS气相色谱-质谱联用仪。
GC条件:HP-5MS石英毛细管柱(30 m × 0.25 mm × 0.25 μm);柱温:起始温度40 ℃,程序升温3 ℃/min至80 ℃,再程序升温5 ℃/min至280 ℃,保持20 min;柱流速为1.0 mL/min;进样口温度250 ℃;柱前压100 kPa;分流比30∶1;进样量0.1 μL;载气为高纯氦气。MS条件:电离方式EI;电子能量70 eV;传输线温度250 ℃;离子源温度230 ℃;四极杆温度150 ℃;质量范围35~500 amu。
1.2 方法
1.2.1 白兰花挥发油的提取与鉴定
采用水蒸气蒸馏法[19]提取白兰花挥发油。采用气相色谱质谱联用仪器进行分离分析,采用Wiley7n.l标准谱库检索定性。
1.2.2 得率计算
白兰花挥发油提取率 = (M-M0) / 100×100%
其中,M(g)为挥发油连同容器重量;M0(g)为干燥容器重量。每次实验样品用量100.0 g。
1.2.3 抑菌实验[17]
将冻存在20%甘油中的植物病原真菌接种到PDA培养基上,28 ℃避光培养4天,细菌接种到液体LB培养基中,37 ℃,200 rpm避光培养12 h。将挥发油用丙酮稀释成5个浓度(0.2、0.1、0.05、0.025、0.012 5 mL/mL)待用。将活化好的植物病原真菌孢子接种到约45 ℃的PDA培养基并倒入培养皿中,冷却凝固后待用。取液体LB培养好的细菌菌液,将其接种到约45 ℃的固体LB培养基并倒入到培养皿中,冷却凝固后待用。在无菌滤纸片(用打孔器将滤纸片加工成直径为6 mm)中心滴加5 μL丙酮稀释的待测样品,待溶剂挥干后,将其放置在已接菌的培养基中。每块平板均以丙酮作为阴性对照,真菌以放线菌酮和制霉菌素作为阳性对照,细菌以卡那霉素作为阳性对照。植物病原真菌在28 ℃培养箱中培养48 h后观察抑菌圈大小,细菌在37 ℃培养箱中培养12 h后观察抑菌圈大小,进行3组平行实验,求其平均值。
1.2.4 拒食活性测定[18]
采用小叶碟添加法。挑选大小均一、生命力较强的实验粘虫,隔离于锥形瓶中,保持其饥饿状态6~8 h后,取出并将其置于洁净的培养皿中。将采摘的新鲜玉米叶裁剪成边长为1 cm的正方形叶碟,将其浸泡于上述用丙酮稀释好的挥发油中,2~3 s后取出,待溶剂挥干后,置于放有试虫的培养皿内。对照组使丙酮溶液作对照用相同方法处理。分别在6、12、24、48 h用坐标方格纸测量拒食面积并计算拒食率,进行3组平行实验,求其平均值。公式如下:拒食率(%) = [(对照组取食面积-处理组取食面积)/对照组取食面积]×100%。
2 结果与分析
2.1 白兰花中挥发油成分的总离子流图
2.2 挥发油化学成分分析
对白兰花挥发油的化学成分进行气相色谱-质谱分析,采用Wiley7n.l标准谱库检索定性,其结果见表1。
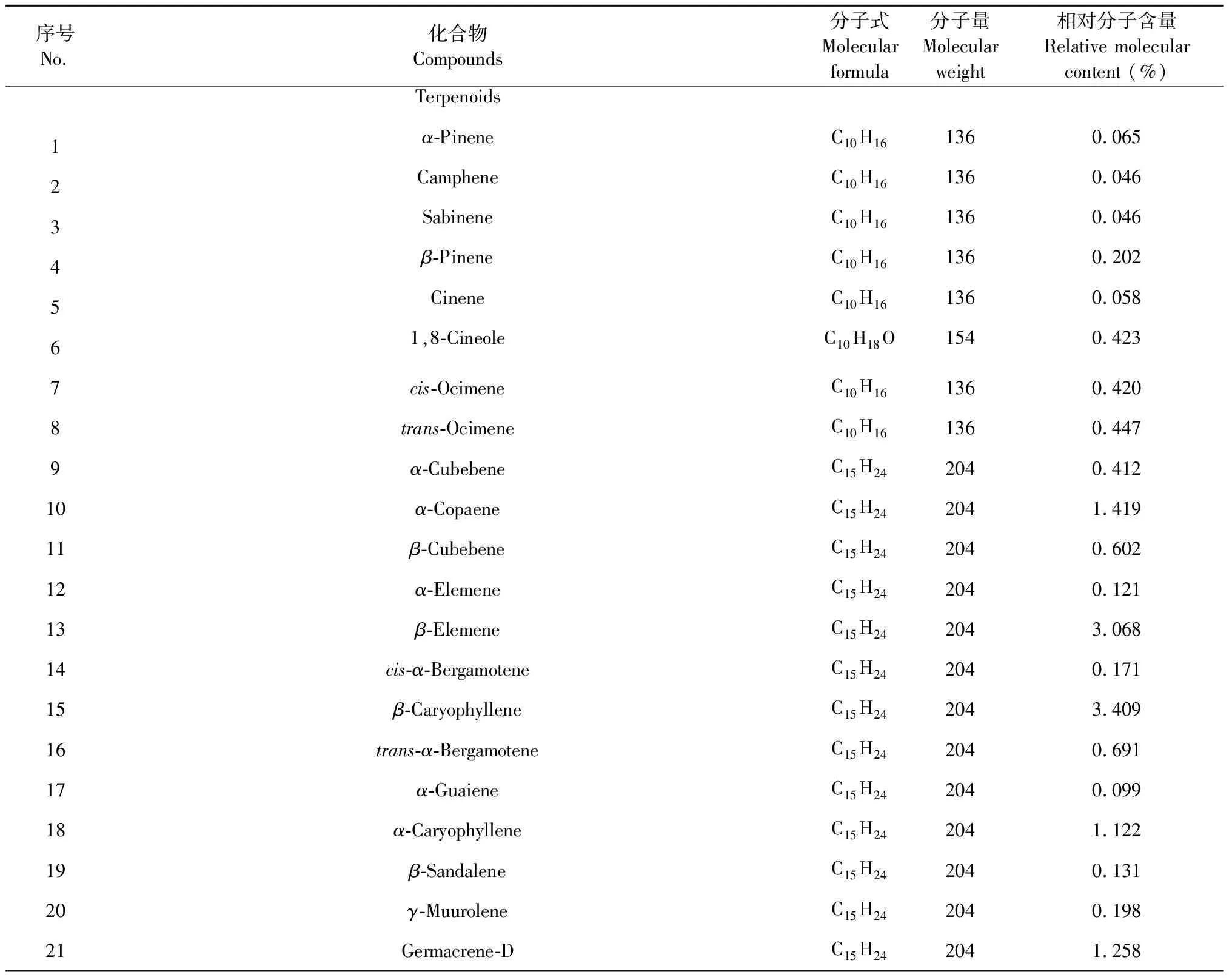
表1 白兰花挥发油的化学物质组成和百分比含量Table 1 The chemical composition and percentage content of essential oils from flowers of M.alba DC
续表1(Continued Tab.1)

序号 No.化合物 Compounds分子式 Molecular formula分子量 Molecular weight相对分子含量 Relative molecular content (%)22β-SelineneC15H242041.67723α-MuuroleneC15H242040.31624β-BisaboleneC15H242041.99925δ-CadineneC15H242041.83326α-CalacoreneC15H202000.45427β-CalacoreneC15H202000.11628Caryophyllene oxideC15H24O2206.09729γ-CadineneC15H242040.2403012-Oxabicyclo[9.1.0]dodeca-3,7-diene,1,5,5,8-tetramethyl-,(1R,3E,7E,11R)C15H24O2201.672311,5-Epoxy salvial-4(14)-eneC15H24O2200.11132Naphthalene,1,2,4a,5,6,8a-hexahydro-4,7-dimethyl-1-(1-methylethyl)-C15H242040.11133Bicyclo[5.2.0]nonane,4-methylene-2,8,8-trimethyl-2-vinyl-C15H242040.11234Tricyclo[5.2.2.0(1,6)]undecan-3-ol,2-methylene-6,8,8-trimethyl-C15H24O2200.03735α-Cedrene oxideC15H24O2200.438361,6-Dimethyl-4-(1-methylethyl)-(1,2,3,4,4a,7)hexahydronaphthaleneC15H242040.48937cis-β-FarneseneC15H242040.466Alcohols38cis-Linalool oxide (furanoid)C10H18O21701.84739trans-Linalool oxide (furanoid)C10H18O21701.66940LinaloolC10H18O15443.18041HotrienolC10H16O1520.34542BenzeneethanolC8H10O1220.09643trans-Linalool oxide (pyranoid)C10H18O21700.12744cis-Linalool oxide (pyranoid)C10H18O21700.087454-TerpineolC10H18O1540.05046α-TerpineolC10H18O1540.17347GeraniolC10H18O1540.10148NerolidolC15H26O2220.66349tau-MuurololC15H26O2221.58350Selin-11-en-4α-olC15H26O2220.592516-Isopropenyl-4,8a-dimethyl-1,2,3,5,6,7,8,8a-octahydro-naphthalen-2-olC15H24O2201.00052Epi-CubebolC15H242040.32753(+) SpathulenolC15H24O2200.37254Epi-EudesmolC15H26O2220.818Hydrocarbon552-UndecanoneC11H22O1700.03356NonadecaneC19H402680.03157HeneicosaneC21H442970.04858TricosaneC23H483250.068
续表1(Continued Tab.1)
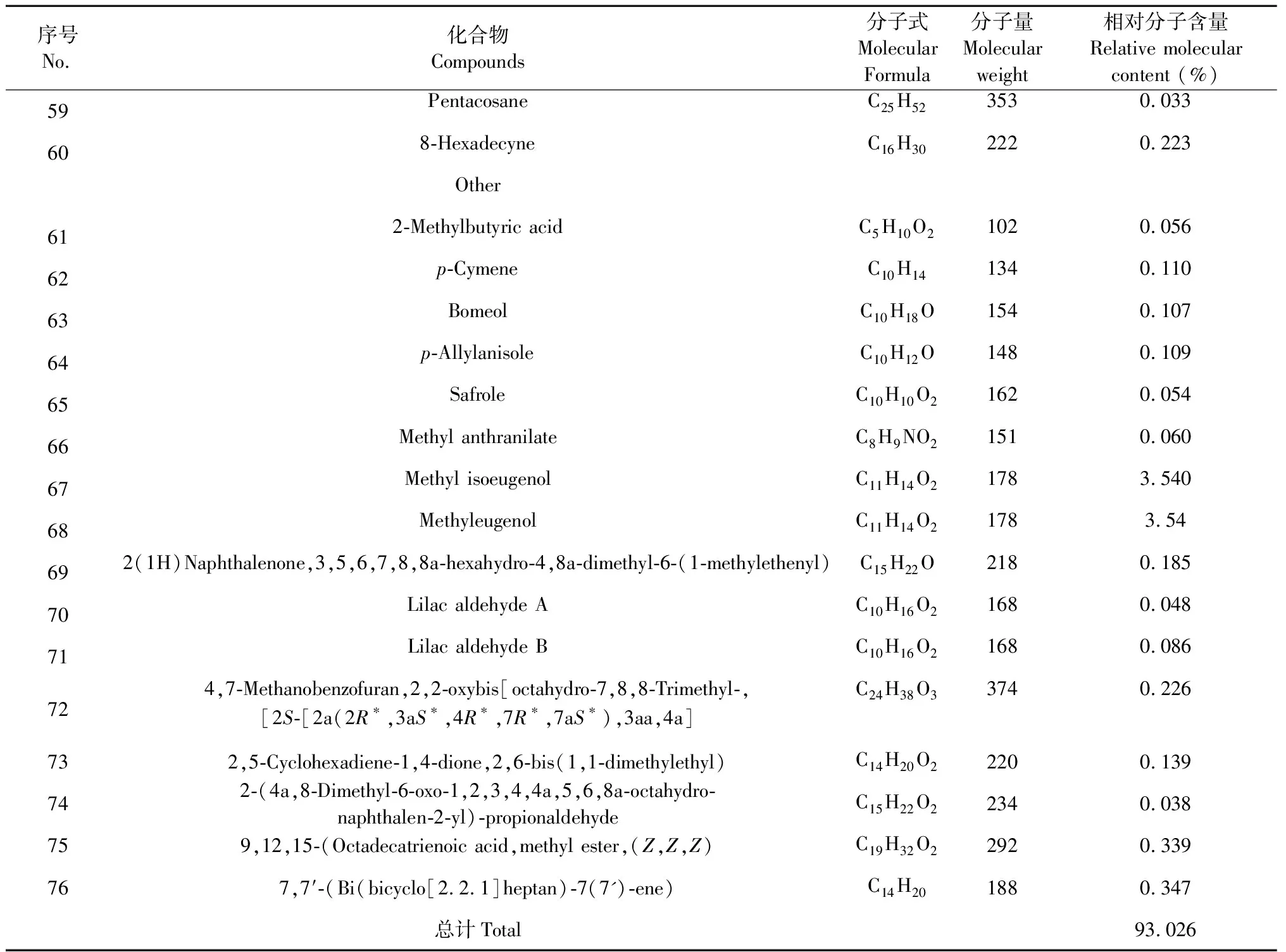
序号 No.化合物 Compounds分子式 Molecular Formula分子量 Molecular weight相对分子含量 Relative molecular content (%)59PentacosaneC25H523530.033608-HexadecyneC16H302220.223Other612-Methylbutyric acidC5H10O21020.05662p-CymeneC10H141340.11063BomeolC10H18O1540.10764p-AllylanisoleC10H12O1480.10965SafroleC10H10O21620.05466Methyl anthranilateC8H9NO21510.06067Methyl isoeugenolC11H14O21783.54068MethyleugenolC11H14O21783.54692(1H)Naphthalenone,3,5,6,7,8,8a-hexahydro-4,8a-dimethyl-6-(1-methylethenyl)C15H22O2180.18570Lilac aldehyde AC10H16O21680.04871Lilac aldehyde BC10H16O21680.086724,7-Methanobenzofuran,2,2-oxybis[octahydro-7,8,8-Trimethyl-,[2S-[2a(2R∗,3aS∗,4R∗,7R∗,7aS∗),3aa,4a]C24H38O33740.226732,5-Cyclohexadiene-1,4-dione,2,6-bis(1,1-dimethylethyl)C14H20O22200.139742-(4a,8-Dimethyl-6-oxo-1,2,3,4,4a,5,6,8a-octahydro-naphthalen-2-yl)-propionaldehydeC15H22O22340.038759,12,15-(Octadecatrienoic acid,methyl ester,(Z,Z,Z)C19H32O22920.339767,7′-(Bi(bicyclo[2.2.1]heptan)-7(7')-ene)C14H201880.347总计Total93.026
表1中列出了从白兰花挥发油中鉴定出的76个化合物,主要为单萜和倍半萜。本次检测出的化合物占总挥发油的93.026%,主要成分有芳樟醇(43.180%)、石竹烯氧化物(6.097%)、β-榄香烯(3.068%)、甲基丁香酸(3.540%)、β-石竹烯(3.409%)、β-红没药烯(1.999%)、顺-呋喃型芳樟醇氧化物(1.847%)、δ-杜松烯(1.833%)、β-芹子烯(1.677%)、tau-木罗醇(1.583%)、α-胡椒烯(1.419%)和大香叶烯D(1.258%)等。
2.3 抑菌活性测定
用滤纸片法,测定纯挥发油及5种不同浓度挥发油的抑菌活性,其结果见表2、表3。白兰花挥发油对指示细菌和植物病原真菌都具有一定抑制作用,其中,纯挥发油抑制效果最佳。白兰花挥发油对枯草芽孢杆菌和水稻黄单胞菌具有较好的抑制作用,在浓度为0.0125 mL/mL时,都能对这两株指示细菌具有抑制作用。此外,白兰花挥发油在高浓度时对植物病原真菌具有很好的抑制作用,在低浓度时对植物病原真菌的抑制作用相对较弱。
2.4 拒食活性测定
采用叶碟法,测定5种不同浓度的白兰花挥发油对粘虫幼虫的拒食活性,其结果见表4。
表4显示,不同浓度白兰花挥发油对粘虫幼虫具有一定的拒食作用。当白兰花挥发油浓度大于0.l mL/mL时,供试虫不取食,拒食率接近100%;当浓度小于0.05 mL/mL时,随着时间的推移粘虫表现出波浪型拒食特性,即某一段时间拒食率较高,某一段时间拒食率低。总体而言,白兰花挥发油对粘虫幼虫表现出较强拒食活性,取当浓度为0.1 mL/mL的白兰花挥发油处理叶片48小时后,仍具有80%的拒食率。
3 结论
本论文利用传统的水蒸气蒸馏法提取的挥发油得率为4.18%,虽耗时长,但所提取的挥发油外观佳,抑菌和拒食活性好。而后通过气相色谱-质谱联用法分析白兰花中挥发油的成分,共鉴定出76个成分,总含量占挥发油的93.026%。白兰花挥发油中的香气成分主要为芳樟醇,其次石竹烯氧化物、甲基丁香酸、β-石竹烯等,这些成分构成了白兰特有的香味。通过与文献[19,20]报道的挥发油对比,发现白兰花的挥发油化学成分与采摘时间和提取方法有关,并且与白兰叶和茎的挥发油成分存在差异,但其主要成分大体相同,所以白兰花挥发油也具有白兰叶和茎挥发油相似的功效。
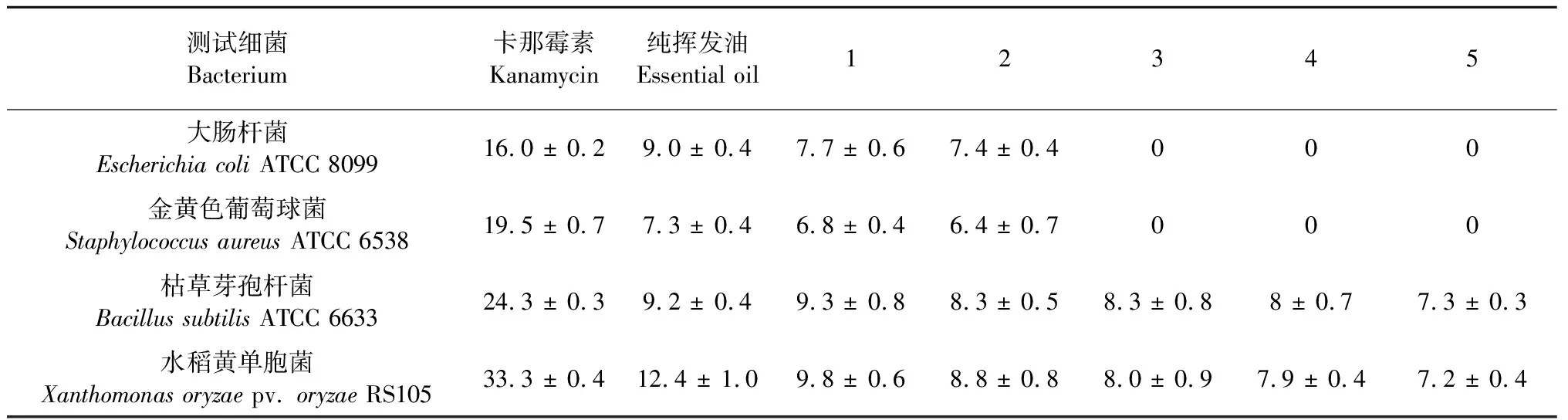
表2 纯挥发油及不同浓度白兰花挥发油的抗细菌活性(抑菌圈的直径,mm)Table 2 The antibacterial activity of essential oils from flowers of M.alba(The diameter of inhibition zone,mm)
注:丙酮稀释后的5个浓度(0.2、0.1、0.05、0.025、0.0125 mL/mL)的挥发油分别与1、2、3、4、5对应。表中数据均为3次重复平均值。
Note:The five kinds of essential oils diluted by acetone (0.2,0.1,0.05 ,0.025,0.0125 mL/mL) correspond to 1,2,3,4,5.Date given were from 3 duplicates.
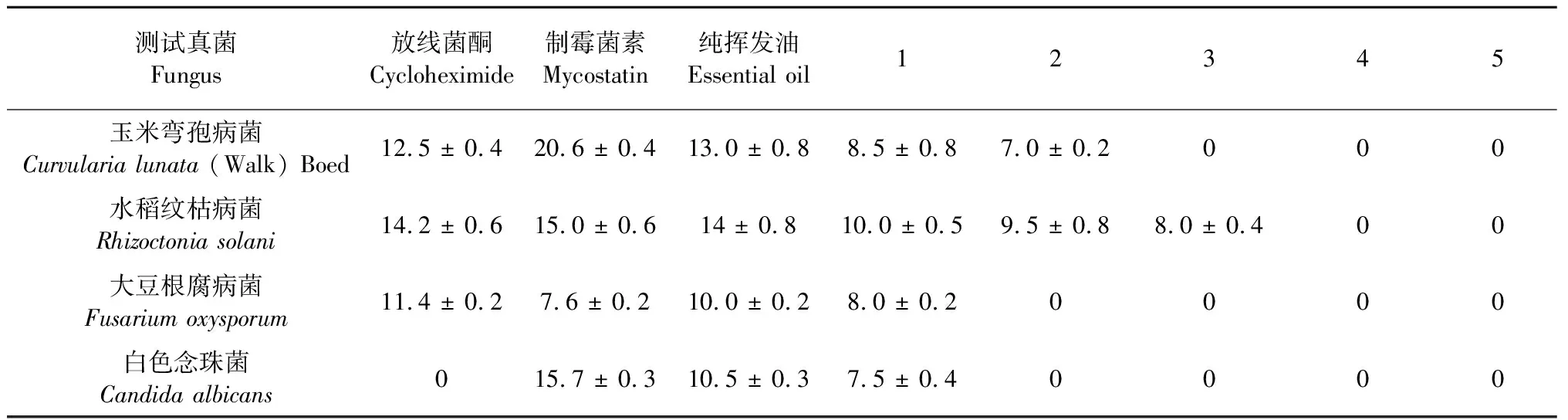
表3 纯挥发油及不同浓度白兰花挥发油的抗真菌活性(抑菌圈的直径,mm)Table 3 The antifungal activity of essential oils from flowers of M.alba.(The diameter of inhibition zone,mm)
注:丙酮稀释后的5个浓度(0.2 mL/mL,0.1 mL/mL,0.05 mL/mL,0.025 mL/mL,0.0125 mL/mL)的挥发油分别与1,2,3,4,5对应。表中数据均为3次重复平均值。
Note:The five kinds of essential oils diluted by acetone (0.2 mL/mL,0.1 mL/mL,0.05 mL/mL,0.025 mL/mL,0.0125 mL/mL) correspond to 1,2,3,4,5.Date given were from 3 duplicates.
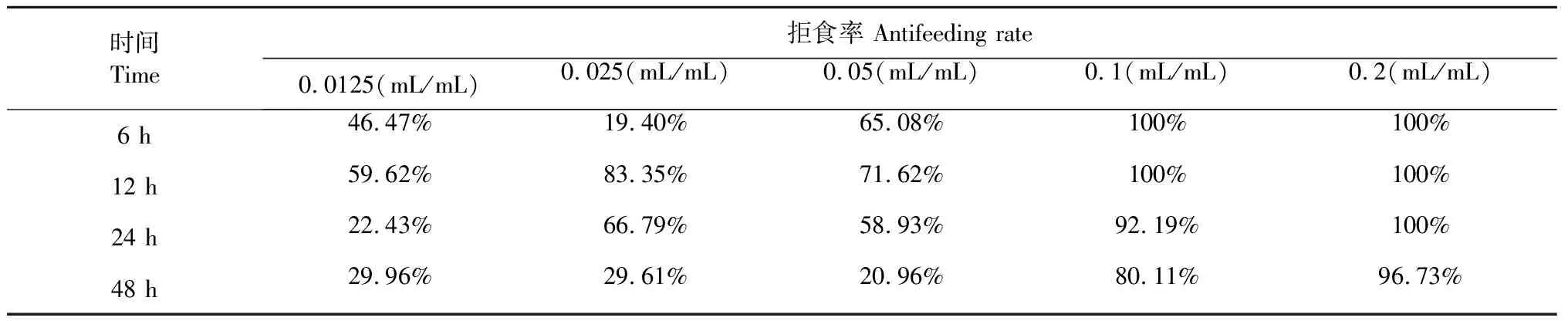
表4 白兰花挥发油对粘虫的拒食活性测定结果Table 4 Results of resist food effect of essential oils from flowers of M.alba DC.on Mythimna separata
从白兰花挥发油抑菌效果来看,白兰花挥发油对枯草芽孢杆菌和水稻黄单胞菌具有较好的抑制作用,在浓度为0.012 5 mL/mL时,都能对这两株指示细菌具有抑制作用。此外,白兰花挥发油在高浓度时对植物病原真菌具有很好的抑制作用,在低浓度时对植物病原真菌的抑制作用相对较弱。
综上所述,通过水蒸气提取白兰花挥发油,杂质较少,整体外观好;从白兰花挥发油对不同菌种的抑菌实验中可知,对细菌和真菌都具有一定的抑制作用,尤其是对水稻黄单胞菌和水稻纹枯病菌抑制效果最好;白兰花挥发油对粘虫抗虫性试验可知,白兰花挥发油在特定浓度下有很高的拒食率,从而使挥发油对粘虫幼虫具有较好的抑制作用。故而,白兰花挥发油在农作物生产以及植物病害防治上具有一定的应用前景。

