冠状动脉慢血流患者焦虑或抑郁状态分析及其潜在机制探讨
冯强,李中中
作者单位:056001 河北省,邯郸市中心医院 心内四科
冠状动脉慢血流(CSF)是指除外溶栓治疗、冠状动脉成形术、冠状动脉痉挛及扩张、心肌病和瓣膜病等因素后,冠状动脉造影过程中未发现冠状动脉病变而冠状动脉远端血流灌注延迟的现象[1]。CSF会导致胸部不适或心绞痛等症状,严重影响患者的生活质量。1972年Tambe等[2]首次提出CSF现象后,CSF越来越受到国内外心血管界的重视,已逐渐成为国内外学者研究的热门课题。诸多研究显示,CSF与性别、吸烟、心率、血小板、血尿酸升高、高同型半胱氨酸血症等因素有关[3-4]。有国外研究表明,焦虑或抑郁状态也是CSF的高危因素[5-6],但国内相关研究较少[7]。另外,有学者认为,焦虑或抑郁与神经递质五羟色胺(5-HT)、去甲肾上腺素(NE)及多巴胺(DA)的功能障碍有关[8]。而外周血中5-HT主要存在于血小板,因此焦虑或抑郁可通过影响血5-HT水平或血小板计数及过度激活下丘脑-垂体-肾上腺系统而导致CSF。本研究通过对非典型冠心病(排除由典型冠状动脉粥样硬化引起管腔狭窄而又具有典型冠心病相关症状)患者进行焦虑或抑郁量化评分调查,探讨焦虑或抑郁状态与CSF关系及其相关机制。
1 资料与方法
1.1 研究对象
选取我院2016-05-01至2017-04-30期间收治的非典型冠心病患者232例。排除标准:(1)急性心肌梗死、冠状动脉血栓、冠状动脉扩张、心肌病、冠状动脉瘤、心脏瓣膜病、高度房室阻滞等心血管疾病患者;(2)感染性疾病、肿瘤、严重脑血管疾病、尿毒症、贫血、感染、近期外科手术、肿瘤、纽约心脏协会心功能分级Ⅲ级及以上等身体一般情况较差患者。根据冠状动脉造影结果将患者分为慢血流组(n=92)和对照组(n=140)。
1.2 研究方法
一般资料收集:收集和比较两组患者的一般资料,包括年龄、性别、吸烟或饮酒史、既往病史(高血压、糖尿病、脑卒中、心肌梗死)、常规血生化检查结果(包括血糖、血脂、白细胞、红细胞、血肌酐、血尿素氮等)、体重指数。
血小板计数和血清神经递质水平检测:由血常规结果记录血小板计数,另将收集的部分血液标本以3 000 r/min离心20 min,收集上清液,采用酶联免疫吸附法(ELASA)进行5-HT、NE及DA等神经递质指标的检测。
焦虑或抑郁状态评估:对所有入选患者进行汉密尔顿焦虑量表(HAMA,14项版本)和汉密尔顿抑郁量表(HAMD,24项版本)评分,按照全国精神科量表协作组提供的评分标准[9]评估(HAMA评分≥14分为焦虑症, HAMD评分≥20分为抑郁症),并根据临床症状做出最终诊断。所有患者焦虑或抑郁评分及诊断均由我院精神科医师统一进行评价诊断。
冠状动脉造影:采用Judkins法对所有入选患者行择期冠状动脉造影术,术中分别进行左、右冠状动脉造影。右冠状动脉造影的主要体位有:左前斜(左45°)、头位(头30°)两个体位;左冠状动脉造影的主要体位有:头位(头30°),肝位(足20°+右30°),蜘蛛位(足20°+左30°),左肩位(头20°+左35°),右肩位(头 20°+右 35°),足位(足30°)六个照射体位。术中图像采集速度为30 帧/s。手术由经验丰富的介入医师进行。以匀速(约3 ml/s)推注对比剂,左、右冠状动脉每次每体位注射4~6 m1对比剂,每个体位需采集3~5个心动周期,必要时可根据术中冠状动脉病变情况以及血流速度调整采集时间。每个体位尽量1次完成。CSF判定方法:采用Gibson等[10]提出的校正心肌梗死溶栓治疗试验(TIMI)血流帧数法,在图像采集速度为30帧/s时,由于左前降支较长,对比剂通过时间长,故将左前降支所得帧数除以1.7得出左前降支矫正帧数,正常左前降支为(36.2±2.6)帧,校正后为(21.1±2.1)帧,左回旋支(22.2±4.1)帧,右冠状动脉(20.4±3.0)帧。CSF诊断标准为:1支或1支以上冠状动脉的帧数>正常值的2倍标准差,即对比剂通过任何1支或1支以上冠状动脉的帧数>27帧[11,12](其中左前降支为矫正后帧数)。
1.3 统计学方法
所有资料均以SPSS 20.0软件录入和分析,计量资料采用均数±标准差(±s)描述,计数资料以例(%)表示,组间比较采用卡方检验。P<0.05为差异有统计学意义。
2 结果
两组患者一般情况比较(表1):两组患者在年龄、性别构成、吸烟史、饮酒史、高血压史、糖尿病史、脑卒中病史、冠心病家族史、血糖、总胆固醇、甘油三酯、白细胞、红细胞、血肌酐、血尿素氮、入院时心率、左心室射血分数、体重指数等一般资料上的差异均无统计学意义(P均>0.05)。
表1 两组患者一般情况比较(±s)

表1 两组患者一般情况比较(±s)
性别 (男/女,例) 67/73 44/48 0.0828 0.7735左心室射血分数 (%) 56.09±7.21 55.33±7.85 0.7581 0.4564
两组患者的HAMA和HAMD评估结果比较(表2):慢血流组中焦虑症(42.39% vs 28.57%)及抑郁症(16.31% vs 4.29%)患者比例均高于对照组,差异均有统计学意义(P均<0.05)。
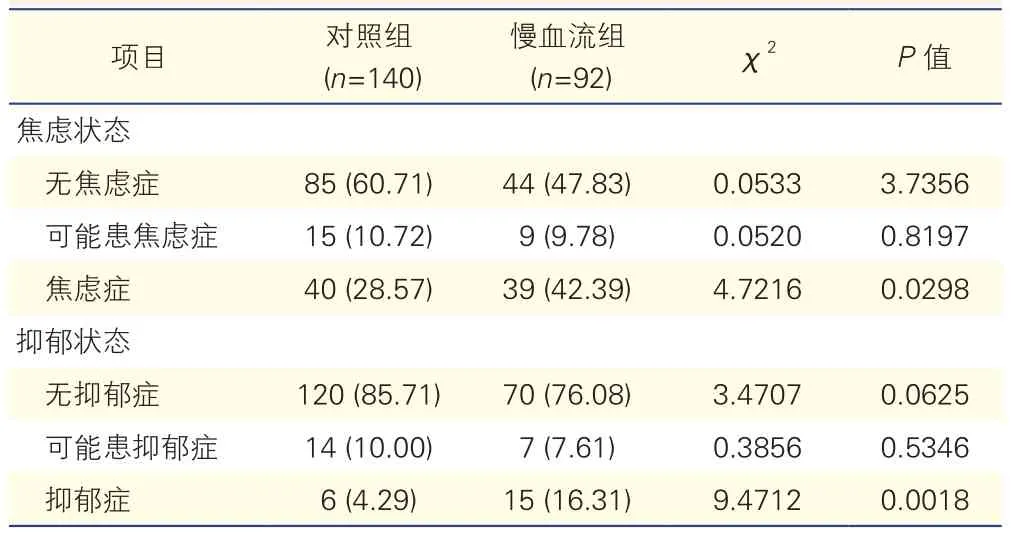
表2 两组患者的汉密尔顿焦虑或抑郁量表评估结果比较[例(%)]
两组患者血小板计数及血5-HT、NE及DA水平比较(表3):慢血流组血小板计数以及血5-HT、NE、DA水平均高于对照组,差异均有统计学意义(P均<0.05)。
表3 两组患者血小板计数及血五羟色胺、去甲肾上腺素、多巴胺水平比较(±s)
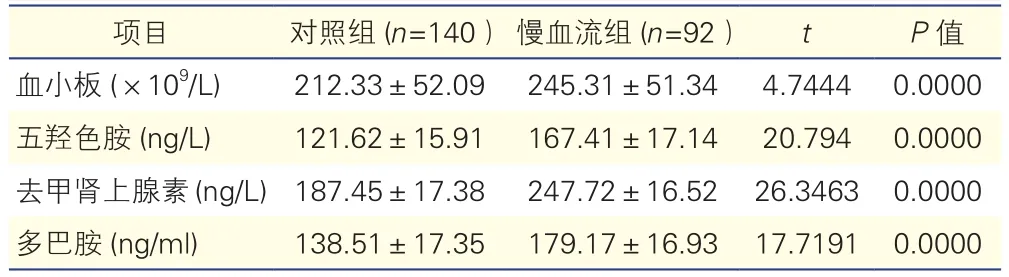
表3 两组患者血小板计数及血五羟色胺、去甲肾上腺素、多巴胺水平比较(±s)
项目 对照组(n=140)慢血流组(n=92) t P值血小板(×109/L) 212.33±52.09 245.31±51.34 4.7444 0.0000五羟色胺(ng/L) 121.62±15.91 167.41±17.14 20.794 0.0000去甲肾上腺素(ng/L)187.45±17.38 247.72±16.52 26.3463 0.0000多巴胺(ng/ml) 138.51±17.35 179.17±16.93 17.7191 0.0000
3 讨论
有研究显示,CSF可能导致急性冠状动脉综合征、心肌缺血甚至心肌梗死,值得重视[13]。已有研究证实,焦虑或抑郁是冠心病的独立危险因素,同时抑郁还是冠心病风险评估的独立预测因素,尤其对急性冠状动脉综合征患者预测价值较大[14],且与冠状动脉狭窄程度呈正相关[15]。早期CSF患者在平静状态下可无症状,但当运动量增加、情绪激动、应激反应等增加心肌耗氧时,就会因心肌相对供氧不足而导致胸痛、胸闷等类似于心绞痛的症状出现,而患者又无明显心肌损伤、冠状动脉狭窄证据,长期反复出现症状,会逐渐造成心肌细胞纤维化、心肌重构等不可逆改变。因此,加强对CSF发病机制及相关危险因素的研究有着重要的临床意义。
本研究通过对非典型冠心病患者进行冠状动脉造影,并根据结果将患者分为慢血流组和对照组,慢血流组中经HAMA评分诊为焦虑症的患者及经HAMD评分诊为抑郁症的患者比例均高于对照组,提示焦虑症或抑郁症可能是CSF的高危因素。
焦虑或抑郁与CSF关联的机制目前尚未完全阐明。相关文献曾提出,抑郁症患者存在5-HT功能低下[16],外周血5-HT主要存在于血小板中。有文献报道,抑郁或焦虑患者血小板的激活和聚集作用增强[17],这可能是抑郁或焦虑与CSF相关的可能机制之一,因为血小板与CSF密切相关[18,19]。本研究发现,慢血流组患者血小板计数和血5-HT水平均明显高于对照组,且慢血流组中HAMA评分和HAMD评分较高的患者比例均明显高于对照组,提示焦虑或抑郁状态与CSF关联可能与血小板计数及外周血5-HT水平有关。也有学者认为,抑郁症患者下丘脑-垂体-肾上腺系统的过度激活[20],从而导致交感神经兴奋性增高,血液循环中肾上腺素、NE水平升高,进而血管紧张素水平升高,微循环收缩,从而导致CSF。这就意味着焦虑症或抑郁症患者血液循环系统中高肾上腺素和NE水平可能是导致CSF的原因之一,本研究中慢血流组患者血NE及DA水平明显高于对照组也印证了这一点。另外,还有学者认为,抑郁症或焦虑症患者血浆一氧化氮代谢及血小板内皮细胞一氧化氮合成下降[21],使血管舒张功能受限,进一步导致血管内皮功能紊乱,血管紧张性增加,这可能也是抑郁或焦虑与CSF有关的原因之一。近年来研究发现,抑郁症患者炎症因子C反应蛋白及白细胞介素-6水平明显增高,这也可能与CSF相关[7]。本研究显示,焦虑或抑郁状态与CSF可能有一定关联,其机制可能与血5-HT、NE及DA水平有关,这也与目前国内外相关资料相一致。然而,目前焦虑或抑郁状态与CSF尚无明确的因果关系,有待于进一步研究。
总之,本研究显示,CSF患者中抑郁症或焦虑症患者的比例明显高于对照人群,说明焦虑或抑郁状态与CSF之间有一定关联,其机制可能与焦虑症或抑郁症患者血5-HT功能及分泌水平异常及下丘脑-垂体-肾上腺系统的过度激活有关,提示临床工作中可考虑采取抑制焦虑或抑郁患者5-HT及下丘脑-垂体-肾上腺轴的方法来减少焦虑症或抑郁症患者中CSF的发生。

