不同施肥方式下土壤氨氧化细菌的群落特征*
任灵玲, 李秀玲, 刘灵芝
不同施肥方式下土壤氨氧化细菌的群落特征*
任灵玲, 李秀玲, 刘灵芝**
(沈阳农业大学土地与环境学院/土肥资源高效利用国家工程实验室/农业部东北耕地保育重点实验室 沈阳 110866)
为了研究长期定位施肥对棕壤中氨氧化细菌(ammonia-oxidizing bacteria, AOB)种群结构多样性和垂直分布特征的影响, 本研究采用化学分析、荧光定量PCR(qPCR)和变性梯度凝胶电泳(PCR-DGGE)技术, 针对沈阳农业大学试验区不同施肥方式(不施肥、低量无机氮肥、高量无机氮肥、无机氮肥与有机肥配施)下不同土壤深度(0~20 cm、20~40 cm、40~60 cm)的土壤理化性质、AOB丰度及种群多样性进行分析, 比较不同施肥方式对土壤AOB种群的影响。结果显示, 与不施肥相比, 施肥会降低土壤pH, 增加土壤铵态氮(70.5%~939.21%)和硝态氮(253.20%~625.48%)含量。随土壤深度增加, 土壤pH升高, 铵态氮和硝态氮含量除低量无机氮肥处理外, 多呈降低趋势。土壤增施氮肥可提高AOB丰度, 降低总细菌丰度。其中, 0~20 cm土层中AOB丰度较高, 且高量无机氮肥处理的AOB数量最高, 为9.65×105拷贝数∙g-1(干土)。DGGE图谱分析显示, 不同处理下, AOB群落结构多样性指数存在明显差异(<0.05), 各多样性指数均在表层(0~20 cm)最高, 增施氮肥则显著降低AOB的多样性。聚类分析表明, 4个施肥处理中, 高量无机氮肥处理聚为一类, 其他处理则因土壤深度不同而异; 3个土壤深度中, 除不施肥处理外, 所有施肥处理均表现为0~20 cm、20~40 cm土层发生聚类, 40~60 cm则明显与其他两层分开。冗余梯度分析(RDA)显示, 硝态氮(=0.027)是造成影响AOB群落结构差异的主要原因。上述研究结果表明, 长期定位施肥土壤AOB的数量和群落结构多样性受施肥方式显著影响, 并表现出明显的垂直分布特征。与无机氮肥相比, 有机无机配施处理有助于改善土壤pH, 维持不同土壤深度下AOB群落结构多样性。
棕壤; 施肥方式; 氮肥; 氨氧化细菌(AOB); 群落结构; 土壤深度
硝化作用是土壤氮素转化的关键过程, 由氨氧化细菌(ammonia-oxidizing bacteria, AOB)和氨氧化古菌(ammonia-oxidizing archaea, AOA)驱动的氨氧化过程作为硝化作用的限速步骤, 可通过其数量、多样性、结构组成的改变来响应土壤氮素转化[1]。许多研究指出, 酸性土壤中长期施肥可改变AOA的丰度和群落结构, 中性或碱性土壤中AOB比AOA更敏感。Chen等[2]在研究水稻(L.)酸性红壤发现, 各施肥处理中AOA丰度变化明显, 而AOB几乎没有区别。Wu等[3]研究小麦(L.)中性土壤中发现, 长期施肥(22年)显著改变AOB的群落结构, 而AOA则保持不变。近年来, Hayatsu等[4]在日本茶园土壤中成功分离出嗜酸性AOB, 使得这类微生物在酸性土壤中的作用有了新的认知。研究表明, 土壤pH、氮素种类、土壤类型、施肥方式和作物品种等因素, 均可对氨氧化微生物产生特异的选择性。Fan等[5]研究长期施肥水稻土指出, AOB的数量和群落结构较AOA变化明显, 增施氮肥可显著提高AOB的多样性。Ai等[6]发现, 小麦与玉米(L.)轮作潮土中, 施加氮肥可显著提高AOB数量。Kumar等[7]和Liu等[8]研究酸性土壤时均指出, 配施有机肥可显著增加土壤中AOB的数量和群落结构多样性。Ouyang等[9]在美国的犹他州粉砂壤土中也发现, 有机氮肥可显著提高AOB-A基因丰度, 且氨氧化细菌的活性随有机肥料增加而增加。
农业生态系统中, 不同施肥方式可通过影响土壤理化特征, 改变功能微生物的丰度及群落结构组成, 进而对土壤质量和生态功能产生影响。许多研究表明, 较单施化肥相比, 无机有机氮肥配施的农田管理模式, 有助于优化土壤微生物群落结构, 改良土壤理化属性和养分供应状况, 维持并提高土壤质量。Kumar等[7]研究长期施肥的水稻土时指出, 无机有机肥配施可以缓解土壤酸化, 稳定土壤功能和丰富功能基因。Zhao等[10]研究小麦与水稻轮作的黏土时指出, 无机有机肥配施可显著提高土壤有效养分、微生物量以及微生物多样性, 对于可持续的农业生产来说, 无机有机肥配施是一种较好的施肥方式。然而, 在长期施肥模式下, 针对棕壤中氨氧化细菌群落结构多样性对不同施肥方式, 特别是有机无机肥配施的响应特征, 及其随土壤深度增加的变化差异等相关研究少有报道, 这些研究结果对于探索不同施肥模式下土壤氮素转移与变化规律具有指导意义。
为进一步认识长期定位不同施肥模式下棕壤氨氧化细菌的变化特征, 采用PCR-DGGE和qPCR技术, 以沈阳农业大学长期定位试验田为平台, 比较4种施肥方式下, 长期定位棕壤AOB的丰度与种群结构差异, 同时结合土壤理化性质的分析, 探讨AOB对不同施肥方式的响应机制和垂直分布特征, 为维持土壤质量、稳定生产力提供依据。
1 材料与方法
1.1 试验材料与样品采集
试验地位于辽宁省沈阳市沈阳农业大学长期定位试验站(41°49′N, 123°34′E), 该地区属于大陆性季风气候, 年平均气温8.0 ℃, 年均降水量为705 mm。土壤类型属于中厚层棕壤。长期定位试验始于1987年, 种植作物为玉米。施肥方式设置为4个处理, 分别为不施肥[CK, 0 kg(N)∙hm-2]、施低量氮肥(N2, 年施尿素氮135 kg∙hm-2)、施高量氮肥(N4, 年施尿素氮270 kg∙hm-2)和尿素氮肥与有机肥配施(M2N2, 其中尿素氮135 kg∙hm-2; 有机肥为猪厩肥, 其中含纯N 135 kg·hm-2)。小区面积为69 m2, 不同施肥处理3次重复。
土壤采集于2015年7月20日(玉米抽雄期), 采用对角线五点采样法, 采集0~20 cm、20~40 cm和40~60 cm剖面深度的土壤。每个小区同一土层的土壤组成混合代表样, 所取土壤去除杂物, 碾碎后混匀, 一部分用冰盒保存带回实验室后-80 ℃保存, 另一部分装入自封袋带回实验室后4 ℃保存, 用鲜土样测定硝化强度、铵态氮和硝态氮含量, 剩余土壤自然风干后测定土壤pH。
1.2 土壤理化指标的测定
土壤pH测定采用电位法(土∶水=1∶2.5); 土壤铵态氮和硝态氮用0.01 mol∙L-1CaCl2浸提新鲜土样后, 采用连续流动注射分析仪(AA3-HR, SEAL, Germany)测定; 硝化强度的测定参照赵爽等[11]的方法。
1.3 土壤微生物总DNA提取
土壤微生物DNA的提取采用E.Z.N.Z.TM Soil DNA Kit(OMEGA), 获得DNA后用Qubit测定浓度, 并采用1%琼脂糖凝胶电泳鉴定DNA质量,-20 ℃保存。
1.4 细菌16S rDNA和AOB amoA 基因的荧光定量PCR
分别用引物515F/907R和A-1F/A-2R扩增细菌16S rDNA和AOBA基因, PCR体系为50mL, 分别含10×Buffer 5.0mL, dNTP(各2.5mmol×L-1) 4.0mL, 上下游引物(10mmol×L-1)各1.0mL, DNA模板(1~10 ng) 2mL, rTaq(5 U×mL-1)1.0mL, 最后用ddH2O补至50.0mL。PCR程序: 94 ℃预变性5 min; 94 ℃变性30 s, 53 ℃退火30 s, 72 ℃延伸30 s, 45个循环; 最后72 ℃延伸10 min。回收PCR产物连接至pMD18-T载体, 转化至大肠杆菌DH5α感受态中, 经Amp+、IPTG和X-gal的LB平板筛选阳性克隆, 测序分析。
标准曲线的制作: 提取测序正确的细菌16S rDNA、AOBA基因的阳性克隆质粒, 用Qubit测其浓度, 按10倍梯度稀释质粒成实时荧光定量PCR测定标准品,-20 ℃保存。
荧光定量PCR在ABI 7500 StepOne Plus上进行, 反应体系为20mL, 分别含GoTaq®qPCR Master Mix 10.0mL, 上下游引物各0.8mL(10mmol×L-1), DNA模板2.0mL(1~10 ng), 用ddH2O补至20.0mL。qPCR引物及程序如表1所示。
将稀释100倍的土壤DNA样品与标准品一起进行Real-Time PCR检测, 包括阴性对照在内每个样品设3个重复。细菌16S rDNA基因标准曲线的2为0.99, 扩增效率为99.67%, AOB-A基因标准曲线的2为0.993, 扩增效率为107.73%。

表1 细菌16S rDNA和氨氧化细菌(AOB)定量PCR扩增引物及反应条件
1.5 氨氧化细菌16S rDNA的PCR扩增
利用巢式扩增方法扩增氨氧化细菌的V3区域, 反应体系为25 μL, 其中模板1 μL、前后引物(20 mmol×L-1)各0.5 μL、2´Taq Master Mix 12.5 μL、DNA-Free Water 10.5 μL。共使用3对引物8F/1492R、CTO 189F/654R、341F/519R(表2), 其中CTO 189F/654R是针对-AOB的一对特异性较高的引物。最后得到的PCR产物约190 bp, 用0.8%琼脂糖凝胶电泳检测后可用于DGGE分析。
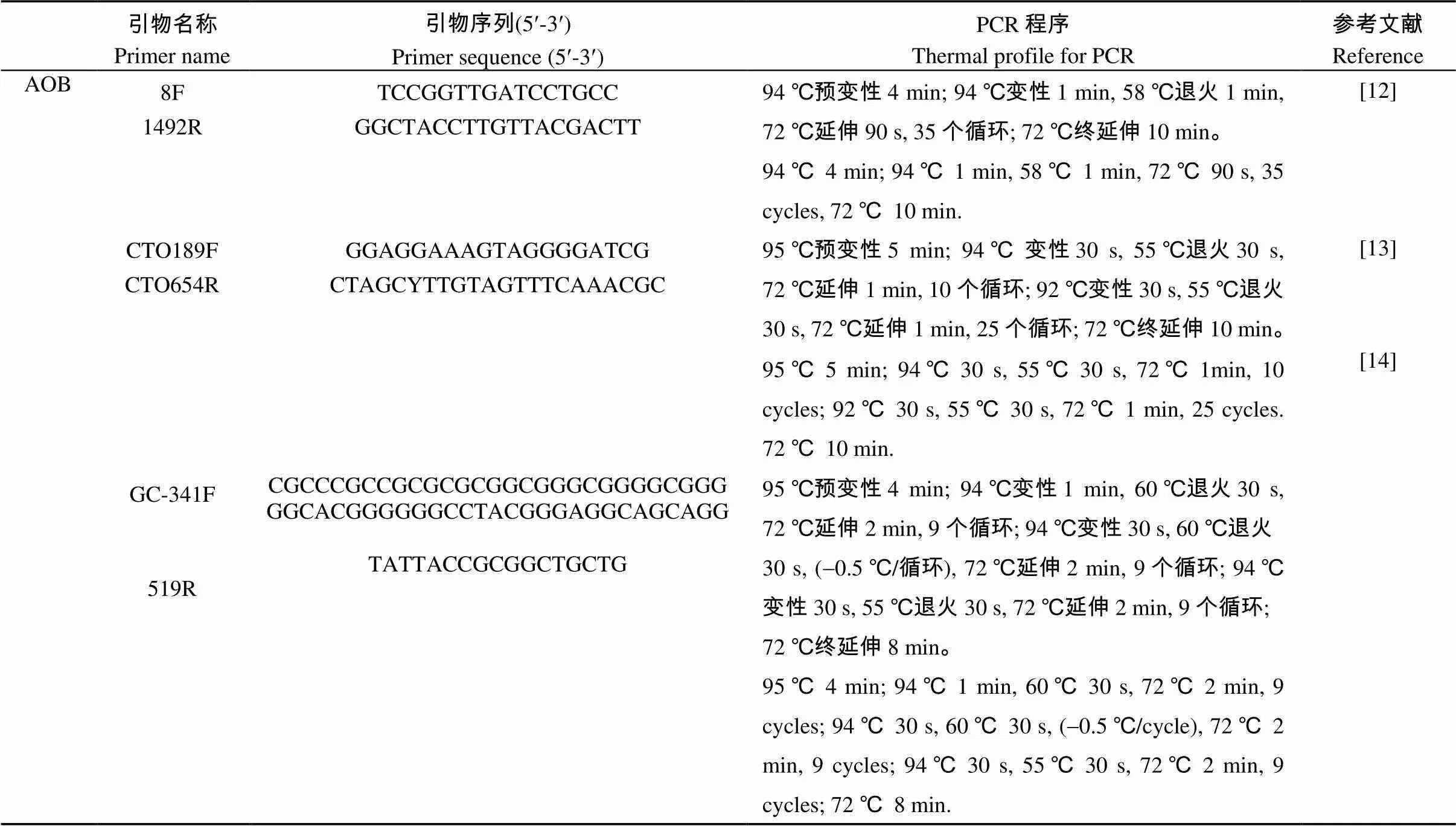
表2 用于PCR-DGGE的扩增引物及反应程序
1.6 PCR产物的变性梯度凝胶电泳(DGGE)分析
移取PCR产物15 μL进行DGGE分析, 变性剂梯度范围为35%~55%, 聚丙烯酰胺凝胶浓度为8%(100%的变性剂为尿素7 mol×L-1和40%的去离子甲酰胺), 在1´TAE缓冲液中, 180 V、60 ℃缓冲液中电泳6 h。电泳后采用Gene Finder法进行染色。然后用Gel-Doc XR凝胶成像系统照相保存。
1.7 数据分析
数据处理采用SPSS 20.0数据处理软件, 差异显著性分析利用单因素方差分析(ANOVA)和多重比较法(Duncan); DGGE图谱分析采用Quantity-One图像分析软件。土壤理化因子与氨氧化微生物群落特征相关性分析采用Pearson相关分析法。用Shannon多样性指数()、均匀度(H)和丰富度()等评价AOB群落结构多样性。采用CANOCO 4.5.1软件(Microcomputer Power, Ithaca, USA)分析AOB群落结构和土壤理化因子间的关系。多样性指数计算公式为:=-∑(n/)ln(n/),H=/ln, 式中n为单一条带的强度,为所有条带的总强度,为每一泳道总的条带数。
2 结果与分析
2.1 长期不同施肥处理下土壤理化性质的变化
不同施肥处理对棕壤理化性质产生不同影响(表3)。与不施肥相比, 所有施肥处理均显著降低了0~20 cm土壤的pH(4.55~5.47); 同时, 施加无机肥的N2和N4处理显著降低40~60 cm土壤pH, 而施加有机肥的M2N2处理则表现出相反结果(<0.05)。同一施肥处理下, 0~20 cm土壤pH不同程度地低于其他土壤深度。土壤氮素含量表现为, 与不施肥相比, 所有施肥处理均可显著增加土壤NH4+-N(0.51~5.30 mg·kg-1)和NO3--N (6.24~45.27 mg·kg-1)的含量(<0.05)。除N2处理外, 同一施肥处理中, 0~20 cm土壤铵态氮与硝态氮含量均不同程度高于其他土壤深度。N2处理在相同土壤深度下, 与CK处理间硝化强度无明显差异, M2N2与N4处理可明显增加表层土壤(0~20 cm)硝化强度。
2.2 长期不同施肥处理下土壤总细菌和AOB数量的变化
以16S rDNA和细菌A基因为靶标, 用荧光定量PCR测定土壤总细菌和AOB的数量。结果显示, 不同施肥处理下土壤总细菌数量为4.30×109~7.27×1011拷贝数∙g-1(干土)。与不施肥相比, 所有施肥处理均显著降低了0~20 cm土壤细菌的数量; 各施肥处理间, 在相同土壤深度下, N4处理土壤细菌数量均不同程度地低于N2和M2N2处理。相同施肥处理下, M2N2土壤细菌数量在不同土层中差异不明显, 其他处理均表现为40~60 cm土壤细菌数量均显著低于0~20 cm土层(图1)。
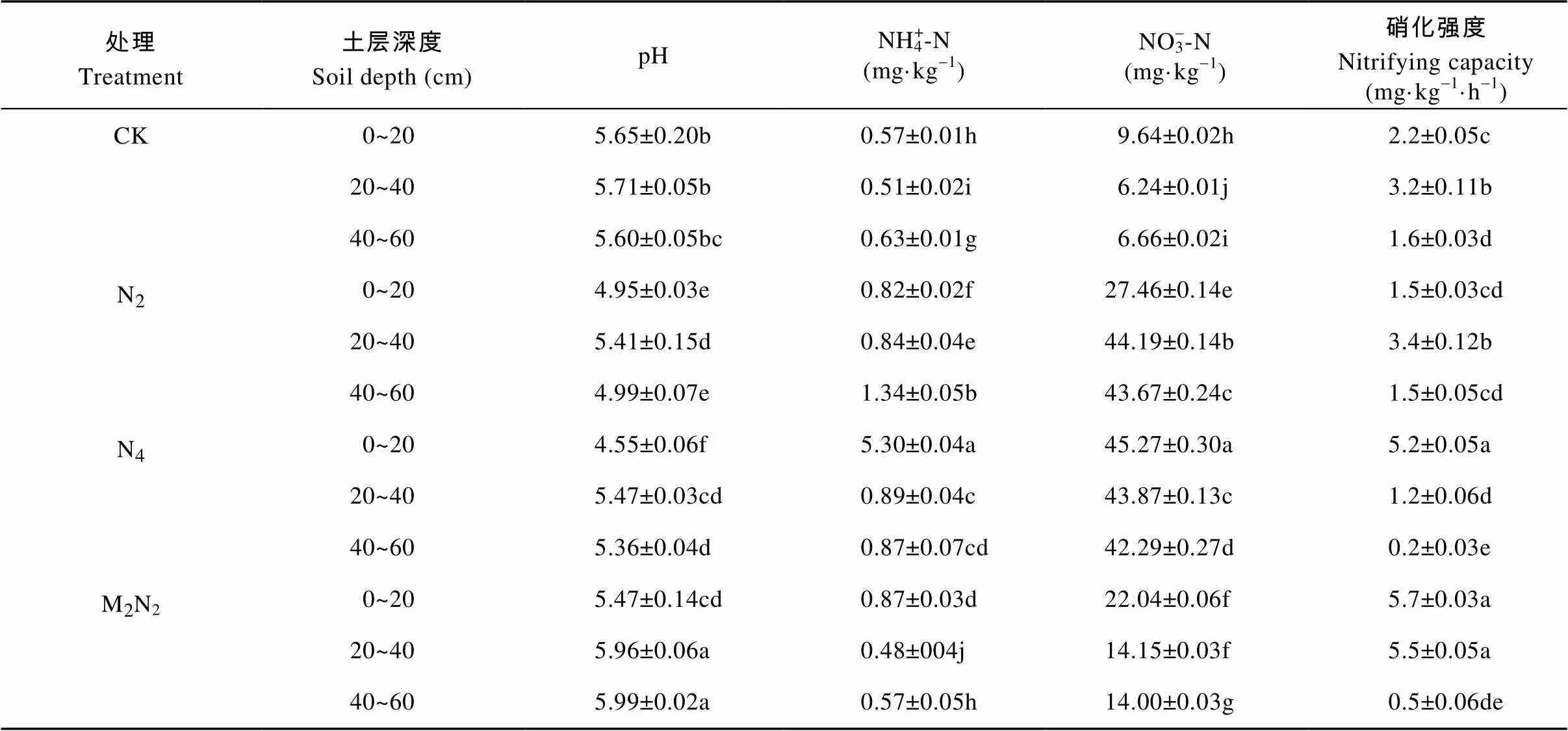
表3 不同施肥处理不同深度土壤理化性质的变化
CK、N2、N4和M2N2分别为不施肥、施低量氮肥、施高量氮肥和有机无机肥配施处理。表中数据为平均值±标准误差, 每列数据标有不同字母表示Duncan检测下差异显著(<0.05)。CK: no fertilizer; N2: low N fertilizer; N4: high N fertilizer; M2N2: organic manure combined with chemical fertilizer. Data are mean ± standard deviation (=3). In each column, data marked with different letters are significantly different according to Duncan test (< 0.05).
土壤AOB的数量为1.31×105~9.65×105拷贝数∙g-1(干土)。与不施肥相比, 低量氮肥处理N2显著增加了不同深度土壤中AOB数量, 高量氮肥处理N4中AOB在20~40 cm土层迅速升高, 在0~20 cm和40~60 cm土层则显著降低。有机无机肥配施处理(M2N2)对0~40 cm土壤中AOB无明显影响, 却显著降低40~60 cm土层AOB数量(图1)。总体上, 土壤施肥后, 细菌和氨氧化细菌主要分布在0~40 cm土层区域中。
土壤AOB与总细菌的数量比值为45.4~55.2。施肥总体上增加了二者的比值, 且无机氮肥对二者比值的增加不同程度地高于无机有机氮肥配施处理(M2N2), 该结果应与增施氮肥后土壤细菌数量下降有关。

图1 不同施肥处理下不同土层土壤细菌(A)和氨氧化细菌(AOB, B)基因丰度特征
CK、N2、N4和M2N2分别为不施肥、施低量氮肥、施高量氮肥和有机无机肥配施处理。图中不同字母表示不同施肥处理不同土层间差异显著(<0.05)。CK: no fertilizer; N2: low N fertilizer; N4: high N fertilizer; M2N2: organic manure combined with chemical fertilizer. Different letters above the bars indicate significant differences among different treatments at different soil depths based on protected LSD test (< 0.05).
2.3 长期不同施肥处理下土壤AOB细菌群落结构的变化
2.3.1 DGGE图谱
DGGE技术是研究微生物种群结构的免培养手段之一, 尽管检测通量有限, 且只能检测生境中数量占优势的微生物种群, 该技术重现性强、检测速度快、价格经济、结果直观等特点, 使其一直被广泛应用于不同生境中微生物种群多样性及空间分布检测等相关领域[15-16]。不同施肥方式下土壤AOB群落结构的DGGE图谱见图2A。不同处理土壤AOB群落结构的DGGE图谱在电泳条带数目、强弱和迁移位置均存在一定程度的差异, 显示出AOB对环境因子变化的响应特征。与不施肥相比, 施肥处理土壤AOB的条带数减少。图中的共有条带(8、14和19)说明不同施肥处理土壤存在共有的AOB类群, 但其亮度不同, 说明这些AOB可能通过数量改变来响应环境的变化。条带17、22只存在于不施肥(CK)处理土壤中, 而条带9、10、18只存在于高量无机氮肥(N4)处理土壤中, 说明这些AOB类群对土壤中氮素变化较为敏感。聚类分析显示(图2B), 12个处理(施肥处理´土层)聚为两大类群, N4处理单独聚成一类, 且0~20 cm与20~40 cm土层土壤之间的相似性达71%, 说明施加高量无机氮肥可明显改变土壤中AOB的群落结构。另外, 所有供试处理0~20 cm与20~40 cm土层土壤明显聚为一类, 说明AOB群落结构在0~20 cm和20~40 cm土层较为相似, 但在深层土壤(40~60 cm)发生明显变化。

图2 不同施肥处理下不同土层土壤氨氧化细菌(AOB)16S rDNA基因PCR-DGGE电泳图谱(A)和聚类分析(B)
CK、N2、N4和M2N2分别为不施肥、施低量氮肥、施高量氮肥和有机无机肥配施处理。L1、L2和L3分别代表0~20 cm、20~40 cm和40~60 cm土层。CK: no fertilizer; N2: low N fertilizer; N4: high N fertilizer; M2N2: organic manure combined with chemical fertilizer. L1, L2 and L3 represent soil depths of 0-20 cm, 20-40 cm and 40-60 cm, respectively.
2.3.2 多样性指数
不同施肥处理下不同深度土壤AOB的Shannon多样性指数()、均匀度(H)和丰富度()存在明显差异(表4)。与不施肥相比, 施肥处理显著降低了土壤中AOB的多样性、均匀度和丰富度指数。不同施肥处理下AOB的Shannon多样性指数()、均匀度(H)和丰富度()指数表现为: CK>N4>M2N2>N2。相同施肥处理下, 土壤中AOB多样性()、均匀度(H)和丰富度()指数均在表土层0~20 cm最高。随土壤深度增加, CK、N2和N4处理下各多样性指数均表现出显著降低的趋势, M2N2处理处理下AOB多样性指数则在不同土层中无明显差异。供试土壤中, N2处理各土层AOB种群多样性、均匀度和丰富度(40~60 cm层除外)指数均为最低, 而N4处理则不同程度地提高了20~40 cm土壤AOB的各多样性指数, 说明土壤施氮量可改变AOB在不同土层的分布情况。
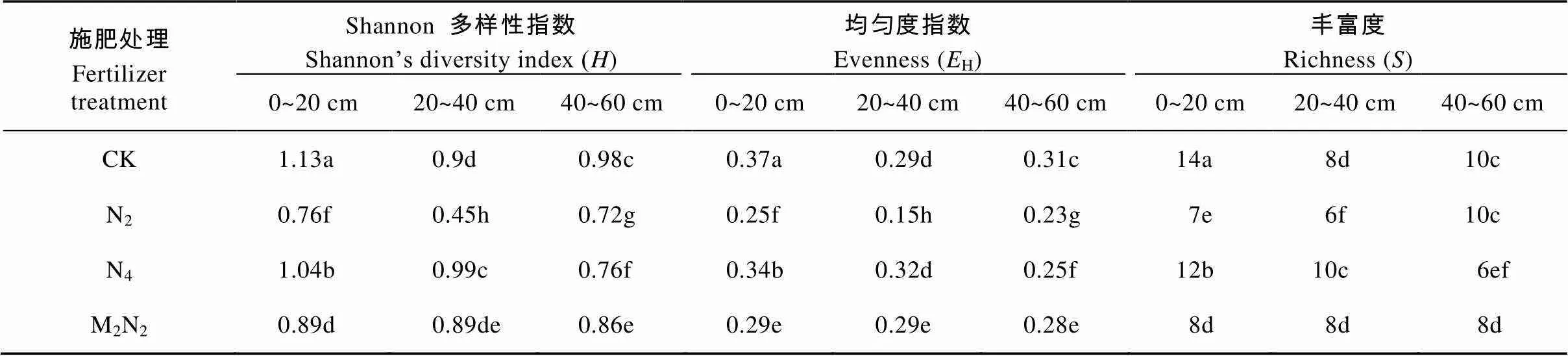
表4 不同施肥处理下不同土层土壤氨氧化细菌(AOB)的Shannon多样性指数(H)、均匀度(EH)和丰富度(S)
CK、N2、N4和M2N2分别为不施肥、施低量氮肥、施高量氮肥和有机无机肥配施处理。表中数据为平均值±标准误差, 每列数据标有不同字母表示Duncan检测下差异显著(<0.05)。CK: no fertilizer; N2: low N fertilizer; N4: high N fertilizer; M2N2: organic manure combined with chemical fertilizer. Data are mean ± standard deviation (=3). In each column, data marked with different letters are significantly different according to Duncan test (< 0.05).
2.4 长期不同施肥处理下土壤中AOB数量、丰度、群落结构与土壤理化性质的相关性分析
如表5所示, 土壤硝态氮含量与细菌丰度呈极显著负相关(=-0.586,<0.01), 铵态氮含量则与AOB丰度呈显著正相关(=0.384,<0.05), 土壤pH与细菌呈显著正相关(=0.341,<0.05), 与AOB呈显著负相关(=-0.381,<0.05)。多样性指数与理化因子的相关性分析表明, AOB种群多样性指数()(=-0.403,<0.05)、均匀度指数(H)(=-0.447,<0.01)均与硝态氮呈显著负相关。丰富度()与土壤铵态氮(=0.631,<0.01)呈极显著正相关, 与pH(=-0.376,<0.05)均呈显著负相关。土壤细菌与氨氧化细菌均与硝化强度无明显相关性。

表5 土壤理化因子与氨氧化细菌(AOB)群落间的相关性
LogA:A基因拷贝数的对数; log16S rDNA: 16S rDNA基因拷贝数的对数。*和**分别表示<0.05和<0.01水平显著相关。LogA: logarithm of number ofA gene copies; Log16S rDNA: logarithm of number of 16S rDNA copies. * and ** mean significant correlation at 0.05 and 0.01 levels, respectively.
以不同施肥处理土壤 DGGE条带作为响应变量, 用土壤pH、铵态氮、硝态氮、硝化强度作为解释变量进行冗余分析(RDA), 冗余分析中箭头表示环境因子, 箭头所处的象限表示环境因子与排序轴的正负相关性, 箭头连线长度表示该环境因子与样本分布相关程度的大小, 箭头连线间的夹角, 代表环境因子间的相关程度(图3)。排序轴特征值分别为: 0.156、0.110、0.078、0.061, 分别解释了15.1%、11.0%、7.8%、6.1%的AOB的群落变化。硝态氮的影响高于其他环境因子, 从图中可以看出土壤硝态氮(=0.027)是造成群落差异的主要因素。pH(=0.113)、铵态氮(=0.35)、硝化强度(=0.545),>0.05, 对AOB群落结构没有显著影响。

图3 土壤氨氧化细菌与环境因子的冗余分析
1、2和3为不施肥处理的0~20 cm、20~40 cm和40~60 cm土层; 4、5和6为施低量氮肥N2的0~20 cm、20~40 cm和40~60 cm土层; 7、8和9为施高量氮肥处理的0~20 cm、20~40 cm和40~60 cm土层; 10、11和12为M2N2有机无机肥配施处理的0~20 cm、20~40 cm和40~60 cm土层。In the figure, 1, 2 and 3 indicate 0-20 cm, 20-40 cm and 40-60 cm soil layers of no fertilizer treatment, respectively. 4, 5 and 6 indicate 0-20 cm, 20-40 cm and 40-60 cm soil layers of low N fertilizer treatment, respectively. 7, 8 and 9 indicate 0-20 cm, 20-40 cm and 40-60 cm soil layers of high N fertilizer treatment, respectively. 10, 11 and 12 indicate 0-20 cm, 20-40 cm and 40-60 cm soil layers of organic manure combined with chemical fertilizer treatment, respectively.
3 讨论
3.1 不同施肥处理及土壤深度变化对AOB数量的影响
通常认为, 土壤pH和肥料可影响土壤中AOB的数量, 土壤中氨氧化微生物数量与种群结构直接影响着土壤氮素供应状况[2]。本研究中AOB数量为1.31×105~9.65×105拷贝数∙g-1(干土), 与Chen等[2]研究长期施肥水稻土中AOB数量平均值为1.90×105拷贝数∙g-1(干土)的结果相似, 相较于Liu等[8]在南方酸性土壤中AOB数量108拷贝数∙g-1(干土)数量级低, 且总AOB数量与铵态氮呈显著正相关。杨亚东等[17]与Wang等[18]指出, AOB适合在中性至碱性、氮素含量丰富的土壤中生存, AOB数量与土壤pH呈显著负相关。研究中, 长期施肥导致土壤pH降低, 土壤呈酸性状态, 土壤pH与AOB数量呈显著负相关。分析其原因可能是AOB在适应长期施肥过程中, 耐酸型AOB数量增多。
通常情况下, NH3是微生物进行氨氧化作用的直接底物, NH4+则作为间接底物影响氨氧化微生物的种类和数量[1]。由于酸性土壤中NH4+解离出来的NH3较少, 从而抑制AOB的生长[19]。研究中, 高量无机氮肥(N4)处理下, 20~40 cm层土壤AOB数量明显高于其他处理, 但土壤中NH4+含量却小于1 mg·kg-1, 其可能原因应是, 有些AOB不以NH4+作为惟一的底物, 而以有机化合物作为底物生长(根系分泌物)[20]; 另外, 土壤中存在未知的AOB, 其对NH4+有较高的亲和力, 如在酸性土壤中占优势的亚硝化螺旋菌()[21]。
施肥过程中, 不同施肥方式带入土壤中的物料不同, 并在灌溉等管理措施下, 使得不同深度土壤中微生物结构与土壤性质产生差异。李晨华等[22]研究新疆灰漠土发现, 长期施肥可显著增加表层(0~20 cm)甚至是深层(20~300 cm)土壤氨氧化微生物的相对丰度。Wang等[18]也发现, 稻田土壤0~20 cm表土层中, AOB数量是20~80 cm土层的439倍。本研究也获得了相似结果, 细菌和AOB主要分布在0~20 cm和20~40 cm土层区域, 其原因可能是长期施入的尿素氮随降水等措施下移至深土层, 并作为底物, 刺激AOB的生长。另外, 李晨华等[23]在绿洲农田土壤的研究指出, 氮肥可刺激表层土壤中AOB的生长,细菌细胞可随降水运移至深土层。
3.2 不同施肥处理及土壤深度变化对AOB群落结构多样性的影响
由DGGE图谱可知, 不同土层不同施肥处理之间AOB条带存在明显差异, 表明长期施肥处理显著改变了土壤氨氧化细菌群落结构特征。与CK相比, 所有施肥处理(N2、N4和M2N2)的AOB群落结构多样性均有所降低, 该结果与Ai[6]和Chu等[24]研究结果一致。其中, M2N2处理在一定程度上可维持不同土层AOB多样性指数。其原因可能是长期施氮肥降低土pH(表1), 导致AOB群落结构多样性降低。施用有机肥可通过维持土壤pH, 进而稳定AOB群落结构多样性。另外, 由于施入土壤中的氮素不同, 氮素种类与含量的差异, 也可能是导致AOB在土壤中分布差异的原因[22]。
研究不同土层AOB群落结构多样性表现为, 除M2N2处理外, 所有处理0~20 cm土层AOB多样性指数显著高于20~40 cm和40~60 cm土层, M2N2处理不同土壤深度差异不明显。究其原因应是, 0~20 cm土层中可利用资源较为丰富、氧气相对充足, 微生物群落之间的竞争关系差, 所以对在数量上不占优势的功能群落影响较小, 致使多样性指数较高。随着土壤深度增加, 生态环境难以满足土壤中AOB的生长需求, 微生物多样性指数降低。有机肥配施方式有助于增加各土层中多种养分供应, AOB能够很好地利用土壤中养分, 与其他种群竞争, 进而增加种群多样性[25]。
4 结论
研究结果表明, 长期定位施肥可显著降低0~20 cm土壤pH, 提高土壤铵态氮、硝态氮含量, 土壤硝化强度则变化不明显。土壤中AOB的数量和群落结构多样性受施肥方式显著影响, 并表现出明显的垂直分布特征。其中, 土壤中增施氮肥可提高AOB的丰度, 降低细菌丰度。土壤中AOB多样性指数均在表土层(0~20 cm)最高, 增施氮肥则显著降低AOB的多样性。有机与无机肥配施不仅有助于改善土壤酸化现象, 并可稳定不同深度土壤中AOB种群多样性。长期施肥棕壤中, 硝态氮含量是影响AOB群落结构多样性的重要因子。
[1] LI Y Y, CHAPMAN S J, NICOL G W, et al. Nitrification and nitrifiers in acidic soils[J]. Soil Biology and Biochemistry, 2018, 116: 290–301
[2] CHEN X, ZHANG L M, SHEN J P, et al. Abundance and community structure of ammonia-oxidizing archaea and bacteria in an acid paddy soil[J]. Biology and Fertility of Soils, 2011, 47(3): 323–331
[3] WU Y C, LU L, WANG B Z, et al. Long-term field fertilization significantly alters community structure of ammonia-oxidizing bacteria rather than archaea in a paddy soil[J]. Soil Science Society of America Journal, 2011, 75(4): 1431–1439
[4] HAYATSU M, TAGO K, UCHIYAMA I, et al. An acid-tolerant ammonia-oxidizing γ-proteobacterium from soil[J]. The ISME Journal, 2017, 11(5): 1130–1141
[5] FAN F L, YANG Q B, LI Z J, et al. Impacts of organic and inorganic fertilizers on nitrification in a cold climate soil are linked to the bacterial ammonia oxidizer community[J]. Microbial Ecology, 2011, 62(4): 982–990
[6] AI C, LIANG G Q, SUN J W, et al. Different roles of rhizosphere effect and long-term fertilization in the activity and community structure of ammonia oxidizers in a calcareous fluvo-aquic soil[J]. Soil Biology and Biochemistry, 2013, 57: 30–42
[7] KUMAR U, SHAHID M, TRIPATHI R, et al. Variation of functional diversity of soil microbial community in sub-humid tropical rice-rice cropping system under long-term organic and inorganic fertilization[J]. Ecological Indicators, 2017, 73: 536–543
[8] LIU H Y, LI J, ZHAO Y, et al. Ammonia oxidizers and nitrite-oxidizing bacteria respond differently to long-term manure application in four paddy soils of south of China[J]. Science of the Total Environment, 2018, 633: 641–648
[9] OUYANG Y, REEVE J R, NORTON J M. Soil enzyme activities and abundance of microbial functional genes involved in nitrogen transformations in an organic farming system[J]. Biology and Fertility of Soils, 2018, 54(4): 437–450
[10] ZHAO J, NI T, LI Y, et al. Responses of bacterial communities in arable soils in a rice-wheat cropping system to different fertilizer regimes and sampling times[J]. PLoS One, 2014, 9(1): e85301
[11] 赵爽, 胡江, 沈其荣. 两个水稻品种根际土壤细菌和氨氧化细菌的群落结构差异[J]. 土壤学报, 2010, 47(5): 939–945 ZHAO S, HU J, SHEN Q R. Difference in community structure of bacteria and ammonia-oxidizing bacteria in rhizosphere between two different rice cultivars[J]. Acta Pedologica Sinica, 2010, 47(5): 939–945
[12] WANG L, LI T. Effects of seasonal temperature variation on nitrification, anammox process, and bacteria involved in a pilot-scale constructed wetland[J]. Environmental Science and Pollution Research, 2015, 22(5): 3774–3783
[13] MA Y X, TAO W, LIU J, et al. Response of ammonia-oxidizing betaproteobacteria to short-term fertilization in a salt marsh in China[J]. Journal of Oceanology and Limnology, 2018, 36(2): 351–361
[14] FOTIDIS I A, TREU L, ANGELIDAKI I. Enriched ammonia-tolerant methanogenic cultures as bioaugmentation inocula in continuous biomethanation processes[J]. Journal of Cleaner Production, 2017, 166: 1305–1313
[15] 黄鑫, 杨弢, 吴昊, 等. 成都老官山汉墓出土竹简饱水保存期间的细菌群落结构[J]. 应用与环境生物学报, 2018, 24(3): 493–499 HUANG X, YANG T, WU H, et al. Bacterial community structure in waterlogged bamboo slips excavated from the Laoguanshan Han Dynasty Tomb of Chengdu[J]. Chinese Journal of Applied and Environmental Biology, 2018, 24(3): 493–499
[16] GARCIAS-BONET N, ARRIETA J M, DE SANTANA C N, et al. Endophytic bacterial community of a Mediterranean marine angiosperm ()[J]. Frontiers in Microbiology, 2012, 3: 342
[17] 杨亚东, 张明才, 胡君蔚, 等. 施氮肥对华北平原土壤氨氧化细菌和古菌数量及群落结构的影响[J]. 生态学报, 2017, 37(11): 3636–3646 YANG Y D, ZHANG M C, HU J W, et al. Effects of nitrogen fertilizer application on abundance and community structure of ammonia oxidizing bacteria and archaea in a North China agricultural soil[J]. Acta Ecologica Sinica, 2017, 37(11): 3636–3646
[18] WANG J C, ZHANG L, LU Q, et al. Ammonia oxidizer abundance in paddy soil profile with different fertilizer regimes[J]. Applied Soil Ecology, 2014, 84: 38–44
[19] XIA W W, ZHANG C X, ZENG X W, et al. Autotrophic growth of nitrifying community in an agricultural soil[J]. The ISME Journal, 2011, 5(7): 1226–1236
[20] TAGO K, OKUBO T, SHIMOMURA Y, et al. Environmental factors shaping the community structure of ammonia-oxidizing bacteria and archaea in sugarcane field soil[J]. Microbes and environments, 2015, 30(1): 21–28
[21] YAO H Y, CAMPBELL C D, CHAPMAN S J, et al. Multi-factorial drivers of ammonia oxidizer communities: Evidence from a national soil survey[J]. Environmental Microbiology, 2013, 15(9): 2545–2556
[22] 李晨华, 张彩霞, 唐立松, 等. 长期施肥土壤微生物群落的剖面变化及其与土壤性质的关系[J]. 微生物学报, 2014, 54(3): 319–329 ZHANG C H, ZHANG C X, TANG L S, et al. Effect of long-term fertilizing regime on soil microbial diversity and soil property[J]. Acta Microbiologica Sinica, 2014, 54(3): 319–329
[23] 李晨华, 贾仲君, 唐立松, 等. 不同施肥模式对绿洲农田土壤微生物群落丰度与酶活性的影响[J]. 土壤学报, 2012, 49(3): 567–574 LI C H, JIA Z J, TANG L S, et al. Effect of model of fertilization on microbial abundance and enzyme activity in oasis farmland soil[J]. Acta Pedologica Sinica, 2012, 49(3): 567–574
[24] CHU H Y, FUJII T, MORIMOTO S, et al. Community structure of ammonia-oxidizing bacteria under long-term application of mineral fertilizer and organic manure in a sandy loam soil[J]. Applied and Environmental Microbiology, 2007, 73(2): 485–491
[25] ZHANG Q, LIANG G Q, MYROLD D D, et al. Variable responses of ammonia oxidizers across soil particle-size fractions affect nitrification in a long-term fertilizer experiment[J]. Soil Biology and Biochemistry, 2017, 105: 25–36
Community characteristics of soil ammonia oxidizing bacteria after different fertilizer applications*
REN Lingling, LI Xiuling, LIU Lingzhi**
(College of Land and Environment, Shenyang Agricultural University / National Engineering Laboratory for Efficient Utilization of Soil and Fertilizer Resources / Arable Land Conservation in Northeast China, Ministry of Agriculture, Shenyang 110866, China)
Studies about ammonia oxidizing bacteria (AOB) have mainly focused on the topsoil and little has remained known about community distribution in the subsoil. There therefore has remained the need to understand the impact of long-term fertilization on AOB abundance, community structure and vertical distribution in order to deepen the exploration of microbial mechanisms of nitrogen (N) transformation and to develop sound fertilization regimes for sustainable soil quality in the study area and beyond. Thus, a long-term (1987-2015) fertilization experiment was set up in the brown earth in Shenyang Agriculture University, Liaoning Province, China. Four treatments were set, no fertilizer (CK), low N fertilizer (N2), high N fertilizer (N4) and low N fertilizer plus organic mature (M2N2). Soil samples were collected at three different depths (0-20 cm, 20-40 cm and 40-60 cm). The soil physico-chemical properties, 16S rDNA and AOB-A gene abundance (real-time PCR, qPCR) and AOB community structure and diversity (denaturing gradient gel electrophoresis, PCR-DGGE) were investigated. While soil pH decreased, the content of soil ammonium N (NH4+-N) increased by 70.5%–939.21% and that of nitrate N (NO3--N) by 253.20%–625.48% in the fertilization treatments over CK treatment. Also while soil pH increased, the contents of soil NH4+-N and NO3--N decreased with increasing soil depth, except for N2treatment. The results of qPCR showed that fertilization treatments increased AOB abundance, but decreased total bacterial abundance compared to CK treatment. AOBA gene abundance was generally higher at the 0–20 cm than at the 20-40 cm and 40-60 cm soil layers. AOB abundance peaked in the N4treatment, with 9.65×105copies per g dry soil. The Shannon diversity (), evenness (H) and richness () indexes of AOB from DGGE fingerprints responded increasingly significantly (< 0.05) to fertilization regimes and soil-fertilization interactions with increasing soil depth. Although the tested diversity indexes were highest in the surface soil (0-20 cm), N fertilizer treatments (N2, N4and M2N2) significantly reduced AOB diversity indexes. Based on cluster analysis of the DGGE fingerprints, AOB community structure in the soil varied with fertilization treatments and soil depth. Three soil depths of high N fertilizer (N4) treatment was grouped together clearly. For other treatments, it was grouped according to soil depth with no discernible difference in AOB community structure among CK, N2and M2N2treatments. The 0-20 cm and 20-40 cm deep soils under fertilizer treatments formed single cluster with no less than 57% similarity, while 40-60 cm soil layer formed another cluster. Redundant gradient analysis (RDA) further showed that NO3--N (= 0.027) was the key factor that shaped AOB community under different fertilization treatments. The results indicated that AOB number and community structure diversity after long-term fertilization significantly varied with fertilization treatment, and showed obvious vertical distribution characteristics. Compared with chemical fertilizer (N2and N4) application, organic manure plus chemical fertilizer (M2N2) more favorably improved soil pH and maintained AOB community diversity in the subsoil.
Brown soil; Fertilization regime; Nitrogen fertilizer; Ammonia oxidizing bacteria (AOB); Community structure; Soil depth
, E-mail: liulingzhi2006@163.com
S147.2
A
2096-6237(2019)01-0011-09
10.13930/j.cnki.cjea.180645
任灵玲, 李秀玲, 刘灵芝. 不同施肥方式下土壤氨氧化细菌的群落特征[J]. 中国生态农业学报(中英文), 2019, 27(1): 11-19
REN L L, LI X L, LIU L Z. Community characteristics of soil ammonia oxidizing bacteria after different fertilizer applications[J]. Chinese Journal of Eco-Agriculture, 2019, 27(1): 11-19
* 辽宁省高等学校基本科研项目(LSNZD201705)和国家自然科学基金项目(31101504)资助
刘灵芝, 主要研究方向为土壤微生物。E-mail: liulingzhi2006@163.com
任灵玲, 主要研究方向为农业环境保护。E-mail: 1464697578@qq.com
2018-07-08
2018-09-30
Jul. 8, 2018;
Sep. 30, 2018
* This study was supported by the Basic Research Projects of Liaoning Higher Education Institutions (LSNZD201705) and the National Natural Science Foundation of China (31101504).

