秋葵连作土壤浸提液对番茄生长的障碍研究*
严逸男, 刘明月, 周相助, 林志强, 张卫清, 许 茹, 王树彬, 陈 露, 尚春雨, 林勇文, 侯毛毛, 林义章, 钟凤林**
秋葵连作土壤浸提液对番茄生长的障碍研究*
严逸男1, 刘明月1, 周相助1, 林志强2, 张卫清2, 许 茹1, 王树彬1, 陈 露1, 尚春雨1, 林勇文1, 侯毛毛1, 林义章1, 钟凤林1**
(1. 福建农林大学园艺学院 福州 350002; 2. 福建省种子管理总站 福州 350003)
单一耕作制度和作物品种, 使设施连作障碍日益加剧。番茄和秋葵都是重要的设施蔬菜类型, 但种植发现秋葵对番茄存在生长障碍, 研究秋葵对番茄的生长障碍发生的生理生态机制具有重要意义。本研究选取种植秋葵的1 a和10 a土壤浸提液(简称1 a浸提液和10 a浸提液), 以全素营养液为对照(简称CK), 探讨秋葵连作土壤浸提液对番茄萌发期种子和幼苗生长的影响。结果表明: 同一浓度土壤浸提液处理下, 10 a浸提液的番茄萌芽期种子表现出主根畸形, 侧根增多但细弱; 番茄幼苗分根增多, 根系活性低于1 a浸提液且都显著低于CK, 顶部嫩叶失绿异常, 活性氧代谢系统紊乱。同一年限不同秋葵土壤浸提液浓度处理下, 番茄萌发期种子随浸提液浓度的升高表现出主根畸形, 侧根增多且细弱, 番茄幼苗分根增多, 1 a和10 a浸提液的番茄根尖数、分根数分别最高达1 146、3 321和2 291、1 947, 显著高于对照(1 071、385); 秋葵土壤浸提液浓度高于250 mg·mL-1处理下番茄幼苗根系活性都显著低于CK, 顶部嫩叶失绿异常, 活性氧代谢系统紊乱。研究表明秋葵根系物及分泌物在土壤中残留, 对后茬番茄的生长造成不良影响, 这些物质随种植年限增加而富集, 从而对番茄产生更严重的毒害。
番茄; 秋葵; 土壤浸提液; 连作障碍; 轮作; 化感作用
设施栽培蔬菜品种局限强, 由于单一的耕作制度和作物品种, 及过分追求经济效益, 设施连作障碍日益加剧。植物根际生态环境恶化, 根系活力下降, 蔬菜生长发育不良; 土壤病虫基数增加, 危害加剧; 蔬菜产量和农产品品质大幅度下降[1]。近年来国内外许多学者通过利用不同植物间的正相互作用, 进行混作、间作、套作, 建立植物有益组合; 通过改进栽培耕作制度, 实施作物轮作, 科学作物布局, 保护生物多样性, 减少作物化感作用的负面影响[2]。植物化感作用是植物-土壤-微生物相互作用的结果, 包括了偏害作用、自毒作用、自促作用和互惠作用[3-8]。在农业生态系统中充分利用化感物质的正效应, 避免负效应, 对于建立可持续农业体系具有重要作用, 因而被认为是一项重要的农业生态技术[6]。
番茄()营养丰富, 是我国栽培面积最大的蔬菜之一[9], 是最重要的设施大棚蔬菜[10], 也是世界第二大蔬菜消费品[11]。作为设施种植最大的蔬菜种类, 其自身的根系分泌物及残茬会引起自毒作用, 连作障碍已成为我国蕃茄集约化生产的瓶颈[12-13]。秋葵()是人们喜食的蔬菜之一, 我国大陆从印度引进秋葵, 已经种植60多年[14]。秋葵用途颇为广泛, 嫩果、叶、花均可供食, 种子可榨油, 丰富的茎秆纤维也具有较高利用价值[15]。由于番茄存在连作障碍, 同时秋葵生产中忌连作[7], 且都属于经济效益较好的蔬菜, 农民希望通过两者的合理种植来减轻单一蔬菜的自毒障碍并得到好的经济效益。但种植发现, 秋葵与果菜类接茬, 秋葵与番茄间作或轮作会发生根结线虫, 导致番茄不同程度的生长以及结果的障碍[14-16], 因此深入研究秋葵对番茄生长障碍发生的生理生态机制具有重要意义。本试验以秋葵种植土壤为材料, 选取常规土壤为对照, 通过选取种植秋葵低年限(1 a)和高年限(10 a)的土壤进行水浸提, 用霍格兰全素营养液为对照培养液, 采用水培法研究其对番茄萌发期种子和幼苗的生长情况, 以探讨秋葵种植土壤浸提液对番茄萌发期种子根、茎生长以及幼苗地下部、地上部生长和生理生化指标及番茄生长的影响, 为明晰番茄与秋葵种植障碍产生的机理提供理论依据。
1 材料与方法
1.1 试验材料
供试土样分别为种植秋葵1 a、10 a(a表示年份)的土壤, 于2018年4月10日在每个地块采用5点法采集土表0~20 cm的土壤, 土样采自福建省漳州市龙海市东园镇东园(24°21′52.39″N, 117°52′12.04″E)。用水浸提法获得土壤浸提液[17]: 取自然风干土壤过1 mm孔径筛, 2018年4月15日按1∶2(/)的比例浸泡于烧杯中, 即加土200 g加蒸馏水400 mL, 充分振荡后静置2 d, 取上清液过滤, 得秋葵种植土壤500 mg·mL-1的溶液(浸提母液)。设置不同浓度浸提液用于番茄萌芽期种子和幼苗的培养。
供试品种为小番茄‘Micro Tom’。将番茄种子用纱布包裹在自来水中浸种6 h, 后放置在28 ℃恒温培养箱中培养2~3 d即可得到露白1~2 mm的番茄萌芽种子, 作为试验材料。
将相同处理的另一批露白种子进行沙培育苗, 待长至3叶一心时取苗, 正常全素营养液水培定植于40 cm×60 cm×20 cm箱中, 营养液配方采用霍格兰番茄专用配方[18], 待苗长至7叶一心时作为试验材料。
1.2 试验设计
将上述的萌芽种子于2018年4月21日开始用10 mL1a和10 a秋葵种植土壤浸提液(简称1 a浸提液和10 a浸提液), 分别设置1 000 mg·mL-1、2 000 mg·mL-1和3 000 mg·mL-1浸提液浓度处理(简称S1-S6, 1 a各浓度处理分别为S1、S2、S3, 10 a各浓度处理分别为S4、S5、S6), 并以全素营养液作为CK对照(T1), 每个处理各30粒种子, 培养5 d, 对处理5 d的种子进行拍照, 之后将各处理种子的全部根系用组培刀切下进行透明处理。
于2018年4月22日将正常培养的7叶1心苗移至6 L1 a浸提液和10 a浸提液, 分别设置125 mg·mL-1、250 mg·mL-1和500 mg·mL-1浸提液浓度处理(简称T2-T7), 并以全素营养液作为CK对照, 培养9 d, 每个处理各40株苗, 每3 d取样一次, 共4次, 随机选取3株番茄苗进行拍照及根系与叶片扫描, 后另选取3株叶片及根系分别取样0.3 g和0.2 g, 液氮冻样后-40 ℃保存,进行各指标的测定。
1.3 指标测定方法
根系透明处理采用植物透明标本制作的NaOH透明方法[19]并稍加改动: 1)乙醇∶冰醋酸=3∶1, 15~20 min; 2)Basic solution(7%NaOH+60%乙醇)过夜; 3)40%、20%、10%乙醇各处理15 min; 4)蒸馏水, 后显微镜观察。番茄根系长、根系体积、根尖数、分根数及地上部叶片面积等采用根系分析扫描仪进行扫描检测; 叶绿素含量测定采用酒精研磨法[20]; 根系活力测定采用TTC法[20]; 超氧化物歧化酶(SOD)活性测定采用NBT光化学还原法[20]; 过氧化物酶(POD)活性测定采用愈创木酚法[20]; 过氧化氢酶(CAT)活性测定采用过氧化氢法[20]; 脯氨酸含量测定采用茚三酮显色法[20]; 丙二醛(MDA)含量测定采用硫代巴比妥酸比色法[20]。
1.4 数据处理
用DPS(7.05)软件对试验数据进行方差分析, 用最小显著差数法(LSD)进行差异显著性分析, 显著性水平为0.05。
2 结果与分析
2.1 秋葵连作土壤浸提液对番茄生长的影响
2.1.1 秋葵连作土壤浸提液对番茄萌芽期种子生长的影响
当植物在逆境下, 最先感受胁迫的器官是根[21-23]。观察处理5 d时种子, 与CK比较, 同一浓度下10 a浸提液处理比1 a浸提液处理所受影响严重。10 a浸提液处理造成番茄主根畸形, 侧根增多但细弱, 茎徒长, 且随浓度增加胁迫愈加明显(图1A)。10 a浸提液对番茄露白后的种子有明显影响, 主要表现为主根短缩且褐化变黄, 根尖细胞小且排列致密(图1B-S6), 呈现黄褐色。根与茎的交界处有类似腐烂的变褐, 侧根细弱(图1C的S6)。表明秋葵种植土壤浸提液对番茄种子萌发的根系造成伤害。
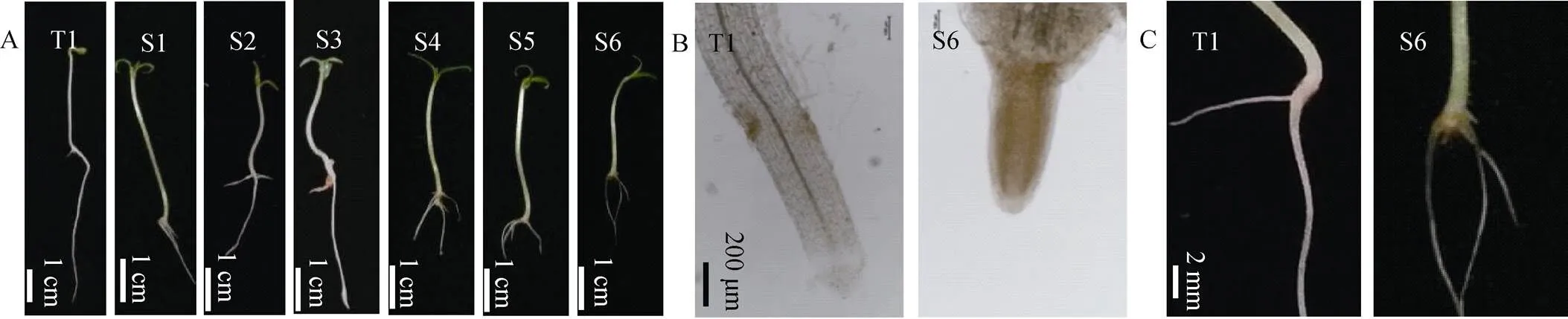
图1 秋葵种植不同年限的土壤浸提液处理第5 d番茄种子生长情况[A: 各处理番茄种子生长情况; B: T1、S6处理番茄种子根部生长情况(2×); C: T1、S6处理番茄种子根系透明情况(27×)]
T1: CK(全素营养液); S1: 1 000 mg·mL-1的种植秋葵1 a的土壤浸提液; S2: 2 000 mg·mL-1的种植秋葵1 a的土壤浸提液; S3: 3 000 mg·mL-1的种植秋葵1 a的土壤浸提液; S4: 1 000 mg·mL-1的种植秋葵10 a的土壤浸提液; S5: 2 000 mg·mL-1的种植秋葵10 a的土壤浸提液; S6: 3 000 mg·mL-1的种植秋葵10 a的土壤浸提液。T1: nutrient solution; S1: 1 000 mg·mL-1soil extract planting okra for 1 year; S2: 2 000 mg·mL-1soil extract planting okra for 1 year; S3: 3 000 mg·mL-1soil extract planting okra for 1 year; S4: 1 000 mg·mL-1soil extract planting okra for 10 years; S5: 2 000 mg·mL-1soil extract planting okra for 10 years; S6: 3 000 mg·mL-1soil extract planting okra for 10 years.
2.1.2 秋葵连作土壤浸提液对番茄幼苗生长的影响
观察处理0~9 d的番茄幼苗, 随着处理时间增加番茄受浸提液处理影响比CK严重, 10 a浸提液处理比1 a浸提液严重。10 a浸提液处理造成番茄分根数增多, 根尖分叉也增多, 根系生长明显异常, 茎徒长, 且随浓度增加胁迫愈加明显(图2, 图3)。第6 d起, 在T6和T7处理下番茄叶片表现为新叶失绿(图4)。表明秋葵土壤浸提液对番茄幼苗的地下部和地上部皆有伤害。

图2 秋葵种植不同年限的土壤浸提液对番茄幼苗生长的影响(0~9 d)
T1: CK(全素营养液); T2: 125 mg·mL-1的种植秋葵1 a的土壤浸提液; T3: 250 mg·mL-1的种植秋葵1 a的土壤浸提液; T4: 500 mg·mL-1的种植秋葵1 a的土壤浸提液; T5: 125 mg·mL-1的种植秋葵10 a的土壤浸提液; T6: 250 mg·mL-1的种植秋葵10 a的土壤浸提液; T7: 500 mg·mL-1的种植秋葵10 a的土壤浸提液。T1: nutrient solution; T2: 125 mg·mL-1soil extract planting okra for 1 year; T3: 250 mg·mL-1soil extract planting okra for 1 year; T4: 500 mg·mL-1soil extract planting okra for 1 year; T5: 125 mg·mL-1soil extract planting okra for 10 years; T6: 250 mg·mL-1soil extract planting okra for 10 years; T7: 500 mg·mL-1soil extract planting okra for 10 years.
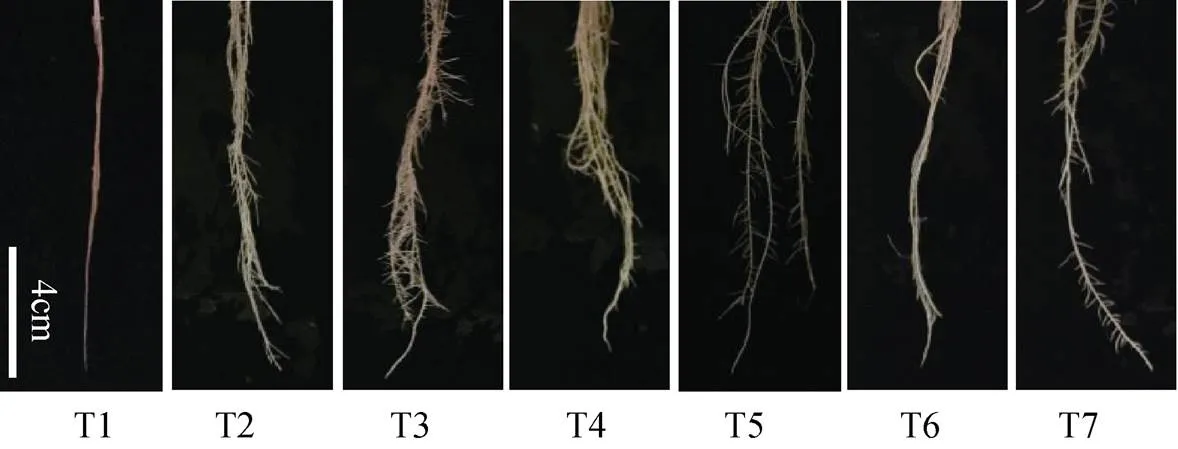
图3 秋葵种植不同年限的土壤浸提液处理6 d番茄幼苗根系尖端部分生长情况
T1: CK(全素营养液); T2: 125 mg·mL-1的种植秋葵1 a的土壤浸提液; T3: 250 mg·mL-1的种植秋葵1 a的土壤浸提液; T4: 500 mg·mL-1的种植秋葵1 a的土壤浸提液; T5: 125 mg·mL-1的种植秋葵10 a的土壤浸提液; T6: 250 mg·mL-1的种植秋葵10 a的土壤浸提液; T7: 500 mg·mL-1的种植秋葵10 a的土壤浸提液。T1: nutrient solution; T2: 125 mg·mL-1soil extract planting okra for 1 year; T3: 250 mg·mL-1soil extract planting okra for 1 year; T4: 500 mg·mL-1soil extract planting okra for 1 year; T5: 125 mg·mL-1soil extract planting okra for 10 years; T6: 250 mg·mL-1soil extract planting okra for 10 years; T7: 500 mg·mL-1soil extract planting okra for 10 years.

图4 秋葵种植不同年限的土壤浸提液对番茄幼苗茎叶生长的影响(0~9 d)
T1: CK(全素营养液); T2: 125 mg·mL-1的种植秋葵1 a的土壤浸提液; T3: 250 mg·mL-1的种植秋葵1 a的土壤浸提液; T4: 500 mg·mL-1的种植秋葵1 a的土壤浸提液; T5: 125 mg·mL-1的种植秋葵10 a的土壤浸提液; T6: 250 mg·mL-1的种植秋葵10 a的土壤浸提液; T7: 500 mg·mL-1的种植秋葵10 a的土壤浸提液。T1: nutrient solution; T2: 125 mg·mL-1soil extract planting okra for 1 year; T3: 250 mg·mL-1soil extract planting okra for 1 year; T4: 500 mg·mL-1soil extract planting okra for 1 year; T5: 125 mg·mL-1soil extract planting okra for 10 years; T6: 250 mg·mL-1soil extract planting okra for 10 years; T7: 500 mg·mL-1soil extract planting okra for 10 years.
2.2 秋葵连作土壤浸提液对番茄幼苗根系形态的影响
观察处理0~9 d番茄幼苗的根长、根系拓扑面积、根系表面积、根系体积、根尖数和分根数, 随处理时间增加, 各处理根系与T1(对照)的差异显著, 根系生长量明显高于T1; 随着处理时间的增长T2-T7处理的根系表现出分根数和根尖分叉异常增多, 且各处理之间的差距随之增大, 在9 d时分别达到T1的1.52~5.95倍和1.75~3.10倍(图5)。其中T3处理下番茄的根长、根表面积和分根数在所有处理中最大, T7处理下番茄的根系体积和根尖数则最大。表明秋葵土壤浸提液会使番茄根系分根数和根尖分叉异常增多。
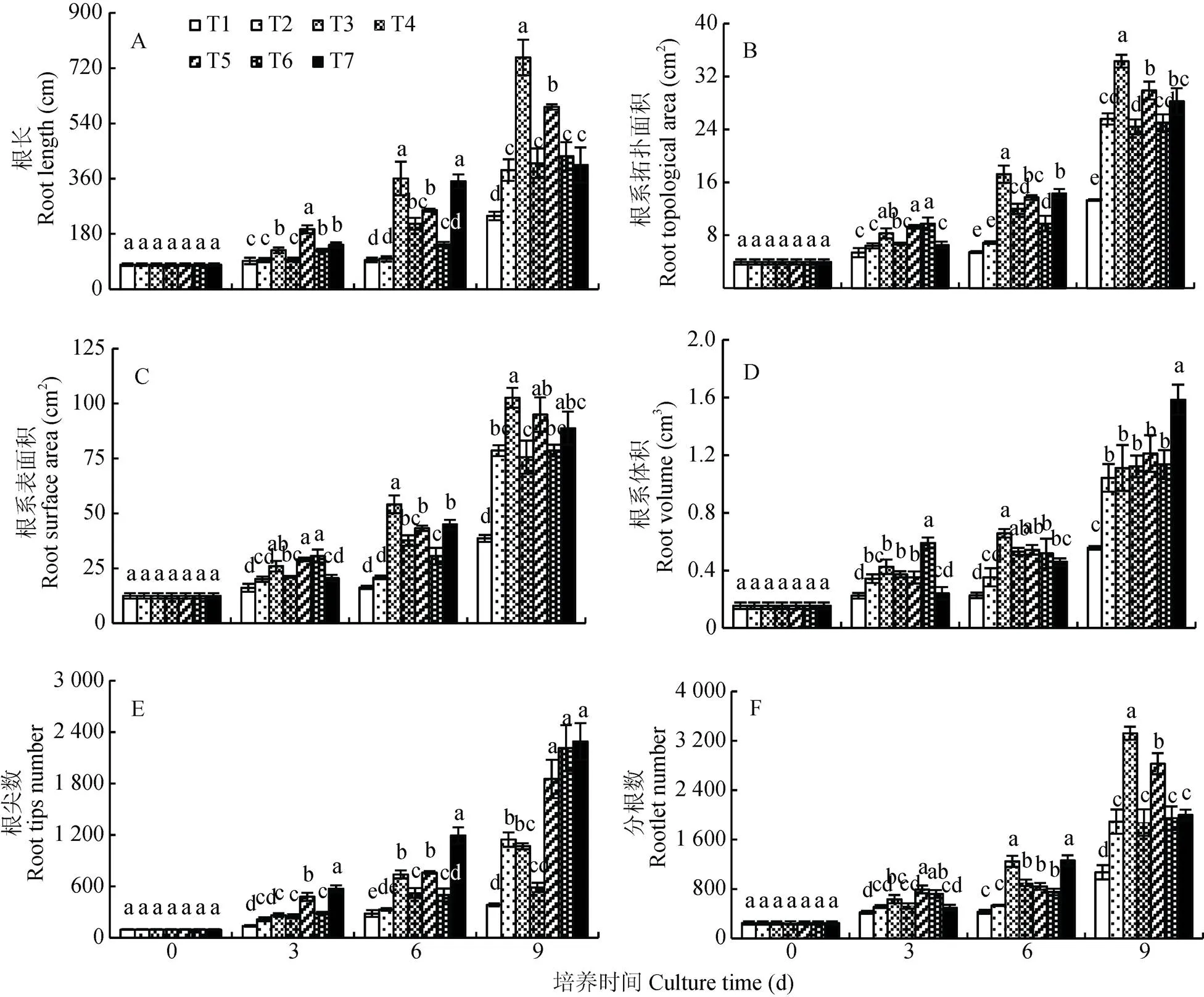
图5 秋葵种植不同年限的土壤浸提液对番茄幼苗根系形态的影响
同一培养时间不同小写字母表示处理间差异显著(<0.05)。T1: CK(全素营养液); T2: 125 mg·mL-1的种植秋葵1 a的土壤浸提液; T3: 250 mg·mL-1的种植秋葵1 a的土壤浸提液; T4: 500 mg·mL-1的种植秋葵1 a的土壤浸提液; T5: 125 mg·mL-1的种植秋葵10 a的土壤浸提液; T6: 250 mg·mL-1的种植秋葵10 a的土壤浸提液; T7: 500 mg·mL-1的种植秋葵10 a的土壤浸提液。Different lowercase letters in bars for the same culture time indicate significant differences at 0.05 level among treatments. T1: nutrient solution; T2: 125 mg·mL-1soil extract planting okra for 1 year; T3: 250 mg·mL-1soil extract planting okra for 1 year; T4: 500 mg·mL-1soil extract planting okra for 1 year; T5: 125 mg·mL-1soil extract planting okra for 10 years; T6: 250 mg·mL-1soil extract planting okra for 10 years; T7: 500 mg·mL-1soil extract planting okra for 10 years.
2.3 秋葵连作土壤浸提液对番茄幼苗根系活力的影响
测定处理0~9 d番茄幼苗的根系活力, T2-T7处理下的番茄幼苗根系活力与对照T1处理存在显著差异; 随着处理时间增加根系活力变化明显, 10 a浸提液处理根系活力总体低于1 a浸提液处理, 且显著低于T1。在处理初期随着处理浓度的增加, 番茄幼苗根系活力也随之增加, 其中3 d时1 a浸提液处理(T2-T4)和T7的根系活力显著高于T1, 在6~9 d时10 a浸提液处理(T5-T7)的番茄根系随浸提液浓度的增加呈先升后降的趋势, 而在6~9 d时T2-T7根系活力都低于T1处理(图6), 这可能是因为在处理中后期植株根系中毒(图2, 图3),说明秋葵种植土壤浸提液对番茄根系活力有毒害作用。
2.4 秋葵连作土壤浸提液对番茄幼苗叶绿素的影响
测定处理0~9 d番茄幼苗的叶绿素a、叶绿素b和总叶绿素。T2-T7处理番茄幼苗叶绿素与T1存在差异, 随着处理时间增加叶绿素变化明显, 浸提液处理叶绿素变化幅度大于T1, 随处理时间延长对番茄叶绿素含量的破坏加重。各处理的叶绿素a含量差异不明显, 叶绿素b和总叶绿素含量初期T2-T7处理高于T1且差异显著; 在3~6 d时1 a浸提液处理(T2-T4)番茄叶绿素b含量均比10 a浸提液处理下(T5-T7)高, 而在处理中后期浸提液处理的番茄叶绿素b含量有一定量的降低, 9 d时番茄总叶绿素含量较3~6 d时有一定量的下降(图7)。表明秋葵种植土壤浸提液破坏番茄叶绿素形成。
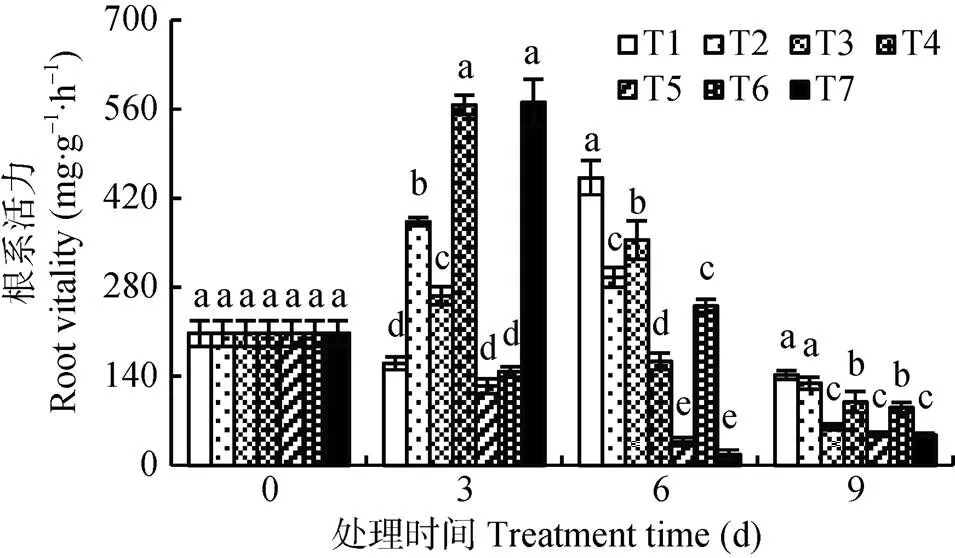
图6 秋葵种植不同年限的土壤浸提液对番茄幼苗根系活力的影响
同一培养时间不同小写字母表示处理间差异显著(<0.05)。T1: CK(全素营养液); T2: 125 mg·mL-1的种植秋葵1 a的土壤浸提液; T3: 250 mg·mL-1的种植秋葵1 a的土壤浸提液; T4: 500 mg·mL-1的种植秋葵1 a的土壤浸提液; T5: 125 mg·mL-1的种植秋葵10 a的土壤浸提液; T6: 250 mg·mL-1的种植秋葵10 a的土壤浸提液; T7: 500 mg·mL-1的种植秋葵10 a的土壤浸提液。Different lowercase letters in bars for the same culture time indicate significant differences at 0.05 level among treatments. T1: nutrient solution; T2: 125 mg·mL-1soil extract planting okra for 1 year; T3: 250 mg·mL-1soil extract planting okra for 1 year; T4: 500 mg·mL-1soil extract planting okra for 1 year; T5: 125 mg·mL-1soil extract planting okra for 10 years; T6: 250 mg·mL-1soil extract planting okra for 10 years; T7: 500 mg·mL-1soil extract planting okra for 10 years.
2.5 秋葵连作土壤浸提液对番茄幼苗抗氧化酶活性的影响
测定处理0~9 d的番茄幼苗叶片和根系SOD、POD和CAT活性。随处理时间增加, 各浸提液处理叶片和根系SOD、POD和CAT活性与T1差异显著。10 a(T5-T7)浸提液处理的叶片SOD活性在同一时期随浓度的升高由先降后升变为先升后将趋势。T5-T7的叶POD活性随浓度的升高由3 d的下降趋势变为9 d的上升的趋势, 且叶片POD活性在3~9 d时都高于对照T1, 在9 d时根系POD活性也高于T1。叶片CAT活性随处理时间及1 a和10 a浸提液浓度增加呈下降趋势(图8)。
番茄幼苗根系SOD活性同一浸提液浓度不同年限的增长呈先下降后上升的趋势, 在T4和T7高浓度活性在3 d时大幅下降。POD活性9 d时各浸提液处理都显著高于T1。6~9 d时根系CAT活性随处理时间及1 a(T2-T4)和10 a(T6-T7)浸提液浓度增加呈下降趋势(图8)。
2.6 秋葵连作土壤浸提液对番茄幼苗脯氨酸和丙二醛含量的影响
脯氨酸作为羟自由基清除剂, 对胁迫反应十分敏感, 其含量与环境胁迫的强度呈显著正相关[24]。测定处理0~9 d的番茄幼苗叶片和根系的脯氨酸含量(图9), 番茄幼苗叶片各浸提液处理下脯氨酸含量在6 d最低。T3和T6的番茄叶片脯氨酸含量在3 d时显著高于对照T1, 而9 d时T5的脯氨酸含量显著高于T1。番茄幼苗根系各浸提液处理下脯氨酸含量随处理时间延长变化明显, 培养6 d时T3-T7比3 d时明显增加, 其中10 a浸提液(T5-T7)下显著高于T1; 9 d时T5的脯氨酸含量仍显著高于其他处理。结果表明, 中高浓度秋葵连作土壤浸提液处理下番茄幼苗处于胁迫中, 且处理浓度越高, 胁迫强度越大, 植株应对胁迫也越灵敏。

图7 秋葵种植不同年限的土壤浸提液对番茄幼苗叶绿素含量的影响
同一培养时间不同小写字母表示处理间差异显著(<0.05)。T1: CK(全素营养液); T2: 125 mg·mL-1的种植秋葵1 a的土壤浸提液; T3: 250 mg·mL-1的种植秋葵1 a的土壤浸提液; T4: 500 mg·mL-1的种植秋葵1 a的土壤浸提液; T5: 125 mg·mL-1的种植秋葵10 a的土壤浸提液; T6: 250 mg·mL-1的种植秋葵10 a的土壤浸提液; T7: 500 mg·mL-1的种植秋葵10 a的土壤浸提液。Different lowercase letters in bars for the same culture time indicate significant differences at 0.05 level among treatments. T1: nutrient solution; T2: 125 mg·mL-1soil extract planting okra for 1 year; T3: 250 mg·mL-1soil extract planting okra for 1 year; T4: 500 mg·mL-1soil extract planting okra for 1 year; T5: 125 mg·mL-1soil extract planting okra for 10 years; T6: 250 mg·mL-1soil extract planting okra for 10 years; T7: 500 mg·mL-1soil extract planting okra for 10 years.
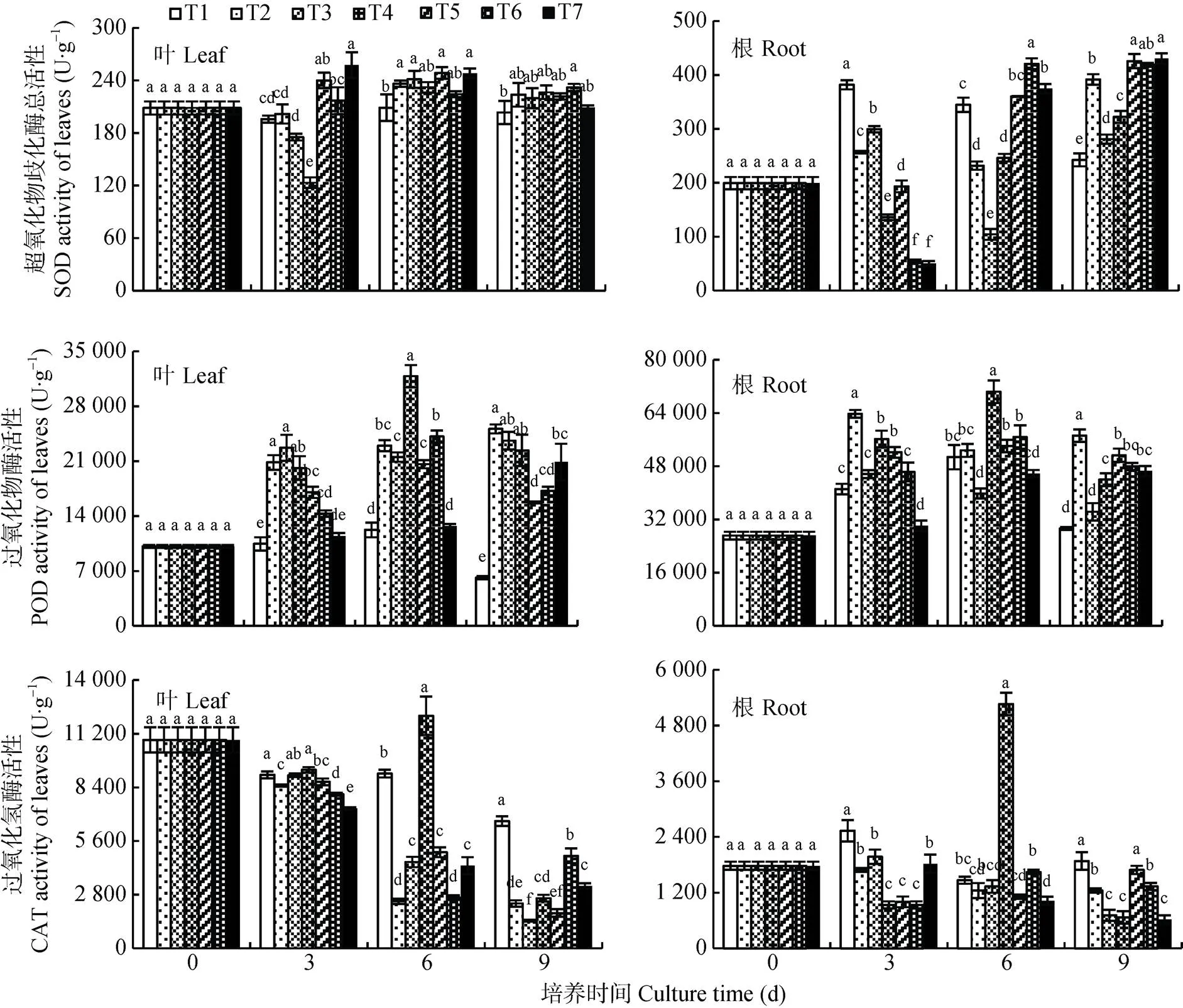
图8 秋葵种植不同年限的土壤浸提液对番茄叶和根SOD、POD和CAT活性的影响
同一培养时间不同小写字母表示处理间差异显著(<0.05)。T1: CK(全素营养液); T2: 125 mg·mL-1的种植秋葵1 a的土壤浸提液; T3: 250 mg·mL-1的种植秋葵1 a的土壤浸提液; T4: 500 mg·mL-1的种植秋葵1 a的土壤浸提液; T5: 125 mg·mL-1的种植秋葵10 a的土壤浸提液; T6: 250 mg·mL-1的种植秋葵10 a的土壤浸提液; T7: 500 mg·mL-1的种植秋葵10 a的土壤浸提液。Different lowercase letters in bars for the same culture time indicate significant differences at 0.05 level among treatments. T1: nutrient solution; T2: 125 mg·mL-1soil extract planting okra for 1 year; T3: 250 mg·mL-1soil extract planting okra for 1 year; T4: 500 mg·mL-1soil extract planting okra for 1 year; T5: 125 mg·mL-1soil extract planting okra for 10 years; T6: 250 mg·mL-1soil extract planting okra for 10 years; T7: 500 mg·mL-1soil extract planting okra for 10 years.
MDA是细胞膜脂过氧化反应的重要产物, 通常以MDA含量作为膜脂过氧化反应的主要指标, MDA含量的多少体现了细胞膜被破坏的程度[25]。测定处理3 d和9 d的番茄幼苗叶片MDA含量在10 a浸提液处理下随浓度增加呈递增趋势(图9)。番茄幼苗叶片浸提液处理3 d时MDA含量显著高于对照T1, 其中T7处理MDA含量达202 μmol·g-1。番茄幼苗根系MDA含量呈先上升后下降的趋势。T3-T4和T6-T7 MDA含量整体呈先上升后下降的趋势, 说明秋葵连作土壤浸提液浓度250 mg·mL-1以上番茄幼苗的根与叶的细胞膜都受到了不同程度的破坏。
3 讨论
种植秋葵土壤的浸提液对番茄种子萌发试验结果表明, 秋葵土壤浸提液导致番茄种子萌发时主根短缩、细胞排列致密、侧根增多且细弱等, 这些影响不仅随秋葵土壤浸提液浓度的递增而加重, 也随秋葵种植年限的增长而增加。这可能是由于秋葵土壤浸提液中存在一些不利于番茄种子萌发和生长的化感物质。许多化感物质能显著抑制植物种子萌发, 并影响种子萌发后幼苗的生长发育[26]。生姜(Roscoe)茎和叶的水提液能抑制大豆[(Linn.) Merr.]和北葱(L.)胚根以及下胚轴的生长, 且这种抑制效果随着提取液浓度升高而增强[27]。与此类似, 黑芥(L.)的根、茎、叶以及花的水提取液亦能抑制野燕麦(L.)胚根和下胚轴的伸长, 其中胚根对化感物质最为敏感[28]。
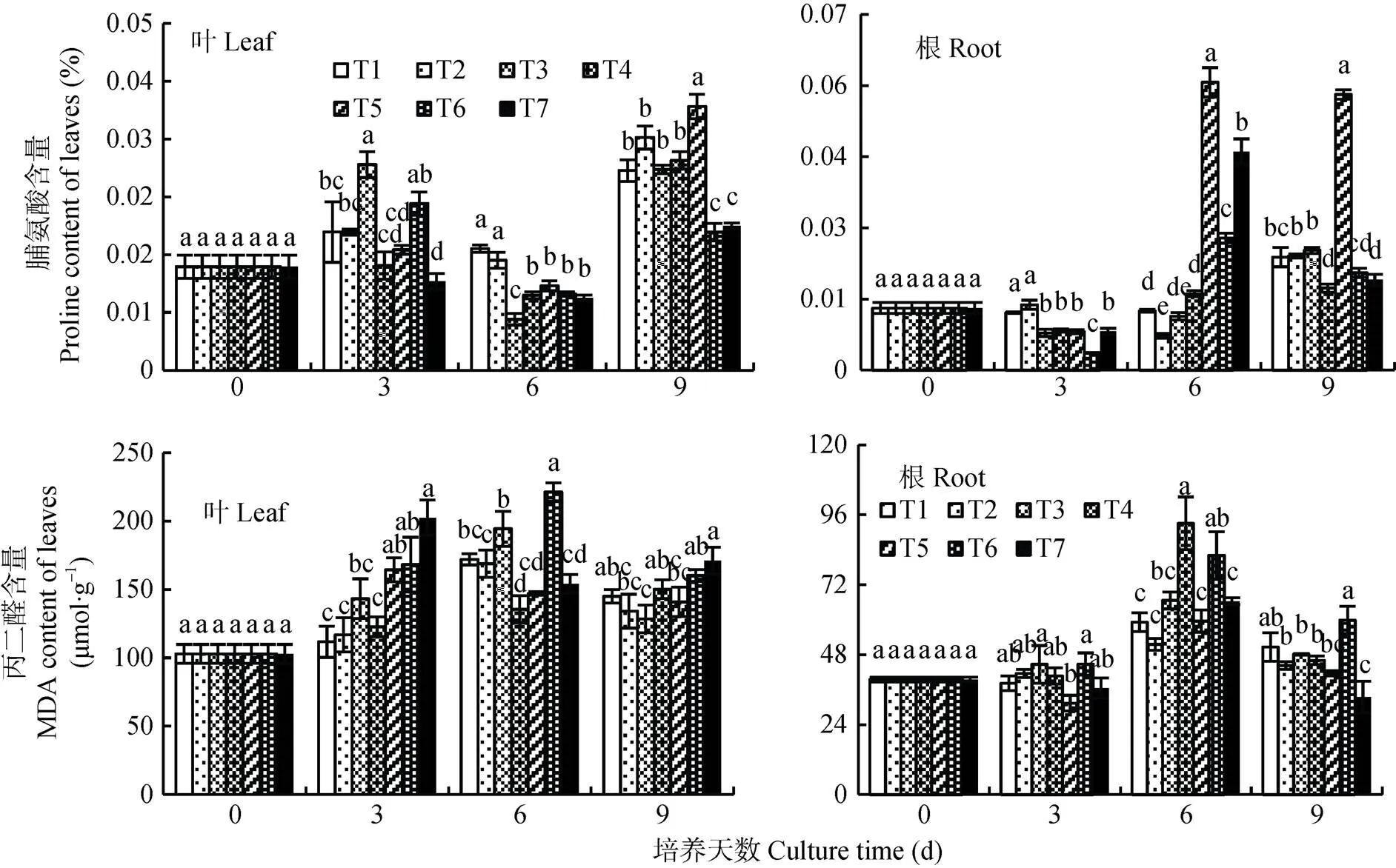
图9 秋葵种植不同年限的土壤浸提液对番茄幼苗叶和根脯氨酸和丙二醛含量的影响
同一培养时间不同小写字母表示处理间差异显著(<0.05)。T1: CK(全素营养液); T2: 125 mg·mL-1的种植秋葵1 a的土壤浸提液; T3: 250 mg·mL-1的种植秋葵1 a的土壤浸提液; T4: 500 mg·mL-1的种植秋葵1 a的土壤浸提液; T5: 125 mg·mL-1的种植秋葵10 a的土壤浸提液; T6: 250 mg·mL-1的种植秋葵10 a的土壤浸提液; T7: 500 mg·mL-1的种植秋葵10 a的土壤浸提液。Different lowercase letters in bars for the same culture time indicate significant differences at 0.05 level among treatments. T1: nutrient solution; T2: 125 mg·mL-1soil extract planting okra for 1 year; T3: 250 mg·mL-1soil extract planting okra for 1 year; T4: 500 mg·mL-1soil extract planting okra for 1 year; T5: 125 mg·mL-1soil extract planting okra for 10 years; T6: 250 mg·mL-1soil extract planting okra for 10 years; T7: 500 mg·mL-1soil extract planting okra for 10 years.
种植秋葵的土壤中存在不利与番茄苗生长的化感物质, 对番茄幼苗的地下部和地上部都有不同程度的伤害, 尤其根系, 出现根尖数和分根数的增多异常, 根系活力异常低; 但短时间处理对叶绿素b含量有一定的促进作用, 而对叶绿素a一直存在抑制作用; 对番茄叶和根抗氧化酶活性也有显著影响, 叶和根的抗氧化酶活性、脯氨酸和丙二醛含量随秋葵土壤浸提液处理时间呈先上升后下降趋势, 且秋葵连作时间延长会加重对番茄的毒害。董小艳等[29]研究表明粮食作物、果树、蔬菜、瓜果、花卉等经济作物的连作年限越长其连作障碍就越严重; 王海燕等[30]认为自毒作用是化感作用的组成部分, 是导致连作障碍的主要原因之一。化感物质存在于植物的各部分组织中, 其中包括通过植物根系分泌到土壤中。有研究表明[31-33]化感物质首先是对膜的伤害, 引起植物细胞分裂、光合作用等的变化, 从而影响植物生理生化特性(POD、SOD、CAT以及激素等), 最终对植物根、茎细胞的生长发育产生抑制作用; 化感物质能影响细胞膜透性, 使细胞生理活动和物质运输发生紊乱, 进而影响原生质体、细胞膜和叶绿体膜的完整性和渗透性, 使叶片中叶绿素含量降低, 并最终造成植物的光合作用速率下降[34]。
研究表明, 秋葵根系分泌物残留在土壤对番茄生长形成毒害, 导致番茄根系活力急剧下降并破坏细胞膜透性, 根系生长不良, 光合色素含量降低, 番茄光能利用率下降, 影响光合功能及碳同化效率, 造成植株生长障碍, 且随着种植年限的增加导致残留分泌物不断积累, 从而进一步加大对番茄的毒害。这与高玲等[14-16]秋葵不能与番茄连作的结论相同, 所以秋葵不能作为番茄的前茬。同时对研究具体是秋葵根系分泌的哪些化感物质导致番茄存在生长障碍存在重要意义。
4 结论
秋葵连作土壤浸提液中存在对番茄生长不利的化感物质, 导致番茄根系活力骤降并破坏细胞膜透性, 影响地下部生长和地上部的光合作用及碳同化效率, 造成番茄生长障碍, 并随种植年限增加化感物质不断积累, 从而进一步加大对番茄的毒害。
[1] 吴彤东. 设施番茄连作障碍的生态控制关键技术研究[D]. 苏州: 苏州大学, 2009 WU T D. Research on key technology of ecological controlling the harm of continuous cropping obstacle in protected tomato[D]. Suzhou: Soochow University, 2009
[2] 王建花, 陈婷, 林文雄. 植物化感作用类型及其在农业中的应用[J]. 中国生态农业学报, 2013, 21(10): 1173–1183 WANG J H, CHEN T, LIN W X. Plant allelopathy types and their application in agriculture[J]. Chinese Journal of Eco-Agriculture, 2013, 21(10): 1173–1183
[3] CHOU C H. The role of allelopathy in biochemical ecology: Experience from Taiwan[J]. Biologia Plantarum, 1989, 31(6): 458–470
[4] Einhellig F A. Mechanism of action of allelochemicals in allelopathy[J]. ACS Symp Ser, 1995, 582: 96-116
[5] EINHELLIG F A. Interactions involving allelopathy in cropping systems[J]. Agronomy Journal, 1996, 88(6): 886–893
[6] 林文雄, 熊君, 周军建, 等. 化感植物根际生物学特性研究现状与展望[J]. 中国生态农业学报, 2007, 15(4): 1–8 LIN W X, XIONG J, ZHOU J J, et al. Research status and its perspective on the properties of rhizosphere biology mediated by allelopathic plants[J]. Chinese Journal of Eco-Agriculture, 2007, 15(4): 1–8
[7] 林文雄, 陈婷, 周明明. 农业生态学的新视野[J]. 中国生态农业学报, 2012, 20(3): 253–264 LIN W X, CHEN T, ZHOU M M. New dimensions in agroecology[J]. Chinese Journal of Eco-Agriculture, 2012, 20(3): 253–264
[8] DUKE S O. Allelopathy: Current status of research and future of the discipline: A commentary[J]. Allelopathy Journal, 2010, 25(1): 17–30
[9] 丁永川. 设施番茄连作障碍及防控农艺技术研究[D]. 泰安: 山东农业大学, 2012 DING Y C. Study of succession cropping obstacle and protection agronomic technology in protected tomato[D]. Tai’an: Shandong Agricultural University, 2012
[10] 葛晓颖, 孙志刚, 李涛, 等. 设施番茄连作障碍与土壤芽孢杆菌和假单胞菌及微生物群落的关系分析[J]. 农业环境科学学报, 2016, 35(3): 514–523 GE X Y, SUN Z G, LI T, et al. Soilspp.,spp., and microbial communities under tomato continuous cropping in greenhouse production[J]. Journal of Agro-Environment Science, 2016, 35(3): 514–523
[11] 张若宇. 番茄可溶性固形物和硬度的高光谱成像检测[D]. 杭州: 浙江大学, 2014 ZHANG R Y. Detection of soluble solids content and firmness of tomato using hyperspectral imaging[D]. Hangzhou: Zhejiang University, 2014
[12] 喻景权, 杜尧舜. 蔬菜设施栽培可持续发展中的连作障碍问题[J]. 沈阳农业大学学报, 2000, 31(1): 124–126 YU J Q, DU Y S. Soil-sickness problem in the sustainable development for the protected production of vegetables[J]. Journal of Shenyang Agricultural University, 2000, 31(1): 124–126
[13] 王芳. 茄子连作障碍机理研究[D]. 北京: 中国农业大学, 2003 WANG F. The mechanism of eggplant (L.) replanting problem[D]. Beijing: China Agricultural University, 2003
[14] 高玲, 刘迪发, 徐丽. 黄秋葵研究进展与前景[J]. 热带农业科学, 2014, 34(11): 22–29 GAO L, LIU D F, XU L. Research progress and prospects of okra[J]. Chinese Journal of Tropical Agriculture, 2014, 34(11): 22–29
[15] 陈仁柳. 福建省黄秋葵高效生产技术研究及推广[D]. 福州: 福建农林大学, 2014 CHEN R L. Study on the efficiency cultivation techniques and generalization of Okra in Fujian Province[D]. Fuzhou: Fujian Agriculture and Forestry University, 2014
[16] 刘东祥, 叶花兰, 刘国道. 黄秋葵的应用价值及栽培技术研究进展[J]. 安徽农业科学, 2006, 34(15): 3718–3720 LIU D X, YE H L, LIU G D. Review of the application value and cultivation technique of okra[J]. Journal of Anhui Agricultural Sciences, 2006, 34(15): 3718–3720
[17] 张金燕, 孙雪婷, 陈军文, 等. 连作三七根际土壤化感物质检测及其提取液对三种作物种子萌发的影响[J]. 南方农业学报, 2017, 48(7): 1178–1184 ZHANG J Y, SUN X T, CHEN J W, et al. Allelochemical detection from rhizosphere soil of continuous-croppingand effects of the extracts on seed germination of three crops[J]. Journal of Southern Agriculture, 2017, 48(7): 1178–1184
[18] 周亮, 李朝晖, 魏宝阳, 等. 景天三七水培营养液配方研究[J]. 湖南农业科学, 2017, (5): 25–27 ZHOU L, LI Z H, WEI B Y, et al. Study on hydropinic nurtient solution formula of[J]. Hunan Agricultural Sciences, 2017, (5): 25–27
[19] 石婷婷, 翟奥博, 赵文, 等. 达氏鳇大型鱼体剥制标本的制作研究[J]. 大连海洋大学学报, 2017, 32(2): 205-210 SHI T T, ZHAI A B, ZHAO W, et al. Stripped specimen preparation of large Kaluga[J]. Journal of Dalian Ocean University, 2017, 32(2): 205-210
[20] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000 LI H S. Principles and Techniques of Plant Physiological Biochemical[M]. Beijing: Higher Education Press, 2000
[21] 李锋, 李木英, 潘晓华, 等. 不同水稻品种幼苗适应低磷胁迫的根系生理生化特性[J]. 中国水稻科学, 2004, 18(1): 48–52 LI F, LI M Y, PAN X H, et al. Biochemical and physiological characteristics in seedlings roots of different rice cultivars under low-phosphorus stress[J]. Chinese Journal of Rice Science, 2004, 18(1): 48–52
[22] 张恩和, 张新慧, 王惠珍. 不同基因型春蚕豆对磷胁迫的适应性反应[J]. 生态学报, 2004, 24(8): 1589–1593 ZHANG E H, ZHANG X H, WANG H Z. Adaptable effects of phosphorus stress on different genotypes of faba-bean[J]. Acta Ecologica Sinica, 2004, 24(8): 1589–1593
[23] 周晓星. 柳属植物对重金属镉胁迫的生长与生理响应[D]. 北京: 中国林业科学研究院, 2012 ZHOU X X. Growth and physiological responses ofto cadmium stress[D]. Beijing: Chinese Academy of Forestry, 2012
[24] CLAUSSEN W. Growth, water use efficiency, and proline content of hydroponically grown tomato plants as affected by nitrogen source and nutrient concentration[J]. Plant and Soil, 2002, 247(2): 199–209
[25] 刘艳阳, 李俊周, 陈磊, 等. 低温胁迫对小麦叶片细胞膜脂质过氧化产物及相关酶活性的影响[J]. 麦类作物学报, 2006, 26(4): 70–73 LIU Y Y, LI J Z, CHEN L, et al. Effect of low temperature stress on peroxidation product of membrane lipids and activity of related enzymes in wheat seedling leaves[J]. Journal of Triticeae Crops, 2006, 26(4): 70–73
[26] 陈锋, 孟永杰, 帅海威, 等. 植物化感物质对种子萌发的影响及其生态学意义[J]. 中国生态农业学报, 2017, 25(1): 36–46 CHEN F, MENG Y J, SHUAI H W, et al. Effect of plant allelochemicals on seed germination and its ecological significance[J]. Chinese Journal of Eco-Agriculture, 2017, 25(1): 36–46
[27] HAN C M, PAN K W, WU N, et al. Allelopathic effect of ginger on seed germination and seedling growth of soybean and chive[J]. Scientia Horticulturae, 2008, 116(3): 330–336
[28] TURK M A, TAWAHA A M. Allelopathic effect of black mustard (L.) on germination and growth of wild oat (L.)[J]. Crop Protection, 2003, 22(4): 673–677
[29] 董小艳, 程智慧, 张亮. 百合根系分泌物对4种观赏植物的化感作用[J]. 西北农林科技大学学报: 自然科学版, 2008, 36(9): 113–117 DONG X Y, CHENG Z H, ZHANG L. Allelopathy of lily root exudates on some receiver ornamental plants[J]. Journal of Northwest A&F University: Natural Science Edition, 2008, 36(9): 113–117
[30] 王海燕, 蒋展鹏. 化感作用及其在环境保护中的应用[J]. 环境污染治理技术与设备, 2002, 3(6): 86–89 WANG H Y, JIANG Z P. Allelopathy and its use in environmental protection[J]. Techniques and Equipment for Environmental Pollution Control, 2002, 3(6): 86–89
[31] 童朝阳, 韩丽梅, 邹永久. 大豆专用肥对轮作、连作大豆叶片超微结构的影响[J]. 大豆科学, 1998, 17(4): 358–362 TONG Z Y, HAN L M, ZOU Y J. Effect of soybean specificy complex fertilizer of ultrastructre of chloroplast under different cropping systems[J]. Soybean Science, 1998, 17(4): 358–362
[32] HALLAK A M G, DAVIDE L C, SOUZ I F. Effects of sorghum (L.) root exudates on the cell cycle of the bean plant (L.) root[J]. Genetics and Molecular Biology, 1999, 22(1): 95–99
[33] 闵红. 大棚蔬菜连作障碍机理研究[D]. 杨凌: 西北农林科技大学, 2010 MIN H. The study of mechanization of continuous cropping in greenhouse[D]. Yangling: Northwest A&F University, 2010
[34] BAZIRAMAKENGA R, LEROUX G D, SIMARD R R. Effects of benzoic and cinnamic acids on membrane permeability of soybean roots[J]. Journal of Chemical Ecology, 1995, 21(9): 1271–1285
Tomato growth as affected by soil extract of continuously cropped okra*
YAN Yinan1, LIU Mingyue1, ZHOU Xiangzhu1, LIN Zhiqiang2, ZHANG Weiqing2, XU Ru1, WANG Shubin1, CHEN Lu1, SHANG Chunyu1, LIN Yongwen1, HOU Maomao1, LIN Yizhang1, ZHONG Fenglin1**
(1. College of Horticulture, Fujian Agricultural and Forestry University, Fuzhou 350002, China; 2. Fujian Seed Management Station, Fuzhou 350003, China)
Single tillage system, single variety and excessive pursuit for economic efficiency have exacerbated the barriers of continuous cropping of greenhouse tomato (). Although its root secretions can cause autotoxicity,okra () is a new vegetable with great economic prospect in China. Rotation is an effective way to avoid continuous cropping obstacles, however, in practice, rotation of tomato and okra inhibited growth and impeded fruiting of tomato. To clear the hypotrophy between tomato and okra, soils of okra continuously cropped for 1 year and 10 years were used to conduct an experiment with tomato seeds and seedlings. Water extracts of two soils were diluted into 1 000 mg·mL–1, 2 000 mg·mL–1and 3 000 mg·mL–1to treat tomato seeds, and into 125 mg·mL–1, 250 mg·mL–1and 500 mg·mL–1to cultivate tomato seedlings. Physiological and biochemical analysis and seed root and stem morphology observation of tomato were conducted to investigate the influence on the below-ground and above-ground growth of tomato to determine the effects of okra soil extracts on tomato seed germination and seedling growth. The results showed that under the same concentration of soil extract, with continuous cropping years increase, the main root of tomato deformed with more but thin lateral root. Tomato seedling also showed increased root forks and root activity significantly lowered and with abnormal and green-lost top leaves compared to the control (total nutrient solution, CK) treatment. The activity of antioxidant enzyme, and MDA and proline contents were also significantly different from CK. Under different concentrations of soil abstracts for the same continuous cropping year, main root deformity appeared gradually in germinated tomato seeds as the concentration of soil extract increased. Also lateral roots increased and most relatively thin, tomato seedling rootlets increased and root tip number and rootlets were respectively 1 146 and 3 321 for the 1-year and 2 291 and 1 947 for the 10-year continuous cropping, all significantly higher than those under the control (1 071 and 385, respectively). Root activity of tomato seedlings firstly rose and then fell. At 3 days of cultivation, root activity of tomato seedlings under soil abstracts with over 250 mg·mL-1concentration of 1 year and 10 years continuous cropping were lower than that of CK. Antioxidant enzyme activity, MDA and proline contents were also significantly different from CK. Above all, some allelechemicals were secreted by okra roots, including the substances vestigital in the soil, which had negative effects on subsequent tomatoes. The substances were enriched with increasing years of continuous cropping, which caused more damage to succeeding tomato crops.
Tomato; Okra; Soil extract; Continuous cropping obstacle; Rotation; Allelopathy
, E-mail: zhong591@fafu.edu.cn
May 23, 2018;
Sep. 28, 2018
S63
A
2096-6237(2019)01-0081-11
10.13930/j.cnki.cjea.180495
严逸男, 刘明月, 周相助, 林志强, 张卫清, 许茹, 王树彬, 陈露, 尚春雨, 林勇文, 侯毛毛, 林义章, 钟凤林. 秋葵连作土壤浸提液对番茄生长的障碍研究[J]. 中国生态农业学报(中英文), 2019, 27(1): 81-91
YAN Y N, LIU M Y, ZHOU X Z, LIN Z Q, ZHANG W Q, XU R, WANG S B, CHEN L, SHANG C Y, LIN Y W, HOU M M, LIN Y Z, ZHONG F L. Tomato growth as affected by soil extract of continuously cropped okra[J]. Chinese Journal of Eco-Agriculture, 2019, 27(1): 81-91
* 福建省科技重大专题(2018NZ0002-2)和福建省发改委农业五新项目(K6017201A)资助
钟凤林, 主要从事设施植物种质创制及产业化、都市农业研究。E-mail: zhong591@fafu.edu.cn
严逸男, 主要从事蔬菜生理生化研究。E-mail: 13405959576@163.com
2018-05-23
2018-09-28
* This study was supported by the Science and Technology Major Project of Fujian Province (2018NZ0002-2) and the Agricultural Five New Project of Development and Reform Commission of Fujian Province (K6017201A).

