物理化学课程中化学动力学教学探讨
范果红,徐红,伊廷锋
(安徽工业大学 化学与化工学院,安徽 马鞍山 243002)
作为物理化学必不可少的组成部分,化学动力学的任务主要是研究化学过程进行的速率和反应机理。化学动力学以非平衡系统为研究对象,分析在反应过程中物质的性质随时间变化的规律和及其动态过程。这些研究更加贴近我们的日常生活和工业生产,在理论和实践上都有重大意义。
教材中对化学动力学的介绍,主要讨论了反应速率方程、反应速率与反应机理的关系,简单介绍了两种反应速率理论,及其他因素(溶液、光、催化剂)对反应速率的影响。其中,反应速率方程、活化能及反应机理的确定是构成化学动力学的理论基础,也是化学动力学目前研究的主要问题。教材对这些重要动力学知识的介绍与实际应用链接不是非常紧密,在真实的化学反应中这些重要动力学参数(反应速率、反应级数、反应活化能等)怎么得出,没有做详细讲解。催化作为化学动力学重要的研究领域,在教材中也有简单介绍。世界上90%以上的化工过程以及60%以上的产品都与催化有关,其中尤其重要的是多相催化反应[1]。目前的催化科学与技术中,催化动力学是其中一个非常重要的研究方向。鉴于目前催化科学的重要性和广泛应用,对于本章内容的讲解,我们可以以催化剂及其催化反应为中心进行拓展,使学生真实了解并掌握反应过程的动力学知识。通过这种方式,学生可掌握反应动力学问题的处理方法,提高课堂上的学习兴趣和效率,同时也对学生今后可能从事的相关科研或工作有所帮助。
一、反应速率方程的测定
要确定一个化学反应的速率方程,除了基元反应可以依据质量作用定律直接得出,复杂反应(非基元反应)必须以实验测得的数据为基础得到速率方程。大部分的催化反应是复杂反应,所以反应速率方程只能通过实验测定,进而得出表观活化能。教材中介绍了多相催化反应必须经过的七个步骤,其中,反应物分子或产物分子的内、外扩散属于物理过程,反应物吸附、表面反应和产物脱附属于化学过程,也叫做表面反应过程。进行动力学实验时,要使速控步骤为表面反应过程中的一步或几步,即要排除内、外扩散影响。实验过程中常用降低催化剂粒度,增大气流线速的方法排除内、外扩散[2]。
催化反应速率方程的确定一般采用微分形式,如气—固相催化反应速率方程可写为
(1)
公式中,v为反应速率,k为反应速率常数,px、py等为气相反应物的分压力(液相反应相应换成浓度),nx、ny等为各反应物的分级数。实验中要测定反应级数,通常使用孤立浓度法。公式(1)取自然对数,可得:
lnv=lnk+nxlnpx+nylnpy+…
(2)
温度保持不变,k可看做常数。保持除Px外其他反应物分压力不变,则:
(3)
所以,求得某一反应物气体不同分压对应的反应速率v,以lnv对lnpx作图即可得到反应分级数。在“合适的实验条件”下(通常控制反应物转化率Xx< 5%),反应速率可表示为:
(4)
其中,Nx为反应气中x的摩尔流量,Wcat为反应所用催化剂的质量。
二、反应活化能的测定
根据Arrhenius方程:
k=Ae-Ea/RT
(5)
可求得反应的活化能Ea,其中R为摩尔气体常数,A为指前因子。其定积分形式为:
(6)
因此,只需得到两个温度下的反应速率常数即可得到反应的活化能。但是,“两点法”往往会存在较大的实验误差,所以实验中采用“多点法”可尽量避免大的误差。从Arrhenius方程的不定积分形式
(7)
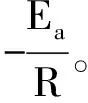
(8)

三、催化反应机理(基元反应)的确定
化学反应从分子水平来看,都是通过许多步骤和一系列的微观过程来实现。这一系列原子或分子水平上的反应称为基元反应。一个复杂反应包含的所有基元反应称为反应机理或反应历程。反应中加入催化剂可以加快反应速率,是因为它与反应物生成不稳定的中间物种,使得反应途径发生了变化,进而导致反应的表观活化能降低。例如,假设有一反应A+B→AB,加入催化剂后其机理可表示为:
通过平衡态近似法可推导出其反应速率方程。但是,大多数的多相催化反应机理都比较复杂,并且同一化学反应在不同催化剂上机理也可能不同。这也导致了对催化反应机理的探究一直是催化领域的研究重点。合理的反应机理不仅对实验现象深层次的本质特征的认识解释有重要意义,也为高效催化剂的开发和反应结果的预测提供理论依据,为工业化生产奠定基础。动力学研究的最终目的是为了推断反应机理。但是,反应速度快时通常无法用常规实验技术检测反应中各中间物种的动态结构,这也导致催化反应机理的研究进展缓慢。近年来,由于高端原位科学仪器的出现,使人们在实验中可以观察到中间物种的出现。另外,随着计算机的快速发展,理论模拟计算成为了对催化反应机理进行深入研究的另一种重要的方法。基于第一性原理和密度泛函理论,人们可以预测反应中可能存在的中间产物和过渡态,计算反应的活化能,预测催化反应的各种可能的机理。从而最终推断出实验中最有可能存在的反应机理。这为设计和制备新型催化剂、提高催化剂的反应活性和选择性提供合理的依据。这些手段都为反应机理的研究提供了技术支撑。
CO+*→CO*
O2+*→O2*
O2*→2O2*
CO*+O2*→OCOO*
OCOO*→CO2+O*
CO*+O*→CO2
若一种反应物在催化剂表面发生吸附,另一种反应物以气态或物理吸附物种的形式存在,两者之间发生反应,则为E-R机理,可表示为
O2+*→O2*
O2*→2O2*
CO+O2*→OCOO*
OCOO*→CO2+O*
CO*+O*→CO2
MVK机理即氧化-还原机理,主要发生在过渡非贵金属氧化物催化剂上,吸附态的CO*与活性晶格氧OLM结合形成*COOLM中间体。该中间体随后分解生成CO2与含有氧空位的VLM。氧空位VLM可供气相O2的吸附,与吸附态的CO*反应生成*OCOOVLM,随后分解生成CO2和含有晶格氧的OLM,催化剂恢复初态。其基元反应可表示为
CO+*→CO*
CO*+OLM→*COOLM
*COOLM→CO2+VLM
VLM+O2→O2*VLM
CO*+O2*VLM→*COOVLM
*COOVLM→CO2+OLM
由此可见,表面上看非常简单的一个反应,其机理研究也是经历了相当长的时间,不同的催化剂催化同一个反应,其机理也可能很不一样。因此,对一个反应是否为基元反应的判断,要基于实验事实。根据现有的实验数据模拟反应动力学是反应机理研究的主要手段。推测出的反应机理中的每个基元反应可以分别应用质量作用定律,再依据常用速率方程的近似处理方法,例如速控步骤法、平衡态近似法、稳态近似法等得出速率方程,并和实验测得的反应速率方程对比。
四、结语
近几十年来,化学动力学从宏观层次到原子—分子尺度的微观层次研究都有了很大发展。在动力学教学中,将动力学的基本概念、方法与催化科学联系起来,学生不仅对这部分的基础内容有了更深的理解,同时也对催化科学有了初步认识。催化科学是一门交叉性的综合学科,以催化反应为中心展开化学动力学的教学,增强了课堂知识与生产实际的关联,激发了学生主动学习的兴趣,提高学生的创新和研究能力。

