祛湿化瘀方对非酒精性脂肪肝模型大鼠血清游离脂肪酸谱的影响Δ
苟小军,冯琴,胡义扬#
(1.上海市宝山区中西医结合医院中心实验室,上海 201999;2.上海中医药大学附属曙光医院/上海中医药大学肝病研究所,上海 201203)
随着人们生活水平的提高和生活方式的改变,非酒精性脂肪肝(NAFLD)的发病率逐年升高,已成为全球性医疗和公共卫生问题[1-3]。NAFLD现已成为西方发达国家人群患慢性肝病和肝功能异常的主要原因之一,其在普通人群中的发病率一般约为20%~33%;大约50%的NAFLD患者在患病4~13年后发展为非酒精性脂肪性肝炎,40%发展为肝纤维化[4-5]。在过去20年中,亚洲国家NAFLD发病率持续上升,并且已呈年轻化趋势;在我国,NAFLD的成人发病率可达15%,在经济发达地区甚至更高[6]。
目前,临床上主要应用化学药如胰岛素增敏剂、降血脂药等治疗NAFLD,但这类药物效果并不十分理想,且容易导致患者出现并发症[7]。近些年来,中医药治疗NAFLD开始引起人们的广泛关注。许多中药不仅具有良好的抗脂肪肝效果,而且毒副作用小、价格低廉、宜长期使用,在治疗NAFLD方面显示出良好的发展前景[8]。
祛湿化瘀方来源于临床经验方,由茵陈、栀子等5味中药组成,在动物实验中多次证实,该方对高脂饮食诱导的NAFLD模型大鼠有明显的治疗作用,能够改善肝脏脂肪代谢,降低肝脏中三酰甘油(TG)和游离脂肪酸的含量[9]。但是在代谢水平上,祛湿化瘀方治疗NAFLD的具体作用机制还未阐明,尤其该方对NAFLD模型大鼠血清中不同类型的游离脂肪酸的影响尚未见报道。因此,本研究通过高脂饮食诱导建立NAFLD大鼠模型,考察祛湿化瘀方对模型大鼠血清游离脂肪酸谱的影响,为临床有效治疗NAFLD及更全面、深入地阐明该方的作用机制提供实验依据。
1 材料
1.1 仪器
7890A/5975C型气相色谱(GC)-质谱(MS)联用仪(美国安捷伦公司);H1650-W型冷冻离心机(德国Eppendorf公司);IX71型倒置显微镜(日本奥林巴斯公司);QL-86型旋涡混合器(江苏海门其林贝尔仪器制造有限公司);TP-220型电子天平(湘仪天平仪器设备有限公司)。
1.2 药品与试剂
祛湿化瘀方药液由上海中医药大学科技中心制备,冷藏备用[该方所用药材茵陈、虎杖、田基黄、姜黄、生山栀均购自上海华宇药业有限公司,有明确的原产地,经生药学专家鉴定均为真品。上述药材按4∶4∶3∶2∶2的质量比配伍;茵陈、虎杖、姜黄以75%乙醇提取3次,滤过,回收乙醇,留取药液;生山栀、田基黄进行水提醇沉处理;合并上述药液,浓缩,使终质量浓度为0.93 g/mL(按生药计)]。
含37种脂肪酸甲酯的混合对照品试剂盒(美国Sigma公司,其具体组成见表1);1%水杨酸甲酯溶液[内标,梯希爱(上海)化成工业发展有限公司,批号:119-36-8];正己烷、硫酸、甲醇等试剂均为分析纯,购自国药集团化学试剂有限公司;实验用水为超纯水。
1.3 动物
SD雄性大鼠30只,体质量(170±20)g,清洁级,购自中国科学院上海实验动物中心,动物生产合格证号:SCXK(沪)2003-0002。大鼠在上海中医药大学实验动物中心清洁级动物房中饲养与实验,期间自由饮水。
2 方法
2.1 分组、造模与给药
大鼠适应性饲养1周后,按计算机随机数字表分为正常组、模型组、祛湿化瘀方组,每组10只。模型组和祛湿化瘀方组大鼠饲喂高脂饲料(普通饲料+2%胆固醇+10%猪油)8周,建立NAFLD模型;正常组大鼠饲喂普通饲料8周。参照文献[9]方法,自第5周起,祛湿化瘀方组大鼠按0.1 mL/kg灌胃祛湿化瘀方药液(相当于体质量60 kg成人的10倍剂量),正常组和模型组大鼠灌胃等量生理盐水,连续给药4周。
2.2 标本留取
在饲喂第8周结束时,称定大鼠体质量,按3 mL/kg腹腔注射2%戊巴比妥钠溶液进行麻醉;打开大鼠腹腔,从下腔静脉收集血液并于4℃静置2 h,3 000 r/min离心15 min后,吸取上层血清于-70℃冷冻保存待测;剖取肝脏,取肝右叶部分组织,以10%中性福尔马林溶液固定,用于病理学检查。
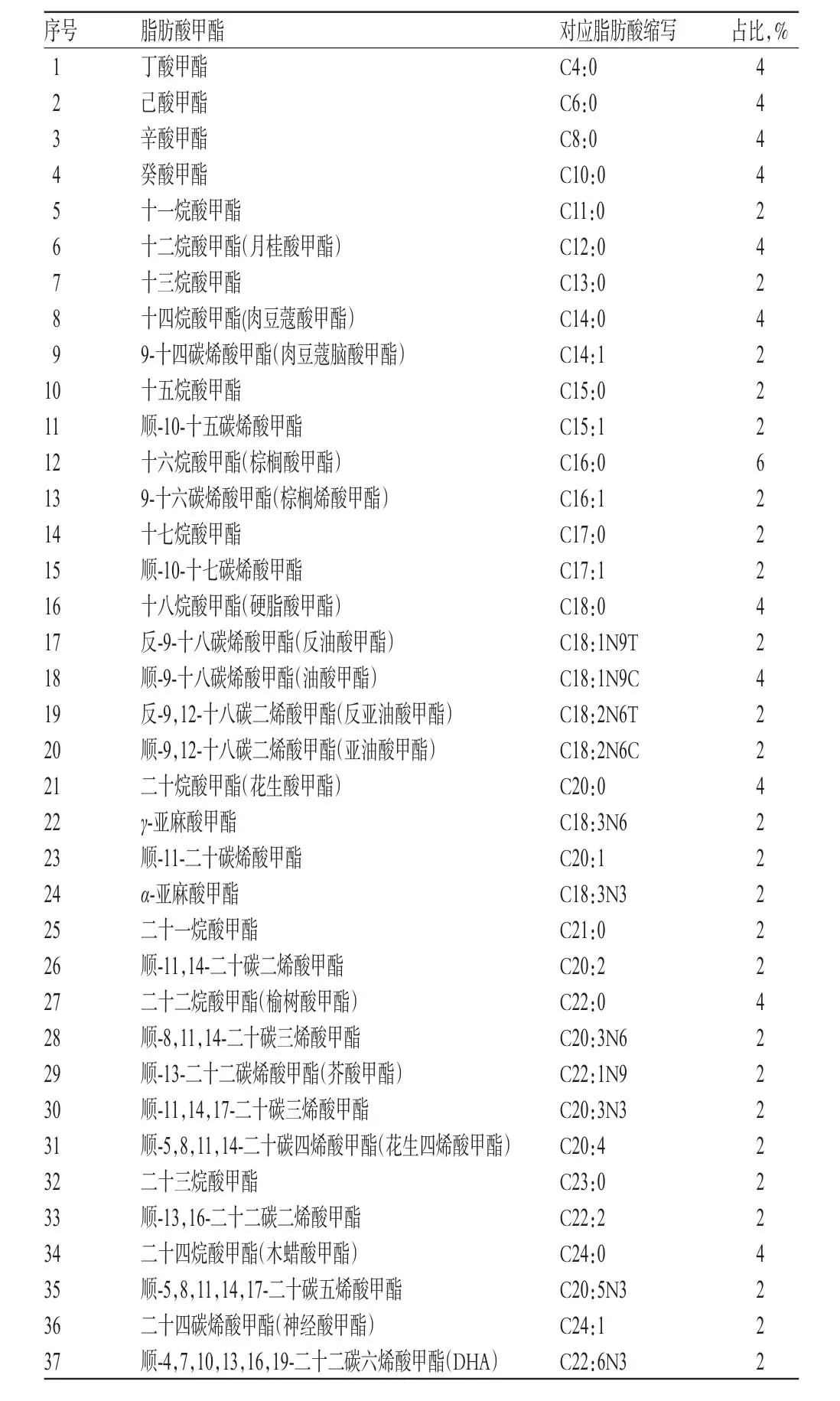
表1 含37种脂肪酸甲酯对照品的混合标准试剂盒组成Tab 1 Composition of mixed standard reagent kit containing 37 kinds of reference substance of fatty acid methyl ester
2.3 肝组织病理学检查
取“2.2”项下固定后的肝组织,脱水,石蜡包埋,按4 μm厚度切片。然后进行常规苏木精-伊红(HE)染色,于倒置显微镜下观察,并依据《非酒精性脂肪性肝病诊疗指南》[10],判定肝细胞脂肪变性程度。
2.4 血清游离脂肪酸的检测
2.4.1 溶液的制备 取含37种脂肪酸甲酯对照品的混合标准试剂适量,用正己烷配制成总成分质量浓度为1 000、500、100、50、10、1 mg/L的系列混合对照品溶液;另外,直接将1%水杨酸甲酯溶液以正己烷稀释至500 μg/mL,作为内标溶液。
2.4.2 血清样本预处理(脂肪酸甲酯化衍生反应) 取大鼠血清样本50 μL,加入1%硫酸甲醇溶液2 mL,于80℃水浴中放置30 min,进行甲酯化反应;然后加入正己烷1 mL,涡旋30 s萃取,静置分层;分取有机相,加水5 mL洗涤,再加正己烷1 mL,涡旋30 s萃取,合并有机相,静置分层;吸取有机相上层清液300 μL,加内标溶液20 μL,混匀后进样测定。
2.4.3 色谱与质谱条件 (1)色谱条件:色谱柱为Agilent DB-WAX毛细管柱(30 m×0.25 mm,0.25 μm);进样量为1 μL,分流进样(分流比10∶1);进样口温度为280℃;离子源温度为230℃;传输线温度为250℃;色谱柱程序升温(起始温度50℃,保持3 min;以10℃/min升至220℃,保持20 min);载气为氦气,载气流速为1.0 mL/min。(2)质谱条件:离子源为电喷雾电离源(ESI);选择离子扫描(SIM)模式;电子能量为70 eV。
2.4.4 方法学考察 对所建立的GC-MS法进行方法学考察。(1)线性关系:取1 000、500、100、50、10、1 mg/L的系列混合对照品溶液各适量,分别加入内标溶液适量,按“2.4.3”项下色谱与质谱条件进样测定。以混合对照品中各组分的质量浓度为横坐标、各组分与内标的峰面积之比为纵坐标,进行线性回归分析,结果相关系数均大于0.99,表明线性关系良好。(2)精密度:取500 mg/L的混合对照溶液连续进样6次,结果各组分峰面积的RSD在0.99%~7.89%之间,表明仪器精密度良好。(3)定量限:取10 mg/L的混合对照溶液连续进样6次,以6次测定结果标准差的10倍作为本方法的定量限,结果各组分的定量限在0.013~0.87 mg/L之间,表明本方法的灵敏度能够满足分析要求。
基于所建分析方法,对含37种脂肪酸甲酯的混合对照品进行检测,结果共获得32种脂肪酸甲酯峰(其中,C4:0、C18:1N9T、C18:2N6T、C20:3N6、C24:1未能检出),总离子流色谱图见图1。由图1可见,各脂肪酸甲酯组分之间及与内标(IS)之间均能实现良好分离,表明本方法可靠。
2.4.5 血清样本中游离脂肪酸含量测定 取大鼠血清样本50 μL,按“2.4.2”项下方法预处理,并按“2.4.3”项下色谱与质谱条件进样测定,再按标准曲线法计算其中游离脂肪酸含量。
2.5 统计学方法
所有数据运用SPSS 21.0软件进行统计分析。计量资料以x±s表示,采用t检验进行组间比较。P<0.05为差异有统计学意义。
3 结果
3.1 各组大鼠肝组织病理学检查结果
显微镜下可见,正常组大鼠肝组织细胞结构正常,未见脂肪样变性等异常变化;与正常组比较,模型组大鼠肝组织多发坏死肝细胞,并有多处坏死灶,坏死区有炎症细胞浸润,肝细胞出现脂肪样变性和空泡变性;与模型组比较,祛湿化瘀方组大鼠肝细胞的脂肪样变性和肿胀程度明显减轻,坏死减少,炎症细胞浸润情况亦减少。各组大鼠肝组织病理学变化显微图见图2。
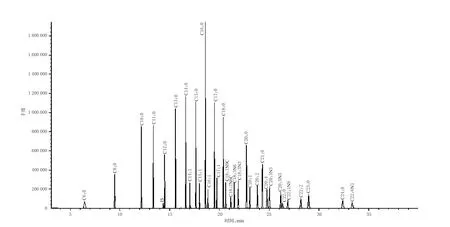
图1 总离子流色谱图Fig 1 Total ion chromatogram

图2 各组大鼠肝组织病理学变化显微图(HE染色,×200)Fig 2 Micrographs of pathological change of liver tissue in rats of each group(HE staining,×200)
3.2 各组大鼠血清游离脂肪酸的组成与含量比较
各组大鼠血清饱和脂肪酸、不饱和脂肪酸含量测定结果见表2、表3。分别对测得的32种血清游离脂肪酸含量按照饱和脂肪酸、不饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸进行分类统计,结果见表4(其中,C6:0、C8:0、C10:0、C11:0、C13:0、C14:1、C15:1、C16:1、C20:5N3、C20:2、C22:2、C23:0在血清中含量太低,只有个别大鼠能检测到,因此未能纳入统计)。
由表2、表3可见,与正常组比较,模型组大鼠血清中C12:0(月桂酸)、C14:0(肉豆蔻酸)、C15:0(十五烷酸)、C16:0(棕榈酸)、C17:0(十七烷酸)、C18:0(硬脂酸)、C20:0(花生酸)、C21:0(二十一烷酸)、C22:0(榆树酸)等饱和脂肪酸含量均显著升高,差异均有统计学意义(P<0.05);C17:1(顺-10-十七碳烯酸)、C18:1N9C(油酸)、C18:3N3(α-亚麻酸)、C18:3N6(γ-亚麻酸)、C22:1N9(芥酸)、C18:2N6C(亚油酸)、C20:1(顺-11-二十碳烯酸)、C20:4(花生四烯酸)、C20:3N3(顺-11,14,17-二十碳三烯酸)、C22:6N3(DHA)等不饱和脂肪酸含量均显著降低,差异均有统计学意义(P<0.05或P<0.01)。由表4可见,与正常组比较,模型组大鼠血清中总脂肪酸和饱和脂肪酸含量均显著升高(P<0.05),不饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸含量均显著降低(P<0.05)。

表2 各组大鼠血清饱和脂肪酸含量测定结果(n=10,μg/mL)Tab 2Results of serum contents of saturated fatty acid in rats of each group(n=10,μg/mL)
由表2、表3可见,与模型组比较,祛湿化瘀方组大鼠血清中C12:0(月桂酸)、C14:0(肉豆蔻酸)、C15:0(十五烷酸)、C16:0(棕榈酸)、C17:0(十七烷酸)、C18:0(硬脂酸)、C20:0(花生酸)、C21:0(二十一烷酸)、C22:0(榆树酸)等饱和脂肪酸含量均显著降低,差异均有统计学意义(P<0.05或P<0.01);C17:1(顺-10-十七碳烯酸)、C18:1N9C(油酸)、C18:3N3(α-亚麻酸)、C18:3N6(γ-亚麻酸)、C22:1N9(芥酸)、C18:2N6C(亚油酸)、C20:1(顺-11-二十碳烯酸)、C20:4(花生四烯酸)、C20:3N3(顺-11,14,17-二十碳三烯酸)、C22:6N3(DHA)等不饱和脂肪酸含量均显著升高,差异均有统计学意义(P<0.05)。由表4可见,与模型组比较,祛湿化瘀方组大鼠血清中总脂肪酸和饱和脂肪酸含量均显著降低(P<0.05),不饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸含量均显著升高(P<0.05)。
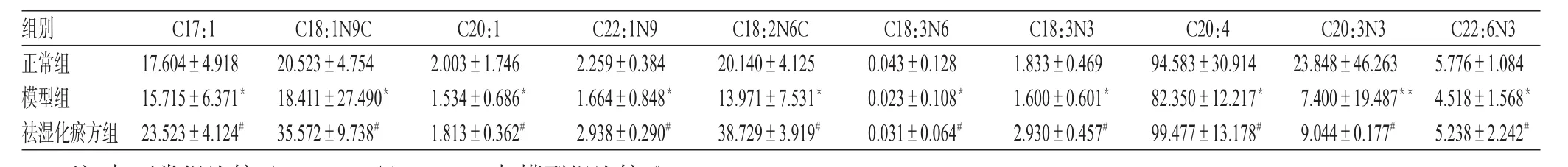
表3 各组大鼠血清不饱和脂肪酸含量测定结果(n=10,μg/mL)Tab 3Results of serum content of unsaturated fatty acid in rats of each group(n=10,μg/mL)

表4 各组大鼠血清不同类别游离脂肪酸含量统计结果(n=10,μg/mL)Tab 4Results of serum content of various free fatty acids in rats of each group(n=10,μg/mL)
4 讨论
NAFLD在古代中医文献中没有记载,其病因(多为饮食不节、久坐少动、精神压力大、过度肥胖)、病位(肝脏)和临床表现涉及祖国医学中“痰证”“湿阻”“胀满”“积聚”“胁痛”等病证,因此可归属于中医的“积证”“胁痛 ”“ 痰 证 ”“ 瘀 血 ”“ 黄 疸 ”“ 鼓 胀 ”“ 肝 痹 ”等 范 畴 。NAFLD发病与肝、脾、肾功能密切相关,主要表现为肝失疏泄、肝血瘀滞,脾失健运、内生湿浊以及肾精亏损等。中医治疗该病主要以清热祛湿、疏肝理气、健脾化痰、活血化瘀、补肾益精等法为主,兼顾虚实、寒热、阴阳辨证用药[11]。祛湿化瘀方是临床经验方,具有清热祛湿、活血化瘀的功效。以往的研究表明,该方对高脂饮食或四氯化碳联合高脂低蛋白饮食诱导的脂肪肝模型大鼠具有明显的保护和治疗作用,能显著降低TG、游离脂肪酸和肿瘤坏死因子α(TNF-α)水平,可改善肝脏脂肪样变性和炎症状态[12-13]。本课题组前期对该方改善肝脏脂肪代谢、防治NAFLD的作用机制进行了研究,发现该方能通过干预“脂联素-游离脂肪酸代谢”路径,来调节单磷酸腺苷蛋白激酶(AMPK)活性及其相关靶蛋白活性,降低肝组织游离脂肪酸水平,从而减轻肝脏中脂质的过度沉积[9-10]。
脂肪酸根据碳链上是否包含双键分为不饱和脂肪酸和饱和脂肪酸;不饱和脂肪酸进一步根据碳链上双键的数量分为单不饱和脂肪酸和多不饱和脂肪酸;根据碳链上双键的位置又可将多不饱和脂肪酸分为ω-3多不饱和脂肪酸、ω-6多不饱和脂肪酸、ω-9多不饱和脂肪酸等[14]。本研究结果显示,NAFLD模型大鼠血清中月桂酸、肉豆蔻酸、十五烷酸、棕榈酸、十七烷酸、硬脂酸、花生酸、二十一烷酸、榆树酸等饱和脂肪酸含量均显著升高,这与高脂饮食摄入和机体内分泌代谢紊乱有关。高脂饮食中的猪油富含饱和脂肪酸,特别是棕榈酸的含量较高[15],不仅可增加血液中游离脂肪酸含量,还可引起胰岛素抵抗[16]。已有研究证明,饱和脂肪酸能降低胰岛素敏感性,可作为配体直接激活Toll样受体4(TLR4)信号通路并促进TNF-α、白细胞介素6(IL-6)等炎症因子的释放,诱导慢性炎症的发生,并加重胰岛素抵抗(IR)[17]。游离脂肪酸通常积聚在肝脏中,当机体摄入高脂饮食或脂肪组织功能异常、无法储存脂质时,过量的脂质会直接进入并蓄积于肝脏,引发肝脏炎症和NAFLD[18]。
本研究结果显示,NAFLD模型大鼠血清中顺-10-十七碳烯酸、油酸、α-亚麻酸、γ-亚麻酸、芥酸、亚油酸、顺-11-二十碳烯酸、花生四烯酸、顺-11,14,17-二十碳三烯酸、DHA等不饱和脂肪酸含量均显著降低。据报道,富含单不饱和脂肪酸的橄榄油可以降低高脂饮食诱导的肥胖模型小鼠的体质量,降低血清TG和转氨酶水平,并显著降低肝脏脂肪含量;同时,单不饱和脂肪酸可降低糖尿病患者的血清低密度脂蛋白(LDL)、TG和空腹血糖(FBG)水平,并使高密度脂蛋白(HDL)明显升高[19-20]。ω-3多不饱和脂肪酸参与了血糖控制过程,对IR和NAFLD有明显影响,其缺乏将伴随胰岛素敏感性改变及脂肪病变[21]。此外,胰岛素信号转导异常和脂肪代谢失衡是脂肪肝形成的主要原因之一,饮食中的不饱和脂肪酸可以调节与葡萄糖代谢有关的酶和激素如α-淀粉酶、麦芽糖酶、胰岛素、瘦素等的水平,从而降低血糖,改善胰岛素敏感性,减轻IR[14]。已有研究发现,富含多不饱和脂肪酸如α-亚麻酸、亚油酸、花生四烯酸等的食物可以抑制肝细胞中的脂肪积聚,这一作用可能是通过上调脂肪酸β氧化、酰基辅酶A氧化酶和中链酰基辅酶A脱氢酶基因表达,下调胆固醇调节元件结合蛋白(SREBP-1c)表达,减轻IR等机制实现的[22-24]。
本实验中的模型组大鼠血清中饱和脂肪酸含量显著升高,不饱和脂肪酸含量显著降低,提示当发生NAFLD时机体同时发生了脂肪酸紊乱,而脂肪酸紊乱会导致肝内脂质过度沉积,进一步加重脂肪肝组织病变[25]。而采用祛湿化瘀方干预后,模型大鼠肝组织病理学变化明显改善;且经GC-MS法测定结果证实,祛湿化瘀方干预能显著改善模型大鼠血清中饱和脂肪酸和不饱和脂肪酸含量的异常变化,调节紊乱的游离脂肪酸谱趋于正常。
综上,笔者认为当高脂饮食导致大鼠发生NAFLD时,血清饱和脂肪酸含量的升高和不饱和脂肪酸含量的降低既是NAFLD的作用结果,也是促进NAFLD发展的因素。NAFLD模型大鼠血清中存在明显的游离脂肪酸谱紊乱,而不同类型的脂肪酸在NAFLD的发生和发展过程中发挥着不同的作用。其中ω-3多不饱和脂肪酸(如α-亚麻酸、DHA等)具有明显的抗炎和改善脂质代谢作用,并能显著改善NAFLD模型大鼠肝脂肪样变性,减轻肝组织炎症反应。建议通过膳食补充ω-3多不饱和脂肪酸或采用祛湿化瘀方等药物干预脂肪酸代谢,从而有效预防和治疗NAFLD。

