伊贝母鳞茎和茎段的组织培养
,
(辽宁农业职业技术学院,辽宁 营口 115009)
新疆野生贝母种质资源丰富,花色绚丽,花型多姿,并具有高抗寒性、早春开花的优点,在辽宁、北京、长沙等地引种均已获得成功[1-2],极其适合我国北方高寒地区园林美化[3]。伊贝母(F.pallidiflora)是其中一种观赏价值较高的新疆野生贝母[4]。伊贝母自然繁殖系数低、人工生产技术难度大,目前对其开发利用的材料主要来源于野生资源,然而由于人工的过度采挖,造成野生资源逐渐枯竭,极大的限制了伊贝母在园林上的大面积推广应用。离体培养是当前珍稀名贵植物品种种质保存和快速繁殖的最有效途径,通过离体培养可以达到伊贝母快速繁殖、保护野生资源和促进园林应用推广的目的。本试验以伊贝母鳞茎和茎段为外植体,探讨外植体消毒和培养条件对其不定芽诱导、增殖、生根情况的影响,建立伊贝母组培快速繁殖体系,为进一步开展伊贝母的种质资源保存、繁育和扩大其园林应用提供参考。
1 材料与方法
1.1 试验材料与培养条件
1.1.1 材 料
供试用伊贝母的鳞茎和茎段均于2017年3月28日采自辽宁农业职业技术学院花卉基地栽植的出苗期植株。
1.1.2 培养条件
以MS为基本培养基,附加30 g/L蔗糖、7 g/L琼脂,调节pH值为5.8~6.0,添加不同浓度IBA、NAA、6-BA等激素。所有培养基均在121 ℃条件下高压灭菌15 min。培养条件为温度(23±1)℃、空气相对湿度60%~70%、光照时间13 h/d、光照强度1 000~1 500 lx。
1.2 试验方法
1.2.1 外植体的消毒与处理
选取白嫩、健康的新鲜贝母地下鳞茎,置于干燥阴凉通风的环境中,待表层土干后再用软毛刷弹去尘土,然后用75%的酒精棉球全面擦拭,将内外层鳞茎从鳞茎盘上轻轻剥离备用;选取自基部向上含2~4节、长4~6 cm茎段,剪去多余叶片,叶基留0.5 cm左右备用。所有选取的材料先在自来水下冲洗1~2 h,再在无菌超净工作台进行消毒灭菌。鳞茎外植体消毒灭菌采用2种处理,处理L1:按75%乙醇30 s+无菌水冲洗2次+2%次氯酸钠14 min+无菌水冲洗3次程序消毒;处理L2:按75%乙醇30 s+无菌水冲洗2次+0.5%次氯酸钠8 min+无菌水冲洗3次+2%次氯酸钠6 min+无菌水冲洗3次程序消毒。茎段消毒同样采用2种处理:处理J1:75%乙醇30 s+无菌水冲洗2次+2%次氯酸钠6 min+无菌水冲洗3次;处理J2:75%乙醇30 s+无菌水冲洗2次+0.5%次氯酸钠2 min+无菌水冲洗3次+0.5%次氯酸钠4 min。消毒后内层细小鳞茎直接备用;外层鳞茎直接切割成0.6 cm2大小备用;茎段剪切成含茎节0.5~0.8 cm长备用。所有外植体材料消毒后接种于附加不同激素组合的MS培养基中进行培养,每个处理接种30块外植体,重复3次,接种2周后统计污染率。
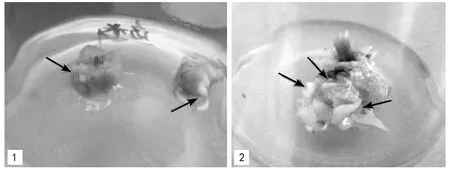
注:1为鳞茎;2为茎段;箭头所指为诱导的芽。图1 伊贝母鳞茎和茎段的不定芽诱导
污染率(%)=(污染数/接种总数)×100%。
1.2.2 不同激素组合对伊贝母鳞茎和茎段诱导不定芽的影响
将消毒后的伊贝母鳞茎块和茎段分别接种于不同浓度植物激素组合的9种MS培养基上(见表1、表2),每种培养基接种30块,重复3次,接种35 d后观察并统计芽诱导率和生长情况。
1.2.3继代培养基的选择
分别选用鳞茎和茎段诱导出的不定芽,转移到含有不同浓度植物激素组合的9种MS培养基上(见表3、表4),每种培养基接种30个,重复3次,培养35 d后观察记录丛生芽增殖倍数和生长情况。
1.2.4 生根培养
当苗高长至2~3 cm时将其从基部切下,接种到不同浓度激素组合的1/2 MS培养基中(见表4),每种培养基接种30个,重复3次,培养50 d后统计生根率和生长情况。
2 结果和分析
2.1 灭菌方法对伊贝母鳞茎和茎段消毒的影响
由表1可知,不同消毒处理对伊贝母鳞茎消毒效果差异显著,对茎段的消毒效果差异不明显。处理L1:鳞茎消毒效果较差,外植体污染率高达78.3%;处理L2:即次氯酸钠在同样的消毒时间内采用不同浓度的2次处理消毒效果最佳,污染率仅为3.8%。相对鳞茎外植体来说,茎段外植体的污染率非常低,且2种消毒处理方式效果差异不大。从试验效果和实验手段简捷的方面出发伊贝母鳞茎的最佳消毒方式是70%乙醇+0.5%次氯酸钠1次消毒后用2%次氯酸钠进行2次消毒;茎段则是70%乙醇+2%次氯酸钠1次消毒效果最好。
2.2 不同激素组合对伊贝母鳞茎和茎段不定芽诱导的影响
消毒后的伊贝母鳞茎和茎段接种到含有不同浓度激素组合的MS培养基上培养15 d后,材料在鳞茎切处、茎段茎节处分化出愈伤组织,随着培养时间的延长,愈伤组织块逐渐增大,35 d后,在愈伤组织逐渐分化出芽(图1)。48 d时统计芽诱导率。
诱导率(%)=(诱导出芽的外植体总数/接种总数)×100%。
表1 灭菌方法对伊贝母鳞茎和茎段消毒的影响

处理鳞茎接种数污染率(%)存活状态处理茎段接种数污染率(%)存活状态L13078.6染菌严重J1302.4染菌较重L2303.8生长较好J2300.0生长较好
由表2和表3可知,不同浓度激素组合对鳞茎和茎段的芽诱导率影响较大。较低浓度的6-BA对芽的诱导率不高,浓度达3 mg/L时反而抑制了芽的发生。NAA则随着浓度的升高诱导率略有提高。综合来看,MS培养基添加2.0 mg/L 6-BA+0.2 mg/L NAA作为伊贝母鳞茎诱导芽的较优激素组合培养基;而MS培养基添加1.0 mg/L 6-BA+0.2 mg/L NAA作为伊贝母茎段诱导芽的较优激素组合培养基。
由此,战场当在一临近洛阳“马市”的“石桥”,即建春门石桥,而非河桥。北魏郦道元《水经注》对“建春门石桥”和“河桥”均有记载:
表2 不同激素对伊贝母鳞茎不定芽诱导的影响
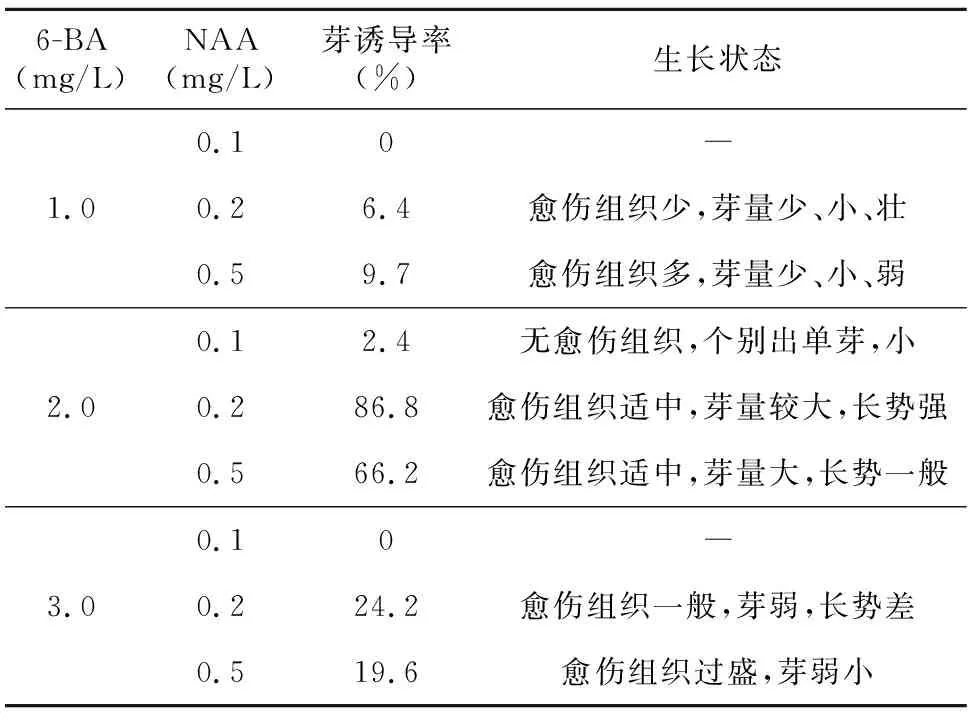
6-BA(mg/L)NAA(mg/L)芽诱导率(%)生长状态0.10―1.00.26.4愈伤组织少,芽量少、小、壮0.59.7愈伤组织多,芽量少、小、弱0.12.4无愈伤组织,个别出单芽,小2.00.286.8愈伤组织适中,芽量较大,长势强0.566.2愈伤组织适中,芽量大,长势一般0.10―3.00.224.2愈伤组织一般,芽弱,长势差0.519.6愈伤组织过盛,芽弱小
2.3 不同激素组合培养基对不定芽的继代培养的影响
将伊贝母鳞茎和茎段诱导出的不定芽转移到不同浓度激素组合的培养基中,培养15 d后发现在外植体块上长出很多新芽(见图2)。
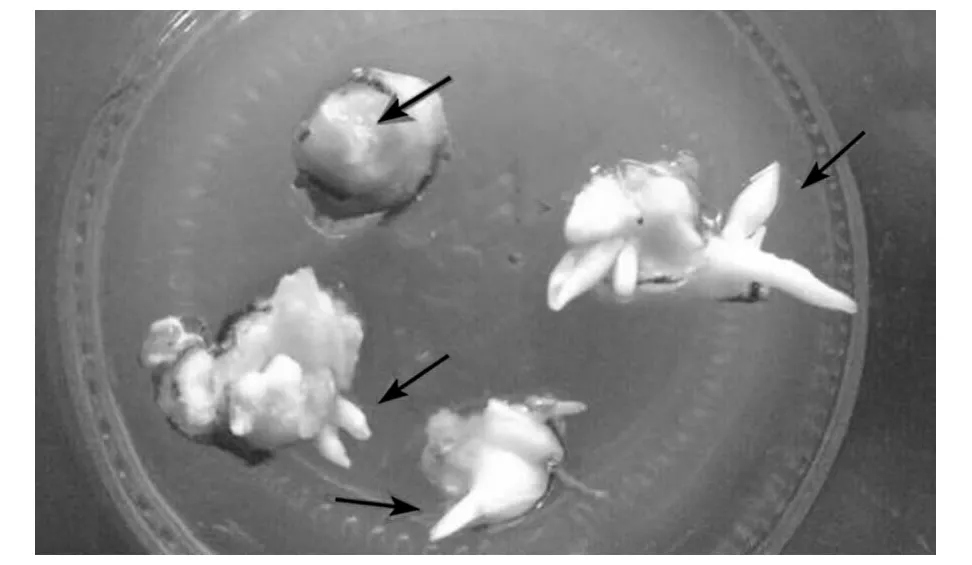
注:箭头所指为增殖的芽。图2 继代培养后出现大量的芽
表3 不同激素对伊贝母茎段不定芽诱导的影响

6-BA(mg/L)NAA(mg/L)芽诱导率(%)生长状态0.10外植体茎段变褐枯死0.50.20外植体茎段变褐枯死0.50外植体茎段变褐枯死0.10外植体茎段失绿1.00.289.2愈伤组织适中,芽量大,长势强0.554.9多数愈伤组织生长过旺,失色变褐0.10外植体茎段失绿2.00.210.8愈伤组织量少,芽量小,长势强0.50外植体茎段失绿、死亡
表4 不同激素对伊贝母鳞茎的不定芽继代培养的影响
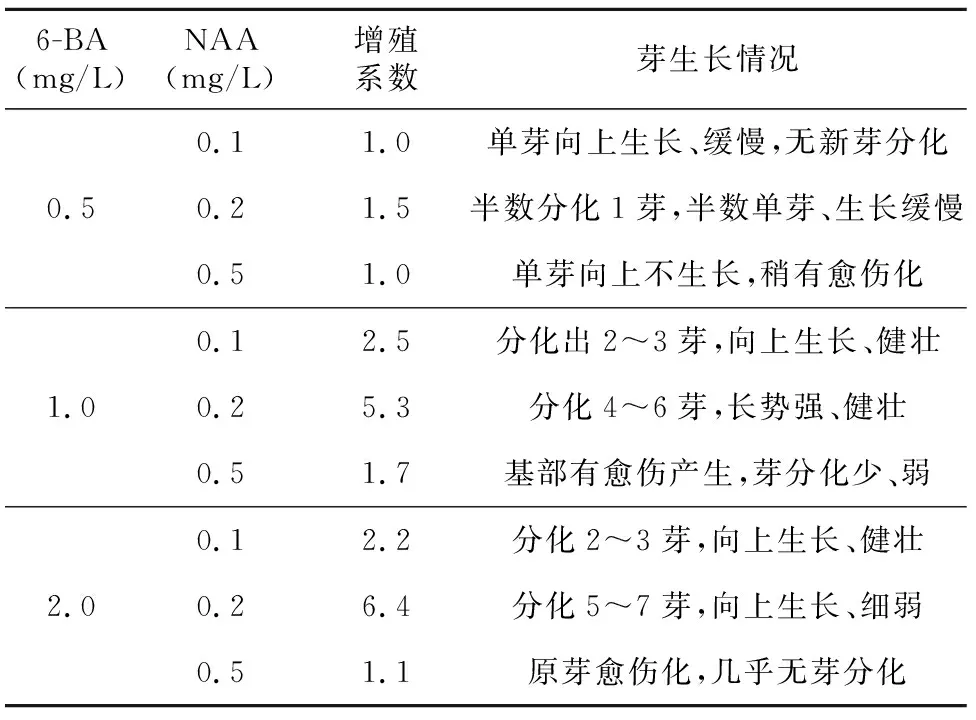
6-BA(mg/L)NAA(mg/L)增殖系数芽生长情况0.11.0单芽向上生长、缓慢,无新芽分化0.50.21.5半数分化1芽,半数单芽、生长缓慢0.51.0单芽向上不生长,稍有愈伤化0.12.5分化出2~3芽,向上生长、健壮1.00.25.3分化4~6芽,长势强、健壮0.51.7基部有愈伤产生,芽分化少、弱0.12.2分化2~3芽,向上生长、健壮2.00.26.4分化5~7芽,向上生长、细弱0.51.1原芽愈伤化,几乎无芽分化
35 d后统计不同培养基中增殖的芽数(如表3所示),6-BA和NAA组合的培养基都能不同程度促进鳞茎和茎段诱导的不定芽的增殖;随着激素浓度的升高,增殖倍数也有所增加;但当6-BA和NAA激素浓度分别达2.0 mg/L和0.5 mg/L时,新生芽的玻璃化现象严重。因此,最优伊贝母鳞茎诱导芽的继代培养基为MS培养基添加1.0 mg/L 6-BA+0.2 mg/L NAA(表4)。伊贝母茎段诱导芽的继代培养基表现与鳞茎的类似,以MS培养基添加0.5 mg/L 6-BA+0.1 mg/L NAA的为最佳继代培养基。
2.4 生根培养
将不定芽接种到不同激素浓度组合的生根培养基上,大约20 d后长出细根,在诱导根形成的同时,不定芽进一步分化形成了小鳞茎,即分化成完整的再生植株。
表5 不同激素对伊贝母茎段的不定芽继代培养的影响
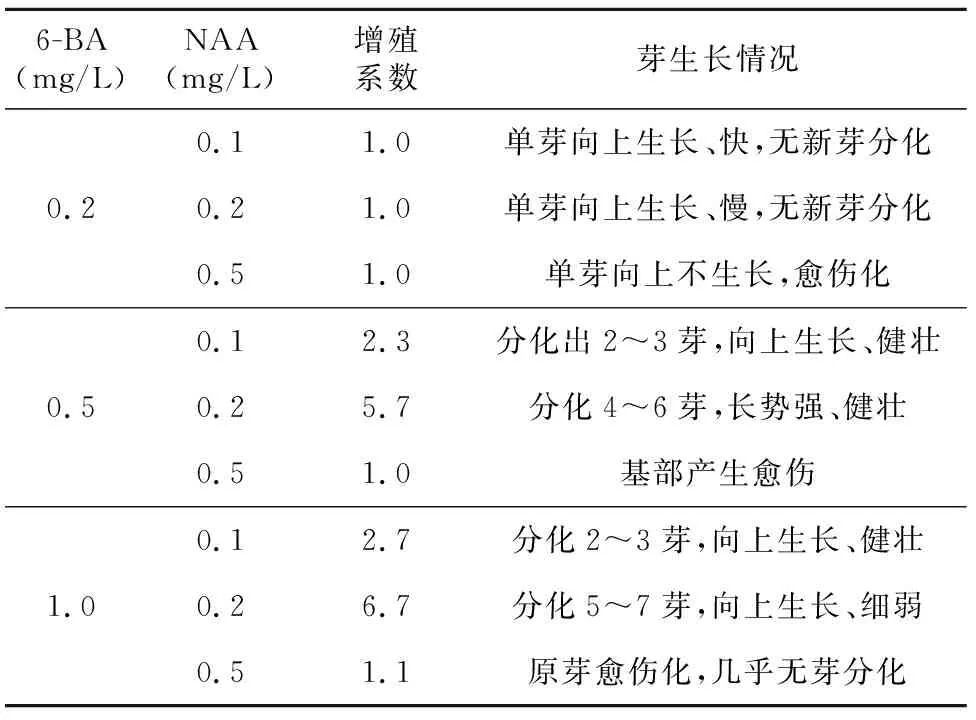
6-BA(mg/L)NAA(mg/L)增殖系数芽生长情况0.11.0单芽向上生长、快,无新芽分化0.20.21.0单芽向上生长、慢,无新芽分化0.51.0单芽向上不生长,愈伤化0.12.3分化出2~3芽,向上生长、健壮0.50.25.7分化4~6芽,长势强、健壮0.51.0基部产生愈伤0.12.7分化2~3芽,向上生长、健壮1.00.26.7分化5~7芽,向上生长、细弱0.51.1原芽愈伤化,几乎无芽分化
如表6所示,添加0.05 mg/L 6-BA+0.05 mg/L NAA的1/2 MS培养基中生根率和根长分别为96.4%和4.2 cm,明显高于其它培养基中的。
表6 不同激素对生根培养的影响

NAA(mg/L)IBA(mg/L)生根率(%)根平均长度(cm)根生长状况0.1096.52.2毛状根、0.050.0598.64.22~5条根、白、健壮00.185.83.6多数1条根,生长健壮0.10.184.43.5毛状根细、弱,一碰即掉

注:箭头所指为诱导的根。图3 诱导生成的根
3 讨 论
在植物组织培养中,无菌外植体的获得是决定组培成功的关键[5,6,11]。由于伊贝母鳞茎取自土壤之中,而且鳞茎表皮不光滑,极易导致消毒不彻底而污染。本试验中,采用70%乙醇和2%次氯酸钠1次消毒后用0.5%次氯酸钠进行2次消毒,效果较好,污染率仅为3.8%;而常规1次消毒的污染率高达78.6%。由于茎段不接触土壤,因此消毒相对容易,以70%乙醇+2%次氯酸钠组合消毒效果最好。
研究表明,MS培养基添加适宜浓度的植物激素可成功诱导不定芽[5,7-8],NAA、6-BA、KT、TDZ和2,4-D不同组合均可诱导不定芽。本试验结果表明,2.0 mg/L 6-BA+0.2 mg/L NAA组合伊贝母鳞茎不定芽的诱导率最高,芽的生长状态最好;1.0 mg/L 6-BA+0.2 mg/L NAA伊贝母茎段不定芽的诱导率最高。同时发现,不定芽的增殖培养,1.0 mg/L 6-BA+0.2 mg/L NAA组合对鳞茎诱导芽的增殖系数最高,达8.9;0.5 mg/L 6-BA+0.1 mg/L NAA组合最适合茎段诱导芽的继代培养。研究发现,贝母组织培养中外植体普遍采用鳞茎[7,10],鳞茎做外植体时小鳞茎的诱导率源于高于茎段作为外植体时的诱导率[10]。本试验研究结果显示,伊贝母鳞茎或茎段做外植体,小鳞茎的诱导率差别不大。
直接诱导小鳞茎可以极大地缩短贝母的生产周期[10]。众多研究表明,贝母外植体再生小鳞茎多通过外植体先形成愈伤组织,愈伤组织再进一步分化成不定芽,由不定芽再生成小鳞茎,也有从外植体直接分化出不定芽和小鳞茎的[9-10,12]。本试验发现,伊贝母再生小鳞茎主要是通过前一种途径,在不定芽诱导生根的过程中,芽普遍继续分化为小鳞茎。

