PEG模拟干旱条件下大豆萌发特性研究
, ,,,,,
(山西省农业科学院小麦研究所,山西 临汾 041000)
随着全球气候变暖和水资源危机加剧,干旱已成为威胁农业生产的主要因素之一[1-3]。目前,在我国规定的五大审定类农作物中,大豆因蛋白质、脂肪含量高、生育期短、生育期需水量较小、养地节肥等特点而备受关注[4]。研究大豆在干旱生产作业条件(土壤水分含量低、非浇灌地等)的萌发特性,对保证齐苗、壮苗和产量形成具有重要意义。对抗旱性研究方法有干旱区栽培、盆栽、抗旱基因检测等[5-10],其中不同PEG-6000浓度模拟干旱胁迫方法因具备简单、可靠、易行等特点而被广泛应用于各种植物抗旱研究中[11-22]。山西南部地区常年播种大豆面积约占山西省大豆播种面积的1/3,是大豆重要产区和生态区。但目前针对该地区主栽品种或典型品种的萌发期抗旱性研究尚未见报道。为此,设置了5个质量浓度PEG-6000溶液,模拟不同干旱胁迫条件,研究5个本地区典型大豆品种萌发特性,旨在为大豆萌发期抗旱研究和实际生产中品种选择提供参考。
1 材料与方法
1.1 试验设计
试验在山西省农业科学院小麦研究所大豆实验室进行。供试品种:晋豆36,晋豆19,晋遗31,晋大70,汾豆79,均为山西省南部主要或典型品种。均为黄色种皮大豆,生育期总体上表现为:晋豆36抗旱性表现一般,晋豆19耐旱,晋遗31和汾豆79抗旱性好,晋大80鉴定为一级抗旱。参照前人研究结果,设置了不同质量浓度的PEG-6000溶液,模拟不同水势,具体为:0(ck)、5%、10%、15%、20%,对应水势0(ck)、-0.1、-0.2、-0.4、-0.6 MPa[14]。
试验主要步骤:在直径9 cm塑料培养皿中,铺2层滤纸,加入20 mL相应浓度溶液,并做液面标记于培养皿外壁,盖上。选取25粒颜色均匀、大小和外观一致、饱满的大豆种子,用0.1%高锰酸钾溶液浸泡消毒2 min,蒸馏水冲洗干净,均匀摆放在培养皿滤纸上,盖好,置于光温培养箱,设置温度25 ℃,光照12 h。每处理3次重复,每隔24 h观察统计萌发率,并补充蒸馏水至标记位置,确保浓度相对稳定和滤纸湿润。
1.2 测定项目与方法
试验进行7 d,计算公式如下:
首日萌发率(%)=(首日萌发种子数/供试种子总数×100%;
发芽势(%)=(前4 d 内正常发芽的种子数/供试种子总数×100%;
发芽率(%)=(前7 d 内正常发芽的种子数/供试种子总数)×100%;
发芽指数=∑(Gt/Dt)。
式中:Gt为t天内的发芽数,Dt为相应的发芽天数。
1.3 数据分析
利用DPS 7.05软件和SPSS 18.0软件进行统计分析,分析前进行必要的反正弦平方根转换。
2 结果与分析
2.1 首日发芽率
进行萌发试验24 h后,首日发芽率方差分析见表1,重复间差异不显著,说明试验控制效果较好。进行Duncan多重比较,品种间、浓度间差异均极显著。均值比较见表2、表3,不同品种间,首日发芽率表现依次为:晋豆36>晋大70>汾豆79>晋遗31>晋豆19,前4个品种间无显著差异,但前3个品种均极显著高于晋豆19,晋遗31显著高于晋豆19。不同浓度间,随着浓度升高,萌发率降低。除对照0%与5%处理间无显著差异外,其余水平间差异极显著。平均首日发芽率从10%浓度开始明显下降,且差异极显著,20%浓度下,均值降至4%。由图1可看出,0%、5%处理下,品种间首日发芽率差异不明显,10%处理下差异最明显。值得关注的是晋豆36,在不同浓度处理下,首日发芽率变化曲线最平缓,在15%和20%这样较高浓度处理下首日萌发率最高。
表1 首日发芽率方差分析
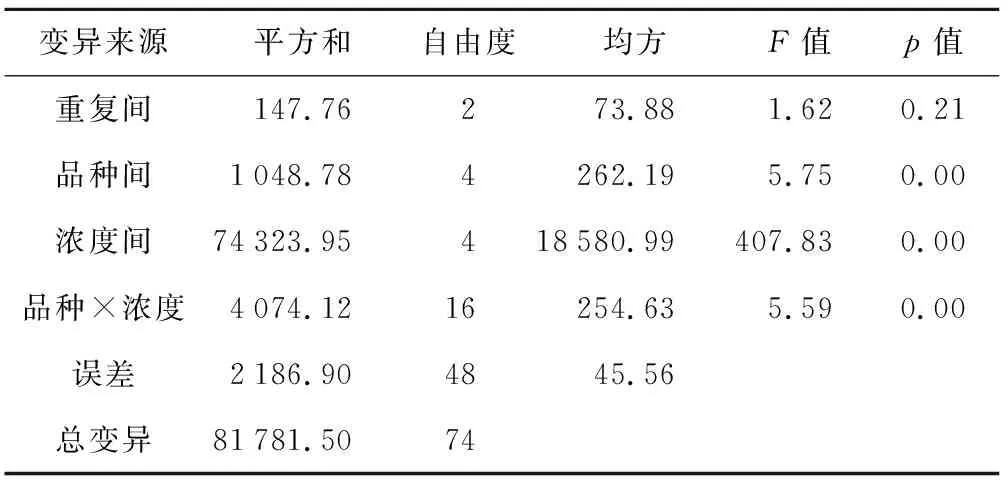
变异来源平方和自由度均方F值p值重复间147.76273.881.620.21品种间1048.784262.195.750.00浓度间74323.95418580.99407.830.00品种×浓度4074.1216254.635.590.00误差2186.904845.56总变异81781.5074
表2 不同品种首日发芽率多重比较
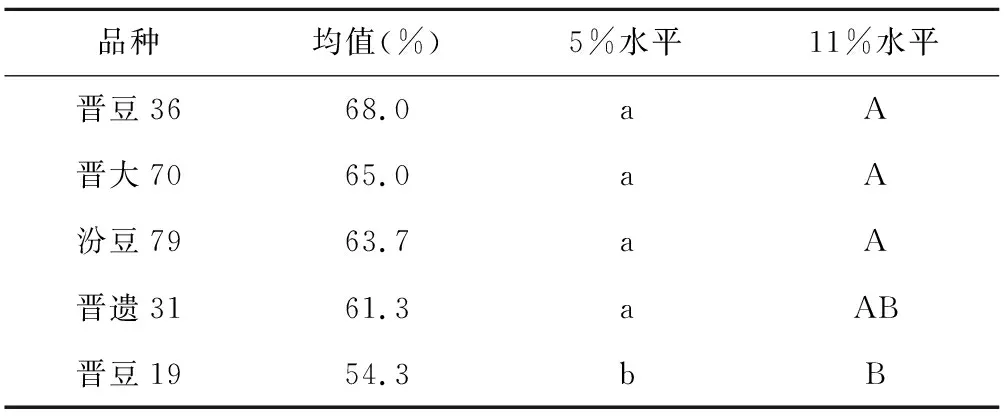
品种均值(%)5%水平11%水平晋豆3668.0aA晋大7065.0aA汾豆7963.7aA晋遗3161.3aAB晋豆1954.3bB
注:不同小写字母表示在0.05水平上的差异显著,不同大写字母表示在0.01水平上的差异显著性。下同。
表3 不同浓度首日发芽率多重比较
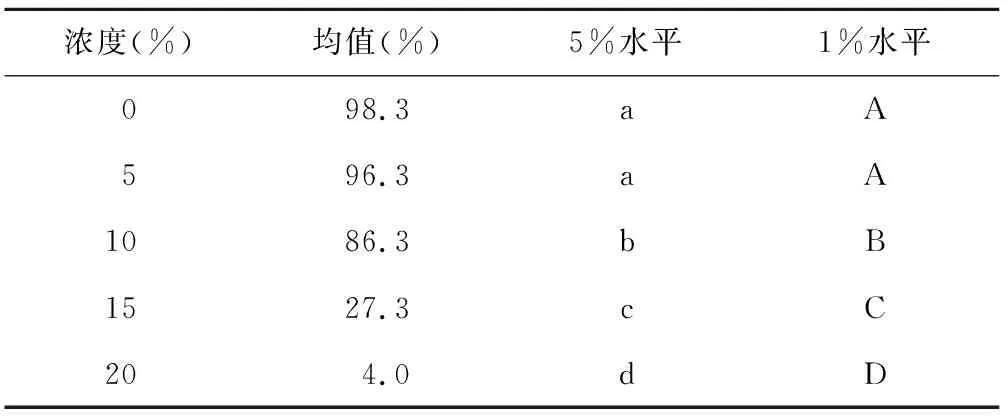
浓度(%)均值(%)5%水平1%水平098.3aA596.3aA1086.3 bB1527.3cC204.0dD
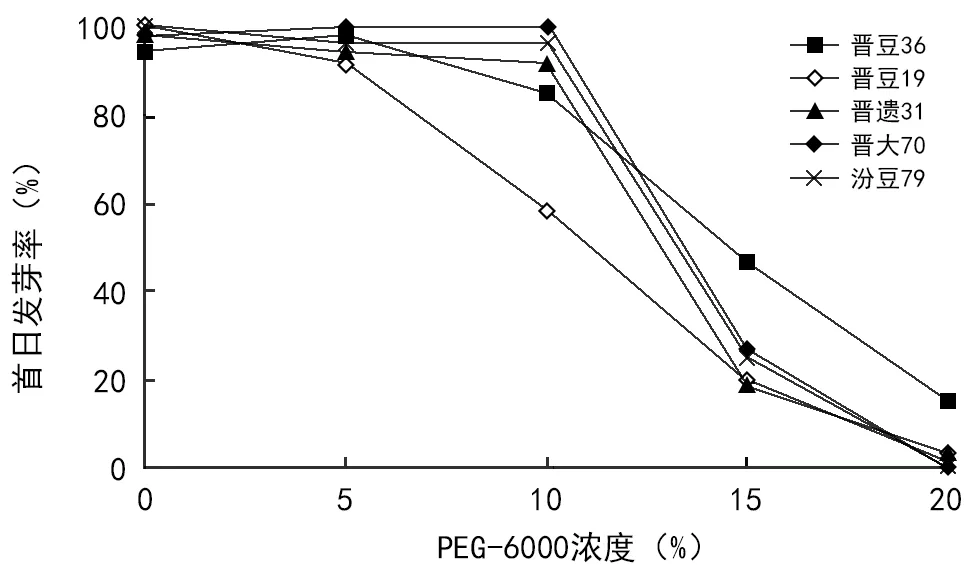
图1 不同处理首日发芽率变化
2.2 发芽势
发芽势方差分析和Duncan多重比较,结果见表4~表6。品种间、浓度间差异极显著,不同品种的发芽势排序,与首日萌发率均值排序相比,发生了较大变化。汾豆79发芽势显著高于晋遗31,极显著高于晋豆36和晋豆19;晋大70显著高于晋豆19,与其他4个品种差异不显著;晋遗31、晋豆36、晋豆19之间差异不显著。不同浓度的发芽势排序,与首日发芽率排序相比无变化,但差异显著程度有变化,即从15%处理开始,发芽势差异表现极显著。具体表现为:0、5%、10%三者之间无显著差异,15%处理极显著低于前三者,20%处理极显著低于其他处理。图2显示,从浓度15%处理开始,发芽势开始出现显著下降和明显分化。
表4 发芽势方差分析

变异来源平方和自由度均方F值p值重复间201.02 2 100.51 4.03 0.02 品种间588.73 4 147.18 5.91 0.00 浓度间17580.12 4 4395.03 176.41 0.00 品种×浓度1224.75 16 76.55 3.07 0.00 误差1195.87 48 24.91 总变异20790.4774
表5 不同品种发芽势多重比较
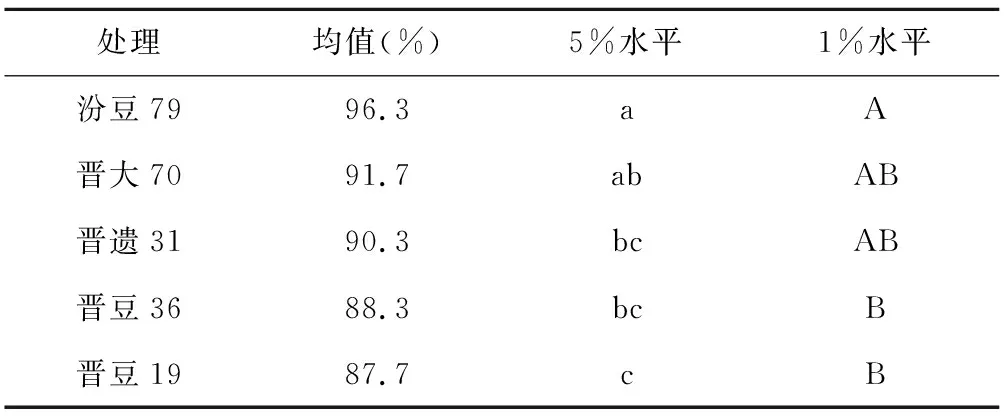
处理均值(%)5%水平1%水平汾豆7996.3aA晋大7091.7abAB晋遗3190.3bcAB晋豆3688.3bcB晋豆1987.7cB
表6 不同浓度发芽势均值多重比较
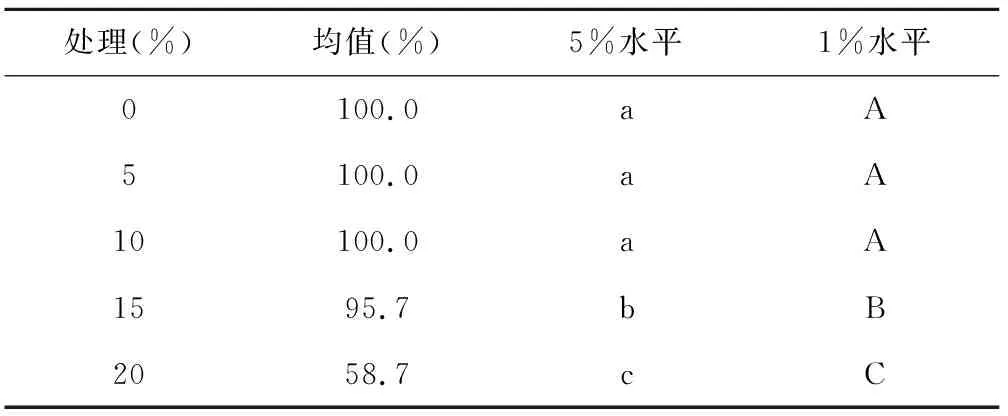
处理(%)均值(%)5%水平1%水平0100.0aA5100.0aA10100.0aA1595.7bB2058.7cC
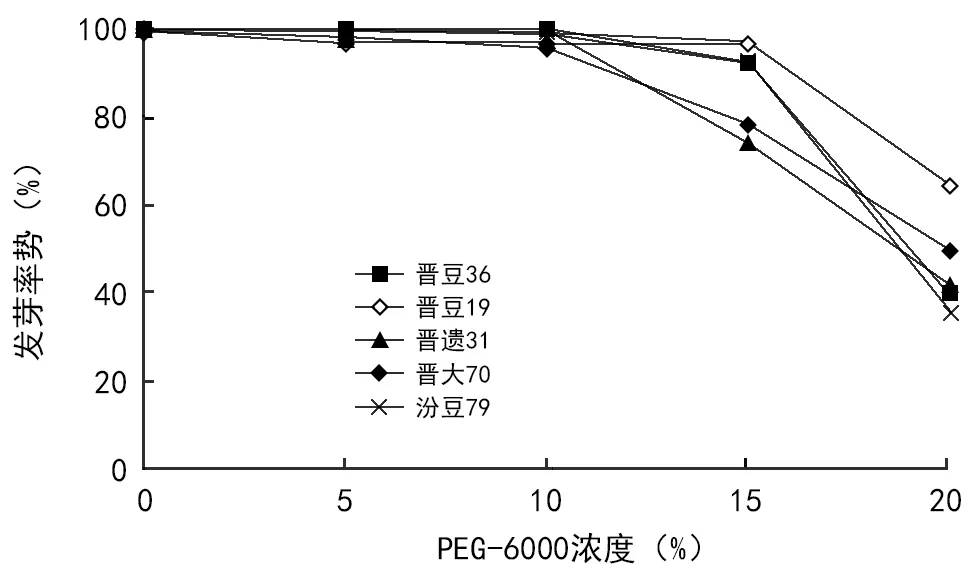
图2 不同处理发芽势变化
2.3 发芽率
发芽率方差分析和Duncan多重比较,结果见表7~表9。品种间、浓度间差异极显著。不同品种的发芽率排序与发芽势排序相比,变化不大。具体表现为:晋豆36和晋豆19交换位次,其他位次无变化。汾豆79、晋大70发芽率显著高于晋豆19、晋豆36,晋遗31与汾豆79、晋大70、晋豆19差异不显著,但显著高于晋豆36,汾豆79极显著高于晋豆36。不同浓度的发芽率排序,与首日发芽率、发芽势排序相比,均无变化,
表7 发芽率方差分析
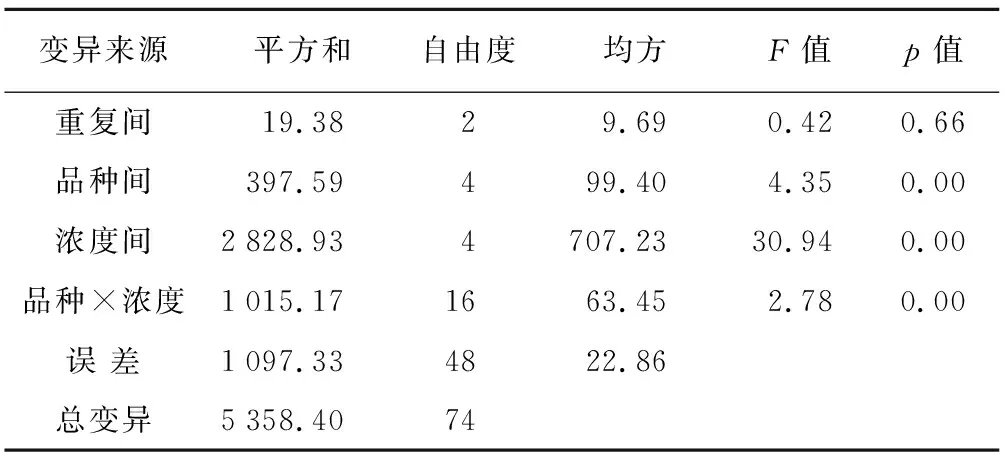
变异来源平方和自由度均方F值p值重复间19.38 2 9.69 0.42 0.66 品种间397.59 4 99.40 4.35 0.00 浓度间2828.93 4 707.23 30.94 0.00 品种×浓度1015.17 16 63.45 2.78 0.00 误 差1097.33 48 22.86 总变异5358.40 74
表8 不同品种发芽率多重比较

品种均值(%)5%水平1%水平汾豆7999.7aA晋大7099.3aAB晋遗3198.7abAB晋豆1995.7bcAB晋豆3695.0cB
表9 不同浓度发芽率多重比较
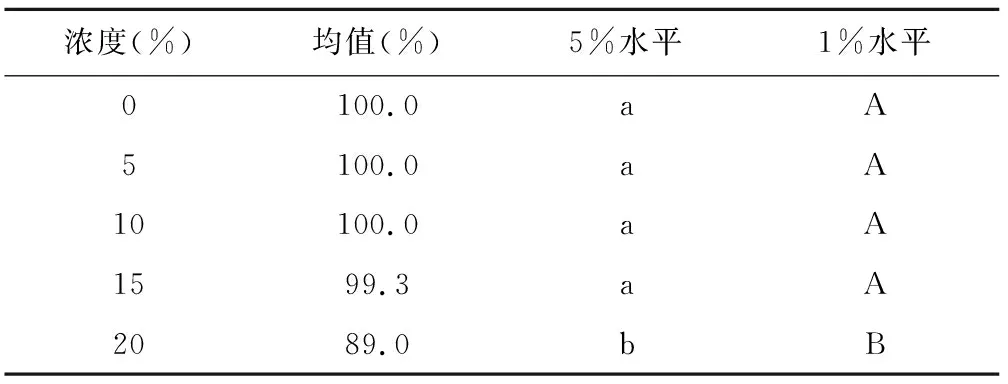
浓度(%)均值(%)5%水平1%水平0100.0aA5100.0aA10100.0aA1599.3aA2089.0 bB
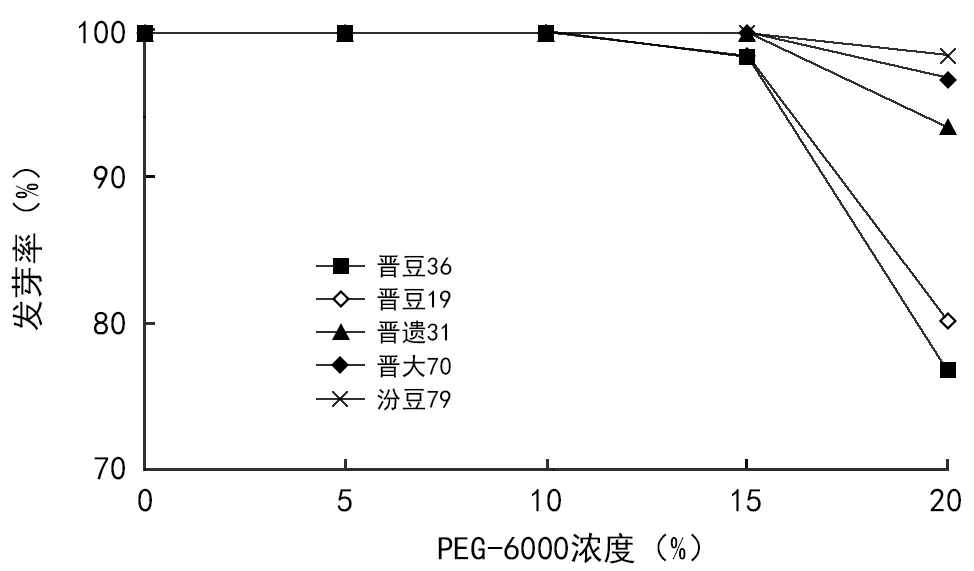
图3 不同处理发芽率变化
但差异显著程度有变化,即从20%处理开始,发芽率出现极显著下降趋势。具体表现为:前四者之间无显著差异,20%极显著低于其他处理。图3显示,从浓度20%处理开始,发芽率出现了极显著下降和明显的高低分化。
2.4 发芽指数
发芽指数方差分析和Duncan多重比较,结果见表10、表11。品种间差异不显著、浓度间差异极显著。不同浓度的发芽指数排序,与首日发芽率、发芽势、发芽率排序相比无变化,但差异显著程度有变化,即从15%处理开始,发芽指数出现极显著下降。具体表现为:0、5%、10%三者之间无显著差异,15%极显著低于前三者处理,20%处理极显著低于其他处理。图4显示,从浓度15%处理开始,发芽指数开始出现极显著下降。从浓度10%处理开始品种间发芽指数出现明显高低分化。
表10 发芽指数方差分析
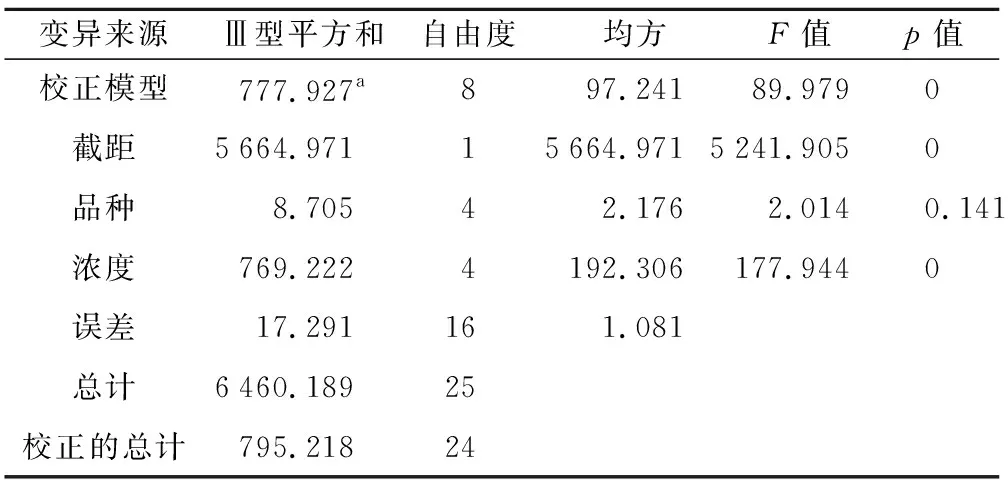
变异来源Ⅲ型平方和自由度均方F值p值校正模型777.927a897.24189.9790截距5664.97115664.9715241.9050品种8.70542.1762.0140.141浓度769.2224192.306177.9440误差17.291161.081总计6460.18925校正的总计795.21824
注:a.R2=0.978(调整R2=0.967)。
表11 不同浓度的发芽指数多重比较

处理(%)均值5%水平1%水平019.83aA519.62aA1018.57aA1511.37bB205.88cC
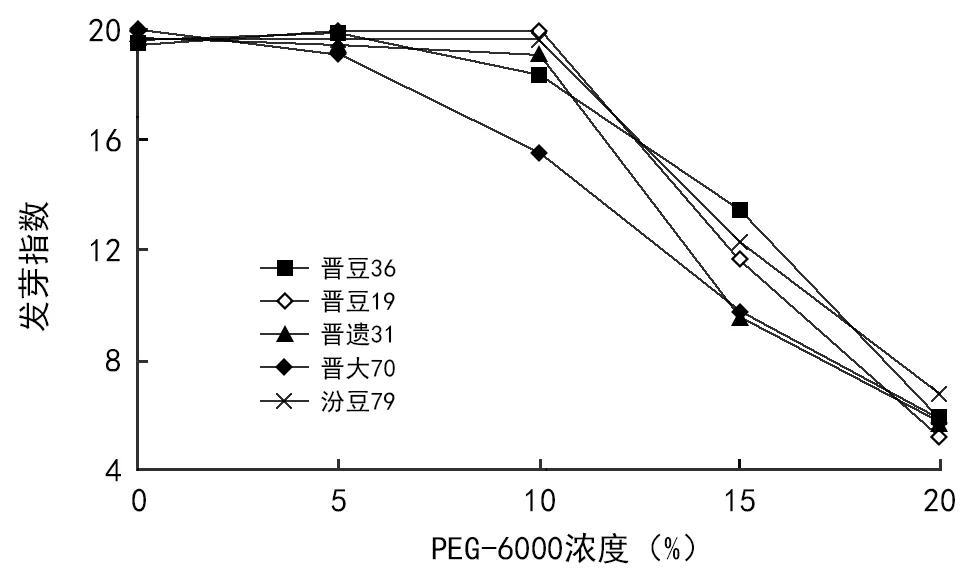
图4 不同处理发芽指数变化
3 讨 论
PEG-6000因分子量大,不易进入植株细胞内等特性,被广泛用于抗旱研究领域[11-22]。对于不同植物,对应的有效筛选抗旱PEG浓度并不完全相同。比如,20% PEG-6000处理8 h,适合作为幼苗黄芩抗旱材料的筛选条件[11],这一浓度也是评价亚麻抗旱性的最适浓度[12]。5%~10% PEG-6000浓度适合筛选小豆苗期抗旱性生理指标并鉴定抗旱性[13]。10% PEG-6000可作为大麦发芽期判断大麦抗旱性的适宜胁迫浓度[14]。
PEG-6000模拟干旱胁迫造成的萌发、生理、表观特性变化主要表现在以下方面:大麦发芽率随着浓度增加而降低[14];不同浓度处理均降低铃铛刺和披针叶野决明种子发芽率、发芽势、日相对发芽率和平均发芽速率,延缓种子萌发进程[15];玉米萌发中,也发现一定浓度对萌发指标造成的显著延缓效应[16];花生幼苗渗透调节物质(可溶性糖、可溶性蛋白等)和丙二醛(MDA)含量随PEG浓度升高都显著增加,并随胁迫时间延长而积累[17];随着干旱胁迫加重和时间延长,小麦MDA含量均不断升高[18];大麦幼苗叶片表皮蜡质总量和各组分含量在PEG胁迫6 d后均呈极显著增加[19]。这些现象均是植物对干旱胁迫的一种响应。但也有研究发现:适当浓度PEG-6000溶液处理可促进萌发;史锋厚等对油松种子萌发研究发现,溶液质量分数、处理时间和处理温度对处理效果具有明显影响[20];陈士超等研究发现,5%~10%处理对紫花苜蓿种子萌发和幼苗生理综合评价结果最优,是最适宜萌发的渗透势条件[21];张峻琳等研究表明,在35 ℃高温胁迫下,5%~15% PEG-6000对北紫生1号、北紫生2号、北紫生3号种子萌发具有促进作用,25% 浓度对北紫生4号萌发作用显著[22]。可以看出,渗透调节物质、MDA含量上升是植物对干旱胁迫的重要响应手段,通过这些植物降低了自身水势,有利于获得水分,起到抗旱效果。
在大豆方面,王燕平等利用PEG-6000模拟干旱胁迫研究了22份大豆品种(除吸水率使用30%质量浓度外,其他指标均使用15%),发现品种间萌发性状存在差异,12 h吸水率、相对发芽势、相对发芽率、根长指数与萌发抗旱系数呈极显著正相关。鉴定出晋大74、晋大70等4个高抗旱品种[23]。本研究采用的PEG-6000浓度为0~20%,梯度为5%,过高或过低的浓度不适于对干旱模拟和萌发期抗旱鉴定。试验中在培养皿外壁设置液面刻度线标记,方便了定量补充蒸馏水,减轻了整体换培养液的繁琐工作,同时保持了试验浓度相对稳定和可靠。研究发现,10% PEG-6000处理时,首日发芽率即出现极显著下降;15%浓度处理时,发芽势和发芽指数出现极显著下降;20%处理时,发芽率出现极显著下降。结论基本符合前人报道的不同浓度PEG-6000对萌发指标的影响和延缓效应。试验发现,有的品种表现为播种初期抗旱萌发,但随后抗旱能力表现不佳(如晋豆36),有的品种表现为初期抗旱一般,但后期持续抗旱转好(如汾豆79),不同品种萌发特性表现不同。总体上,汾豆79、晋大70表现萌发期抗旱性表现较好。15%~20% PEG-6000比较适合大豆萌发期抗旱的筛选和鉴定。后续研究应加强试验品种的广泛性和代表性,加强生理生化和分子生物学变化分析和机理探索,设置更有效的浓度区分发芽率,跟踪研究其他重要生育时期的抗旱性表现。

