辐照对火龙果果浆杀菌效果及品质的影响
杜晓静,白新鹏,*,李卓婷,刘 品,曹 君,姜泽放,邓志勇,高晓东
(1.海南大学食品学院,生物活性物质与功能食品开发重点实验室,海南 海口 570228;2.中核海南海原开发有限公司,海南 海口 570228;3.海南北纬十八度果业有限公司,海南 东方 572600)
火龙果(pitaya)又名青龙果、红龙果,是仙人掌科(Cactaceae)量天尺属(Hylocereus)和蛇鞭柱属(Selenicerus)植物,红心火龙果现主要分布在我国海南及广西、广东等大陆南部地区[1]。成熟果实果肉肥厚、口感香甜、色泽鲜亮诱人,并且富含人体所需的多种营养成分如VC、糖类和多种有机酸等。但由于红心火龙果含水量高,营养丰富,受到机械作用后组织结构易遭到破坏,导致呼吸作用加快,并发生失水皱缩等现象;同时也为微生物的生长创造了有利的条件,导致微生物大量繁殖,极大程度地降低了营养品质并缩短了货架期[2-3]。由于鲜果保存期不长,为了适应市场的需要,常把鲜果制成果浆进行出售。因此,研究火龙果果浆的保鲜问题具有实用价值。
为了最大限度地保持果浆产品的新鲜程度,目前使用的杀菌手段主要有热处理[4]、超高压[5]、高压脉冲电场[6]、紫外线[7]、臭氧[8]以及辐照[9]等。在实际工业生产中常采用热杀菌方法,如巴氏杀菌,但热杀菌技术容易破坏果蔬原有的营养成分[10]。冷杀菌技术能够很好地保持果汁中色、香、味。辐照杀菌是一种高效的冷杀菌技术,不仅可以减少害虫滋生和微生物生长引起的果实腐烂,还可以延缓果实的成熟与衰老,是一种效果好、安全、成本低、适用面广的杀菌技术[11]。近年来,国内外学者已经对辐照在果蔬汁的保鲜上做出了一定的研究,但辐照对火龙果果浆的杀菌效果和生理生化的影响鲜见报道。Song等[12]报道了辐照处理对萝卜汁与羽衣甘蓝汁在微生物、营养成分、感官特性方面的影响;Lee等[13]报道了辐照处理对望子汁微生物、抗氧化活性及色泽在贮藏期间的影响;乔宇等[14]对锦橙汁辐照后相关品质(色度、pH值、VC含量及香气成分)进行了分析。对于果蔬汁这种不适于高温灭菌的食品,辐照杀菌是一种理想的方法。
实验采用60Co-γ射线辐照处理红心火龙果果浆,通过不同辐照剂量处理后在常温下进行贮藏实验,考察火龙果果浆中微生物、营养品质和微生物的变化,确定出适宜的辐照剂量,之后在不同温度下进行贮藏稳定性实验,最终确定出适宜温度,探索辐照保鲜的可行性,为火龙果产品辐照保鲜提供参考。
1 材料与方法
1.1 材料与试剂
红心火龙果由海南省东方市北纬十八度果业有限公司提供。
酵母浸膏 上海盛思生化科技有限公司;胰蛋白胨广东环凯微生物科技有限公司;乳糖 广东化学试剂厂;十二烷基硫酸钠 国药集团试剂有限公司;硫酸、磷酸氢二钾、磷酸二氢钾(均为分析纯) 西陇科学股份有限公司。
1.2 仪器与设备
G154DW压力蒸汽灭菌锅 致微(厦门)仪器有限公司;723PC可见分光光度计 上海奥谱勒仪器有限公司;DK-8D电热恒温水浴锅 金坛市科兴仪器厂;EL204电子天平 梅特勒-托利多仪器(上海)有限公司;SW-CJ-1F超净工作台 苏净集团苏州安泰空气技术有限公司;SHZ-D循环水式真空泵 巩义市予华仪器有限公司;MLR-351生化培养箱 上海一恒科学仪器有限公司;PHS-3D型酸度计 上海精密科学仪器有限公司;水浴恒温振荡器 上海龙跃仪器设备有限公司;GL-20G-II冷冻高速离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 红心火龙果果浆的制备
红心火龙果去皮后榨成果浆(含火龙果籽),果浆进行60 目过筛去籽后,每25 g样品用聚乙烯自封袋密封包装,包装50 份,用于微生物检测;另将每100 g样品用聚乙烯自封袋包装密封,包装50 份,用于理化和感官品质的检测。
1.3.2 辐照处理
由中核海南海原开发有限公司利用60Co-γ辐照源进行动态辐照,辐照源活度为5.27×105Bq,剂量率为682 Gy/圈,每圈为2.5 h;利用重铬酸银剂量计进行剂量跟踪,剂量测定结果与中国计量科学研究院的标准剂量进行对比。预辐照剂量为1、2、3、4、5 kGy,实测剂量为1.24、2.52、3.28、4.02、5.6 kGy,对照组为0 kGy,辐照后的样品在25 ℃下贮藏,每15 d进行各项指标的测定。
1.3.3 微生物的测定
菌落总数的检测依据GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[15],采用平板计数琼脂计数,样品平板在37 ℃下培养48 h计数。大肠菌群数量的检测依据GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠杆菌测定》[16],采用结晶紫中性红胆盐琼脂平板计数,接种后置于37 ℃下培养2 d后计数。霉菌数量的检测依据GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌及酵母菌测定》[17],采用孟加拉红培养基在25 ℃下培养5 d后计数。
1.3.4 火龙果果浆理化指标的测定
采用分光光度法测定花青素含量[18];采用吸光度法测定甜菜苷含量[19];采用苯酚-硫酸法测定总糖质量浓度[20];采用酸碱滴定法测定可滴定酸含量[21];采用酸度计测pH值;采用紫外分光光度法测定VC含量[22]。
1.3.5 感官评价
感官评价由11 位经过严格培训的评价员组成,主要用目测、嗅闻、口感和触摸的方式对火龙果果浆的色泽、滋味、组织状态进行打分,对总体可接受度进行综合性的感官评价,按3位数随机编号待评价的样品;感官评价采用5 分制,4~5 分表示品质很好,3 分表示可接受,0~3 分表示不可接受。
1.3.6 适宜贮藏温度的确定
结合微生物数量、理化品质、感官得分3 个指标筛选出适宜辐照剂量,之后分别在-4、10、25 ℃温度下进行实验,最终确定出适宜贮藏温度。
1.4 数据分析
2 结果与分析
2.1 辐照对火龙果果浆贮藏期间活菌数量的影响
2.1.1 辐照对火龙果果浆贮藏期间菌落总数的影响

表1 辐照及贮藏时间对火龙果果浆菌落总数的影响Table1 Effects of irradiation dose and storage time on total bacterial count of pitaya pulp lg(CFU/mL)
由表1可知,辐照剂量越大杀菌效果越明显。火龙果果浆初始细菌总数为3.29(lg(CFU/mL)),当辐照剂量不小于3 kGy、贮藏时间0 d时,贮藏初期细菌总数低于100 CFU/mL,符合免疫缺陷病人对菌落总数的要求(低于500 CFU/mL)[23]。辐照剂量大于3 kGy时,在贮藏的前15 d内均没有细菌检出,对照组和各辐照组细菌数量都随贮藏时间的延长逐渐增多。在不同贮藏时间细菌总数的数量级不同,其中对照组的菌落总数明显高于1~5 kGy各辐照组。
2.1.2 辐照对火龙果果浆贮藏期间大肠菌群数量的影响

表2 辐照及贮藏时间对火龙果果浆大肠菌群数量的影响Table2 Effects of irradiation dose and storage time on coliform count of pitaya pulp lg(CFU/mL)
由表2可知,随着辐照剂量的增大火龙果果浆中的大肠菌群数量整体下降。贮藏时间0 d时,火龙果果浆的大肠菌群数量随着辐照剂量的增大逐渐减小,当辐照剂量不小于2 kGy,无大肠菌群检出。随着贮藏时间的延长,各组别的大肠菌群数量均呈上升趋势,且对照组在贮藏期间大肠菌群数量大于辐照组。火龙果果浆辐照前初始大肠菌群数量为1.57(lg(CFU/mL)),当辐照剂量不小于2 kGy时,贮藏15 d内均未检出大肠菌群。由此可知,当辐照剂量不小于2 kGy可达到减菌的目的。
2.1.3 辐照对火龙果果浆贮藏期间霉菌数量的影响

表3 辐照及贮藏时间对火龙果果浆霉菌数量的影响Table3 Effects of irradiation dose and storage time on mold count of pitaya pulp lg(CFU/mL)
如表3所示,随着辐照剂量的增大,火龙果果浆中的霉菌数量明显减小,贮藏时间0 d时,霉菌数量随辐照剂量的增加而减小,且在辐照剂量不小于2 kGy时,火龙果果浆中的霉菌均未检出。随着贮藏时间的延长,对照组和1~5 kGy辐照处理组的霉菌数量均有所增加,在贮藏75 d时霉菌数量分别上升了3.71、2.79、2.62、2.50、2.02、1.03(lg(CFU/mL)),辐照处理组的果浆霉菌数量低于对照组,可知辐照处理后的火龙果果浆,在贮藏期间其中的微生物生长受到明显抑制。
2.2 辐照及贮藏时间对火龙果果浆理化品质的影响
2.2.1 辐照及贮藏时间对火龙果果浆花青素、甜菜苷含量的影响

图1 辐照对火龙果果浆贮藏过程中花青素(A)、甜菜苷(B)含量的影响Fig.1 Effects of irradiation dose and storage time on anthocyanin (A)and betanin (B) contents of pitaya pulp
由图1A可知,火龙果果浆花青素含量随辐照剂量的增大呈下降趋势。在贮藏45 d时,对照组和1~5 kGy辐照组花青素含量与辐照前相比分别下降了64.42%、58.01%、53.02%、53.73%、61.94%、64.87%;由此可知,在贮藏前期1~3 kGy辐照处理可延缓花青素含量下降,且剂量增高,下降幅度增大。在贮藏75 d时,对照组及1~5 kGy辐照处理组的果浆花青素含量分别下降至29.21、32.23、34.02、33.21、20.14、18.26 mg/g。由此可知,辐照剂量2~3 kGy可达到减菌效果的同时可延缓花青素含量下降。
由图1B可知,经不同剂量辐照的火龙果果浆甜菜苷含量下降速率不同。在整个贮藏期间,对照组和辐照组的果浆甜菜苷含量均呈下降趋势,在贮藏45 d时,对照组和1~5 kGy辐照处理组的甜菜苷含量分别为1.96、2.25、2.01、1.99、1.51、0.72 mg/100 g,可知1~3 kGy辐照处理组的果浆甜菜苷含量下降的速率小于对照组和高剂量辐照组。在贮藏75 d时,对照组及1~5 kGy辐照组的甜菜含量与辐照前相比分别下降了83.9%、78.5%、78.3%、79.1%、84.4%、94.2%;由此可知,1~3 kGy辐照处理火龙果果浆可延缓甜菜苷含量的下降。
2.2.2 辐照及贮藏时间对火龙果果浆总糖质量浓度、可滴定酸含量、pH值和VC含量的影响
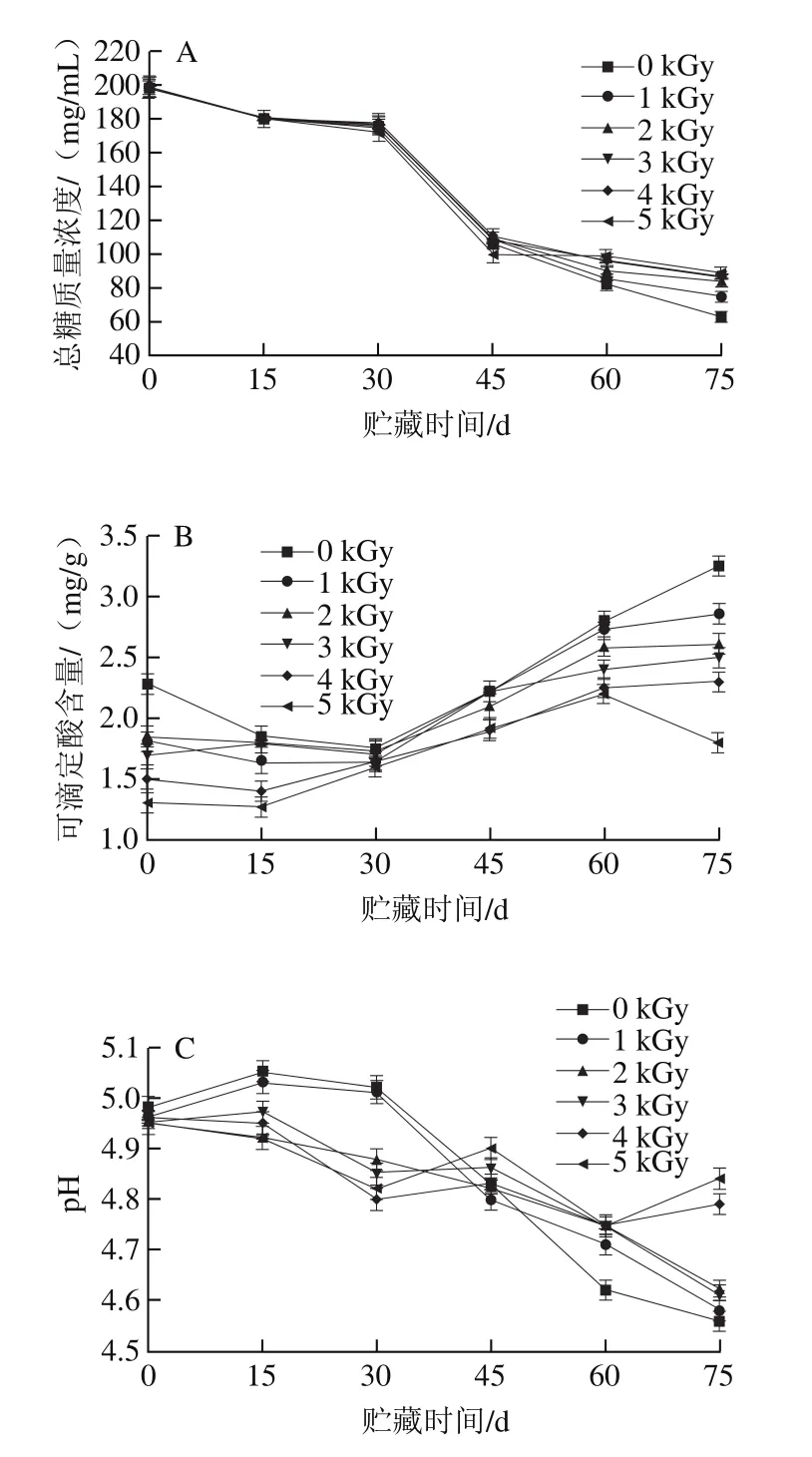
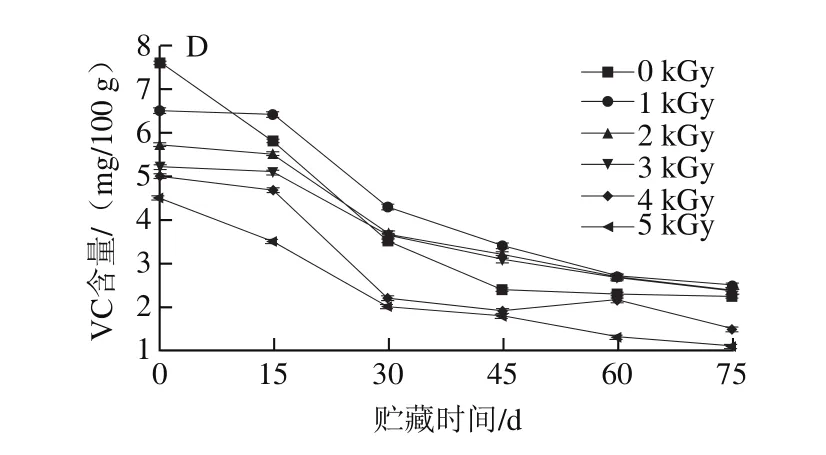
图2 辐照及贮藏时间对火龙果果浆总糖质量浓度(A)、可滴定酸含量(B)、pH值(C)和VC含量(D)的影响Fig.2 Effects of irradiation dose and storage time on total sugar content (A), titratable acid content (B), pH (C) and VC content (D) of pitaya pulp
赵菊鹏等[24]报道,番石榴果实经218 Gy以下的60Co-γ射线辐照后,果实的还原糖、蔗糖、总糖含量与未辐照组果实无明显差异。有研究报道辐照对水果中的碳水化合物结构影响较小,50 kGy内的剂量不会使糖类的分子结构发生变化,表现非常稳定[25]。由图2A可知,对照组和各辐照处理组的火龙果果浆总糖质量浓度变化无明显差异,实验结果与杨宗渠等[25]研究辐照对水果中总糖含量的结果一致;这可能是因为辐照不会引起糖类质量浓度的明显变化。随着贮藏时间的延长,对照组与各辐照剂量的总糖质量浓度均呈下降趋势,在贮藏45 d后,辐照组的总糖质量浓度下降速率低于对照组;可能是因为在贮藏后期果浆发酵,微生物将糖代谢成乙醇,在贮藏后期乙醇又进一步被代谢成乙酸,从而引起了在贮藏期间总糖含量整体下降,总酸含量增加[26]。
酸是影响果实风味的重要因素之一[27]。由图2B可知,在贮藏前15 d内,可滴定酸含量整体呈下降趋势,3 kGy剂量辐照组的可滴定酸含量略微增加。在贮藏30 d后,火龙果果浆的可滴定酸含量开始上升,并伴有酸败味的产生,且对照组变化更明显,辐照剂量不小于2 kGy时可起到延缓可滴定酸含量上升的作用;这与陆秋君[28]研究发现经辐照处理的桃果实在贮藏后期可滴定酸含量增加、Buedo等[29]研究的浓缩桃汁中可滴定酸含量在贮藏期间增加的趋势相同。这可能是火龙果果浆在贮藏后期由于微生物生长消耗糖类产酸,导致果浆酸败,从而引起果浆中的可滴定酸质量浓度增加。综上,辐照剂量不小于2 kGy处理可起到延缓果浆酸败作用。
由图2C可知,对照组和各剂量辐照处理组pH值变化规律无明显差异,说明辐照对pH值的影响较小。随着贮藏时间的延长,在30 d内对照组与各辐照剂量处理的果浆pH值均呈下降趋势;这可能是果浆在贮藏后期酸败,导致pH值下降。在贮藏45 d后,对照组pH值下降速率要高于各剂量辐照组。
VC是一种还原性物质,对果蔬起到保护作用,但采后的果实在贮藏过程中VC易分解损失,当其含量降低到一定程度时,会对细胞组织产生损害而加快衰老速率[30]。由图2D可知,经1~5 kGy辐照处理后,VC含量从7.57 mg/100 g分别下降到了6.50、5.61、5.25、5.01、4.50 mg/100 g。在整个贮藏期间,1~3 kGy剂量辐照组果浆中VC含量下降缓慢,当辐照剂量大于3 kGy时,VC含量下降速率明显增加。这可能是因为低剂量辐照组果浆中的糖类和有机酸对VC起了保护作用,高剂量辐照组下降幅度大可能是因为VC是对辐照较敏感的水溶性维生素[31],辐照后VC损失可能是因为在辐照过程中抗坏血酸转化为脱氢抗坏血酸[12]。因此,当辐照剂量为1~3 kGy时可有效保护果浆中的VC。
2.3 辐照及贮藏时间对火龙果果浆的感官评定

表4 不同辐照剂量及贮藏时间对火龙果果浆感官评分的影响Table4 Effects of irradiation dose and storage time on sensory acceptability of pitaya pulp
根据GB 14891.5—1997《辐照新鲜水果、蔬菜类卫生标准》[32]对新鲜果蔬感官的要求,经过辐照处理的新鲜水果应保持原有的色、香、味和形状且无腐烂异味。从表4可以看出,常温贮藏相同时间,随着辐照剂量的增大,果浆的总体感官得分下降。在贮藏60 d内,0~2 kGy辐照组有失色、水析现象,且伴有腐败异味的产生;3 kGy辐照组有轻微失色现象,但总体可接受;4~5 kGy辐照组的样品失色严重、伴有玻璃化现象;总体不可接受。
2.4 适宜辐照剂量的确定
微生物方面,当辐照剂量不小于3 kGy、贮藏时间0 d时,无大肠杆菌、霉菌检出,细菌检出量极少;可知辐照剂量不小于3kGy辐照处理可显著抑制果浆微生物的生长。营养品质方面,当辐照剂量为2~3 kGy时,可延缓花青素、甜菜苷、VC含量下降,并可延缓酸败,但对总糖质量浓度和pH值无明显影响。感官评价方面,当辐照剂量为3 kGy时,火龙果果浆在贮藏期内有轻微失色,无水析和玻璃化现象,总体可接受度高。因此,2~3 kGy为辐照有效剂量,3 kGy为最高工艺剂量,在达到抑菌的同时不影响感官和营养指标。故筛选出红心火龙果浆的适宜辐照剂量为3 kGy,之后研究经3 kGy辐照处理的果浆在不同贮藏温度下品质的变化。
2.5 3 kGy辐照处理的火龙果果浆在不同贮藏温度下品质的变化
2.5.1 3 kGy辐照样品在不同贮藏温度下花青素、甜菜苷含量的变化
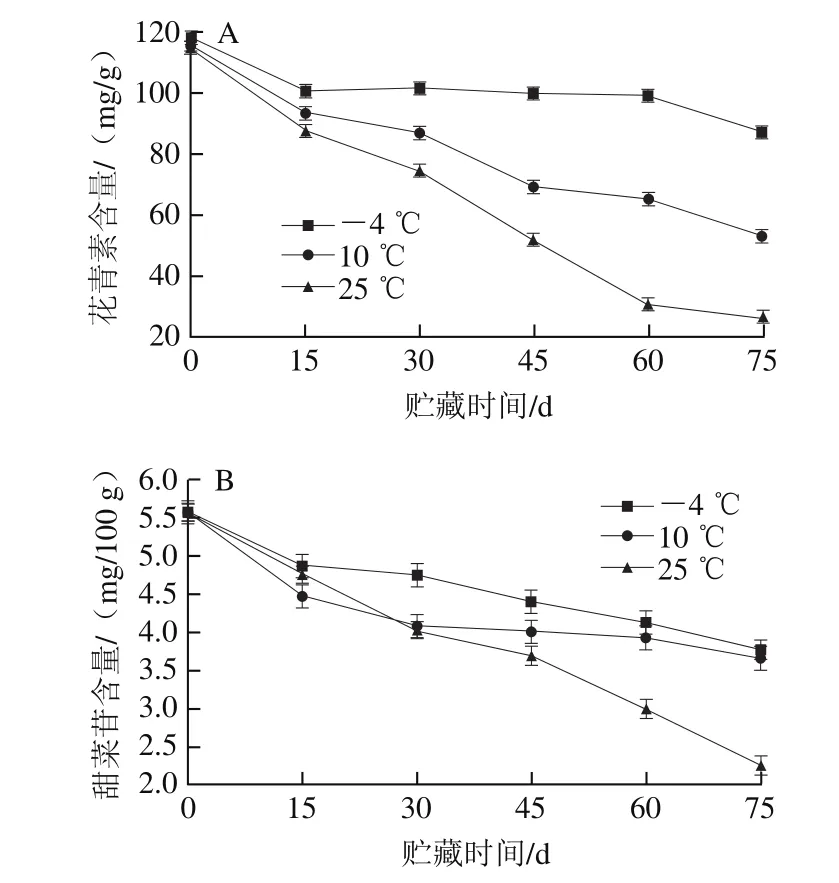
图3 3 kGy辐照的果浆在不同贮藏温度下花青素(A)、甜菜苷(B)含量的变化Fig.3 Changes in anthocyanin (A) and betanin (B) contents of pitaya pulp irradiated at 3 kGy at different storage temperatures
如图3A、B所示,在不同贮藏温度条件下,温度越高,花青素、甜菜苷含量下降得越快,在-4、10、25 ℃条件下贮藏75 d时,花青素含量分别下降了26.2%、54.9%、77.36%;甜菜苷含量分别下降了32.3%、34.3%、59.5%;由此可见,-4 ℃可延缓花青素和甜菜苷含量的下降。
2.5.2 3 kGy辐照样品在不同贮藏温度下总糖质量浓度、可滴定酸含量、pH值及VC含量的变化
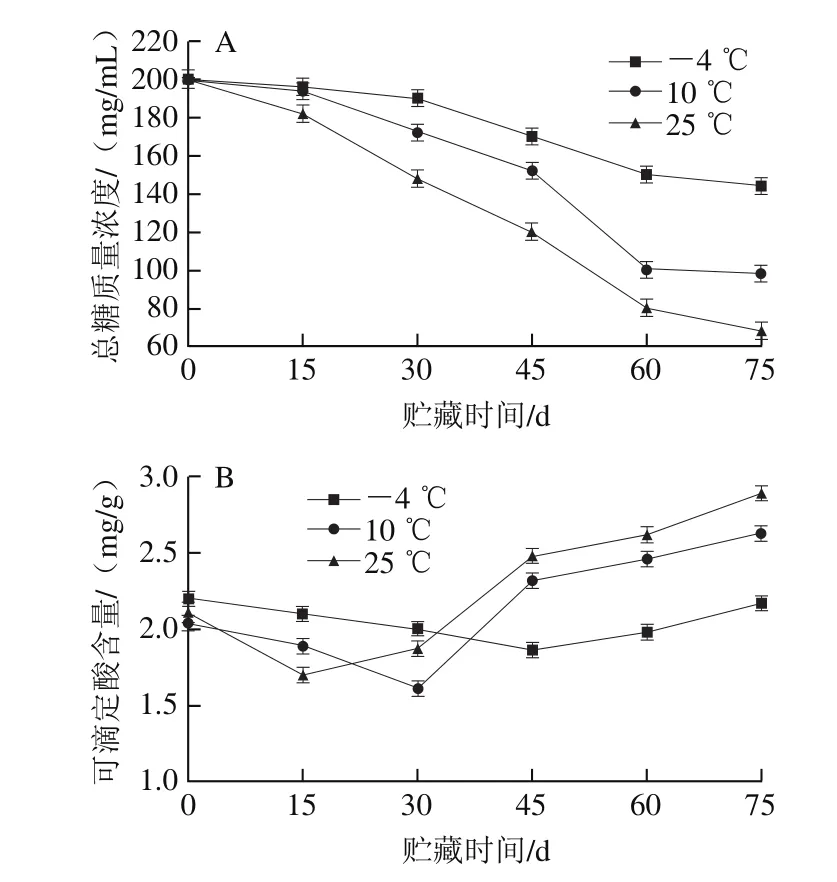
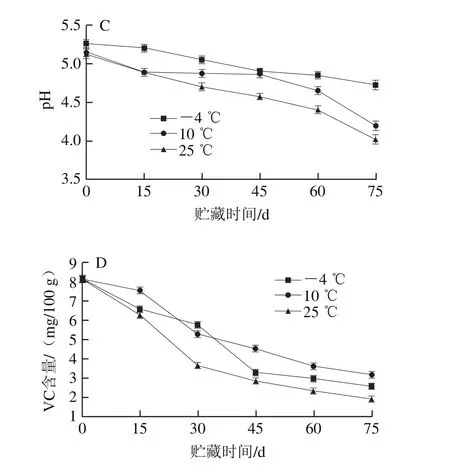
图4 3 kGy辐照样品在不同贮藏温度下总糖质量浓度(A)、可滴定酸含量(B)、pH值(C)及VC含量(D)的变化Fig.4 Changes in sugar content (A), titratable acid content (B), pH (C)and VC content (D) of pitaya pulp irradiated at 3 kGy at different storage temperatures
由图4A可知,在不同温度下贮藏,随着贮藏时间的延长,火龙果果浆总糖质量浓度呈下降趋势,在-4、10、25 ℃条件下贮藏75 d,总糖质量浓度分别下降了28.92%、52.44%、68.41%,低温条件下总糖质量浓度下降趋势较缓;这可能是因为在贮藏期间果浆中微生物生长需要消耗糖类,而低温抑制微生物生长[33]。
由图4B可知,火龙果果浆在整个贮藏过程中,在-4、10、25 ℃条件下可滴定酸含量的变化趋势相同,均呈先降低后增加趋势,但在25 ℃下火龙果果浆贮藏前期可滴定酸含量下降幅度及在贮藏后期上升的幅度均比低温下贮藏的果浆大。
由图4C可知,在不同贮藏温度下,火龙果果浆贮藏过程中pH值整体呈下降趋势,-4 ℃贮藏温度下果浆pH值下降速率相对缓慢,在-4、10、25 ℃条件下贮藏45 d,pH值分别下降到4.90、4.87、4.52;在贮藏75 d时,pH值分别降至4.71、4.25、4.01。这可能是因为贮藏后期可滴定酸含量的增加使得pH值降低。
由图4D可知,不同温度条件下的火龙果果浆在贮藏期间VC含量呈下降趋势,在-4、10、25 ℃ 条件下贮藏15 d时VC含量与0 d相比分别下降了19.2%、7.3%、22.8%;在第75天时,VC含量分别下降了68.2%、60.8%、76.4%;在-4 ℃贮藏的果浆VC含量下降速率比10 ℃条件下快,这可能是因为-4 ℃贮藏条件下,果浆的解冻过程一定程度上造成了VC的损失。
3 结 论
60Co-γ辐照对红心火龙果果浆的减菌效果显著,在减菌、营养品质和感官品质保持方面效果均较好的最低有效辐照剂量为3 kGy。用辐照剂量3 kGy处理后的火龙果果浆在-4、10、25 ℃条件下贮藏,发现-4 ℃贮藏75 d时总体仍可接受,满足实际生产需要。综合分析得出,3 kGy、-4 ℃分别为火龙果果浆的适宜60Co-γ辐照剂量和贮藏温度。

