四种添加剂对黄颡鱼生长、消化与抗氧化能力的影响
■杨雨生 王 洋 曾祥茜 杨 广 朱国霞 张宝龙 吴 旋 白东清*
(1.天津农学院水产学院 天津市水产生态及养殖重点实验室,天津 300384;2.天津渤海水产研究所,天津 300457;3.天津现代晨辉科技集团有限公司,天津 301800;4.天津市静海区畜牧水产业发展服务中心,天津 301600)
黄颡鱼(Pelteobagrus fulvidraco),俗称黄姑、黄腊丁、嘎鱼、嘎牙子等,属鲶目,鲿科,黄颡鱼属,是一种小型淡水经济鱼类[1]。10年前黄颡鱼主要在湖北、四川、辽宁、江苏和浙江等地开展大规模养殖[2],2012年江浙地区黄颡鱼养殖面积达6万亩,单产最高达到1 500 kg/667 m2[3]。目前黄颡鱼的养殖形势依旧乐观,2017年华中地区整体黄颡鱼鱼价稳定在18~22元/kg[4]。随着养殖规模、养殖密度的加大,极易导致黄颡鱼的抗应激能力和抗病力下降,严重影响黄颡鱼产业的健康可持续发展。目前通过在饲料中添加功能性添加剂来提高鱼类的抗应激能力以及免疫力的方式已得到了广泛的应用[5-6]。姜黄素是从姜科植物中提取的一种相对分子质量小的多酚类物质[7],具有抗炎、抗氧化、清除氧自由基、抗过氧化脂质损伤、抗衰老、抗纤维化、保护肝脏和肾脏等多种生理活性[8],在畜禽和水产领域上已见报道[9-10]。壳聚糖又名几丁质糖、脱乙酰基甲壳素,具有较好的抑菌活性,可生物降解,其代谢产物无毒,能够提高免疫力、调节脂肪代谢和降低血脂、胆固醇等多种生理功能[11]。VC具有提高免疫力、提高生长性能、增强抗压调节能力及抗氧化能力等多种生理作用[12-13],但是大部分鱼类不能自身合成,易感缺乏[14]。VB2又称核黄素,是动物必需的水溶性维生素之一,参与机体内氧化还原反应、细胞代谢等多种生理活动[15],可以显著提高团头鲂幼鱼的抗氧化能力,增强肠道消化功能[16]。姜黄素、壳聚糖、VC及VB2这四种添加剂都具有良好的应用效果,但四者配伍的效果未见报道,基于此本研究拟将这四种添加剂及其配伍添加到饲料中,探究其对黄颡鱼生长、消化及抗氧化能力的影响及作用机制,从而为黄颡鱼复合饲料添加剂的筛选提供新思路。
1 材料与方法
1.1 试验材料
1.1.1 试验饲料
VC(纯度≥90)购自山西莱克生物科技有限公司。姜黄素(纯度为10%)、壳聚糖(纯度为90%,脱乙酰度为92.1%)、VB2(纯度为92.7%)均购自徐州江大生物科技有限公司。黄颡鱼浮性膨化饲料购自天津市某饲料有限公司(主要原料:进口鱼粉、豆粕、面粉、磷酸二氢钙、氯化钠、多种维生素、多种微量元素等,其中VC含量为700 mg/kg、VB2含量为32 mg/kg)。
基础饲料为黄颡鱼浮性膨化饲料,营养成分含量为:粗蛋白质≥40.0%、粗脂肪≥6.0%、粗纤维≤5.0%、粗灰分≤15.0%、钙含量0.5%~2.5%、总磷含量0.6%~2.0%、氯化钠含量0.3%~3.0%、赖氨酸≥2.0%、水分≤12%。
在基础饲料基础上,将姜黄素、壳聚糖、VC、VB2四种添加剂按照表1比例溶于蒸馏水后,使用微雾喷壶喷洒于均匀摊开的成品黄颡鱼浮性膨化饲料表面,置于避光通风处阴干后装袋保存。每组饲料分别标记为T1、T2、T3、T4、T5、T6、T7组,其中T1组投喂基础饲料是对照组,T2组只添加姜黄素,T3组只添加壳聚糖,T4组添加VC和VB2,T5~T7组是四种添加剂的不同组合。
1.1.2 试验用鱼
试验用1 050尾健康黄颡鱼购自天津蓝科水产养殖有限公司,初始体重(56.67±10.75)g,初始体长(15.86±1.23)cm,暂养10 d。
1.2 试验方法
1.2.1 试验用鱼分组及饲养管理
1 050尾全雄黄颡鱼被随机分为7组,每组3个重复,每个重复50尾鱼,分别饲养在直径1.5 m,深度0.75 m的玻璃纤维缸中。每天早7:00,晚6:00各投饲一次,日投饲率为鱼体重的2%左右,并根据实际情况进行调整。试验用水采用池塘水与深井水按3∶7混合的形式,蓄水池水温维持在(19.64±2.99)℃左右,养殖水温保持(20.75±3.65)℃左右,pH值8.2,氨氮含量为(0.11±0.05)mg/l,亚硝酸盐含量维持在(0.15±0.06)mg/l,溶氧含量为(5.50±0.71)mg/l,24 h连续充气,3 d全换水一次,每天早间吸底一次。试验时间60 d。
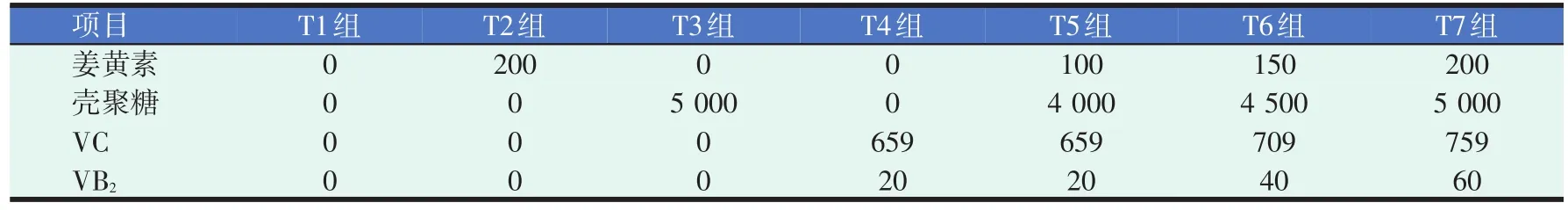
表1 试验饲料中四种添加剂添加水平(mg/kg)
1.2.2 取样处理
饲养60 d后,对试验鱼进行取样,先用一次性注射器进行尾静脉取血,以4 500 r/min离心15 min,取上清液制得血清样品,于-80℃冻存待测。然后进行鱼体解剖,取肝胰脏、脾脏、前肠、中肠、后肠,用预冷生理盐水冲洗干净后再用滤纸吸干称重,按照肝胰脏(g)(或脾脏)∶生理盐水=1∶9的比例,充分研磨,制成10%的匀浆液;前肠(g)(或中肠、后肠)∶生理盐水=1∶4的比例冰浴匀浆,制成25%的匀浆液,4℃条件下4 000 r/min离心20 min,取上清液于-80℃冻存待测。
1.2.3 指标测定方法
1.2.3.1 生长指标及饲料利用率的计算公式
分别于试验测定每尾鱼的体长、体重,计算增重率和特定增长率;根据投放尾数和死亡尾数,计算成活率;根据投饲量和体重的增加量计算饲料系数。
增重率(WG,%)=100×(Wt-W0)/W0
特定增长率(SGR,%/d)=100×(Wt-W0)/t
饲料系数(FCR)=Id/(Wt-W0)
蛋白质效率(PER,%)=100×(Wt-W0)/(Id×Pd)
存活率(SR,%)=100×(N2/N1)
式中:Wt——终末鱼体质量(g);
W0——初始鱼体质量(g);
L——试验末鱼体长(cm);
Id——摄食总量(g);
Pd——饲料中蛋白含量(%);
t——饲养时间(d);
N1——试验初鱼尾数;
N2——试验终鱼尾数。
1.2.3.2 消化酶指标
淀粉酶和脂肪酶活力的测定试剂盒均采购自南京建成生物工程研究所,具体测定方法参照所附说明书进行;蛋白酶活力的测定采用福林酚法,福林酚试剂购自北京索莱宝有限公司。
1.2.3.3 抗氧化能力指标
自南京建成生物工程研究所采购CAT、SOD、MDA、GSH、GSH-Px的测定试剂盒,具体的测定过程参照所附说明书进行。
1.3 数据处理
数据均以“平均值±标准差”表示,采用SPSS16.0单因素方差分析(one-way ANOVA)进行数据分析,若差异达到显著(P<0.05),则进行Duncan's法多重比较。
2 结果
2.1 四种添加剂对黄颡鱼生长指标和饲料利用率的影响(见表2)

表2 四种添加剂对黄颡鱼生长指标和饲料利用率的影响
从表2可以看出,四种添加剂可以不同程度地提高黄颡鱼的增重率、特定增长率、蛋白质效率,而四者配伍效果更好,其中T6组的增重率、特定增长率、蛋白质效率显著高于T1组和T2组(P<0.05);试验组饲料系数与对照组相比均有不同程度的降低,其中T6、T7组与对照组(T1组)相比,饲料系数显著降低(P<0.05),且T6组饲料系数最低;与对照组相比,试验组存活率也有不同程度地提高,其中配伍组(T5~T7组)的存活率显著提高(P<0.05),分别提高了11%、12.71%、12.71%。可见,从生长指标和饲料利用率角度来分析,本试验T6配伍组对促进黄颡鱼生长性能效果最好,其中添加姜黄素150 mg/kg、壳聚糖4 500 mg/kg、VC 709 mg/kg(总量 1 409 mg/kg)、VB240 mg/kg(总量72 mg/kg)。
2.2 四种添加剂对黄颡鱼肠道消化酶活力的影响
2.2.1 四种添加剂对黄颡鱼肠道脂肪酶活力的影响(见表3)
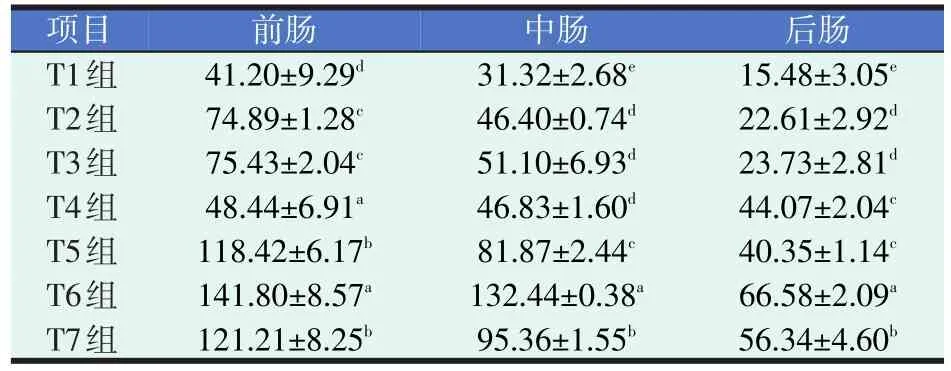
表3 四种添加剂对黄颡鱼肠道脂肪酶活力的影响(U/mg prot.)
由表3可知,黄颡鱼肠道脂肪酶活力顺序为前肠>中肠>后肠。各试验组肠道脂肪酶活力均有不同程度提高(P<0.05),其中配伍组T6组的前肠、中肠、后肠脂肪酶活力均为最高值,分别约是对照组T1组的3.44倍、4.23倍和4.30倍(P<0.05)。
2.2.2 四种添加剂对黄颡鱼肠道蛋白酶活力的影响(见表4)
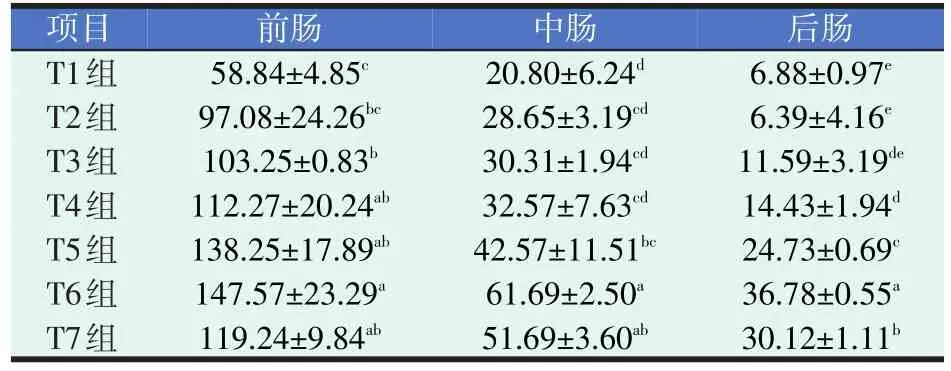
表4 四种添加剂对黄颡鱼肠道蛋白酶活力的影响(U/mg prot.)
由表4可知,黄颡鱼肠道蛋白酶活力顺序与脂肪酶相同。各试验组(T2组除外)前肠蛋白酶活力与对照组相比均显著提高(P<0.05),且T6组前肠蛋白酶活力最高,是对照组的2.51倍(P<0.05);配伍组(T5、T6、T7组)中的中肠蛋白酶活力与对照组相比显著升高(P<0.05),且最高活力出现在T6组;与对照组相比,T4组(VC、VB2合剂组)和配伍组中的后肠蛋白酶活力显著提高(P<0.05),且配伍组中T6组活力最高,是对照组的5.35倍。
2.2.3 四种添加剂对黄颡鱼肠道淀粉酶活力的影响(见表5)

表5 四种添加剂对黄颡鱼肠道淀粉酶活力的影响(U/mg prot.)
由表5可知,黄颡鱼肠道淀粉酶活力顺序为中肠>后肠>前肠。配伍组(T5、T6、T7组)前肠淀粉酶活力与对照组(T1组)相比均显著提升(P<0.05),其中T6组前肠淀粉酶活力最高;与对照组(T1组)相比配伍组中T7组中肠淀粉酶活力最高(P<0.05),T6组次之(P<0.05);除T4组外,与对照组(T1组)相比,各试验组后肠淀粉酶活力均有不同程度地提高(P<0.05),其中配伍组T6组后肠淀粉酶活力最高,是对照组(T1组)的5.02倍(P<0.05)。
2.3 四种添加剂对黄颡鱼体内抗氧化指标的影响
2.3.1 四种添加剂对黄颡鱼体内CAT活力的影响(见表6)

表6 四种添加剂对黄颡鱼体内CAT活力的影响
由表6可以看出,黄颡鱼体内肝胰脏的CAT活力要高于脾脏和血清。各试验组肝胰脏的CAT活力均有不同程度升高,其中T6组肝胰脏CAT活力最高,比T1组提高了约22.27%(P<0.05);T6组脾脏CAT活力最高,是对照组的1.27倍(P<0.05)。与对照组相比,T6组血清CAT活力显著升高(P<0.05),提高了约91.52%。2.3.2 四种添加剂对黄颡鱼体内SOD活力的影响(见表7)
由表7可知,黄颡鱼体内SOD活力大小为血清>肝胰脏>脾脏。肝胰脏SOD活力在T6组达到最高,是对照组的1.41倍(P<0.05),T5组次之(P<0.05);各试验组脾脏SOD活力均有不同程度升高(P<0.05),配伍组(T5、T6、T7组)提升较为明显,且T6组脾脏SOD活力最高,是对照组的1.70倍(P<0.05)。血清中SOD活力也在T6组达到最高,约是对照组的1.65倍(P<0.05)。

表7 四种添加剂对黄颡鱼体内SOD活力的影响
2.3.3 四种添加剂对黄颡鱼体内MDA含量的影响(见表8)
由表8可知,黄颡鱼体内MDA含量大小为血清>肝胰脏>脾脏。各试验组肝胰脏MDA含量与对照组相比均显著下降(P<0.05),其中T6组下降幅度最为明显,T5组次之,与对照组相比分别下降了80.45%、75.42%;脾脏和血清MDA含量最低值也均出现在T6组(P<0.05)。
2.3.4 四种添加剂对黄颡鱼体内GSH含量的影响(见表9)
由表9可知,黄颡鱼体内GSH含量大小为血清>肝胰脏>脾脏。除T2组外,各试验组肝胰脏GSH含量均有不同程度提高(P<0.05),其中配伍组T6组含量最高,约为对照组的1.87倍;各试验组脾脏GSH含量也均有显著升高(P<0.05),其中T6组脾脏GSH含量最高,T5组次之,分别为对照组的1.63倍和1.54倍;与对照组相比,T2、T5、T6、T7组血清GSH含量显著升高(P<0.05),分别提高了约61%、81%、137%、95%。

表8 四种添加剂对黄颡鱼体内MDA含量的影响

表9 四种添加剂对黄颡鱼体内GSH含量的影响
2.3.5 四种添加剂对黄颡鱼体内GSH-Px活力的影响(见表10)
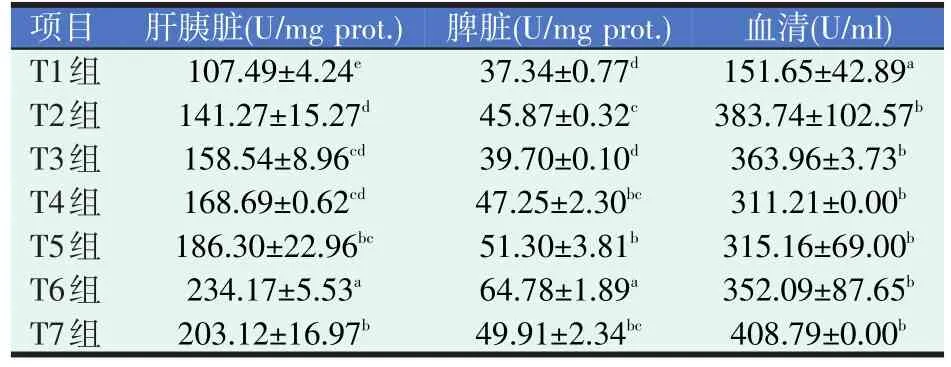
表10 四种添加剂对黄颡鱼体内GSH-Px活力的影响
由表10可知,黄颡鱼体内GSH-Px活力大小顺序为血清>肝胰脏>脾脏。各试验组肝胰脏GSH-Px活力均有不同程度升高(P<0.05),且GSH-Px活力最高值出现在T6组;除T3组外,各试验组脾脏的GSH-Px活力均有显著升高(P<0.05),且T6组脾脏GSH-Px活力最高(P<0.05)。各试验组血清GSH-Px活力与对照组相比均有不同程度提高(P<0.05),其中T7组活力最高。
3 讨论
3.1 四种添加剂对黄颡鱼生长性能和饲料利用率的影响
本试验发现,单独添加姜黄素对黄颡鱼生长性能相关指标有不同程度地提高,但却未见显著差异,这与孙全友等[17]、张宝彤等[18]、张滕闲等[10]结果类似,至于未出现显著性结果可能是由于所添加姜黄素的剂量、纯度、试验对象种类、养殖环境、投饲频率等不同所致。单独添加壳聚糖对黄颡鱼生长性能的影响与壳聚糖在畜禽和水产动物的应用研究结果类似[19-23],而未见显著影响可能是由于壳聚糖的纯度、脱乙酰度不同等因素所致。目前关于VC和VB2联用的应用研究相对较少,但其单独在畜禽和水产动物领域的应用已有大量报道[24-29]。本试验发现,VC和VB2联用可一定程度促进黄颡鱼生长性能,但效果不大,二者是否有协同功效还需深入研究。本试验中配伍组T6组在促进生长性能方面效果显著,可见四种添加剂联用在促生长方面具有一定的协同效果,分析其原因可能是由于姜黄素、壳聚糖和VC都能够提高鱼体的免疫力,使鱼体保持健康状态,同时壳聚糖有利于鱼类肠道有益菌群的增殖,而有益菌的相关代谢产物又可被鱼体利用;此外壳聚糖具有黏性,在饲料中添加后可在饲料表面形成一层保护膜,从而延长饲料的水化时间,减少饲料中营养成分的溶失,提高饲料的利用率。本试验也发现,高剂量组(T7组)的生长性能并未继续提升,这可能与四者配伍剂量有关,尤其是配伍中壳聚糖具有很强的吸附离子和蛋白质的能力,过量添加会影响鱼类对营养物质的吸收利用。
3.2 四种添加剂对黄颡鱼消化能力的影响
鱼类的消化酶对鱼类的生长发育有着极其重要的作用,鱼类消化酶活性的强弱也决定了鱼类对营养物质的吸收能力,进而影响其生长[30]。鱼类的消化酶主要有蛋白酶、淀粉酶和脂肪酶这三种[31]。已有大量研究表明,一些外源添加剂可以增强鱼类的消化酶活性,从而促进其消化能力。本试验发现姜黄素在促进肠道脂肪酶活力方面效果显著,对其它肠道消化酶活性虽无显著提高,但却有所提升,这与胡忠泽等[32]、张滕闲等[10]的研究结果类似。华雪铭等[33]的研究结果表明,适量的壳聚糖可以提高暗纹东方鲀的肠道淀粉酶活力,从而促进其消化能力,这与本试验结果基本一致,本试验发现,壳聚糖可显著提高中肠和后肠淀粉酶活性,对肠道脂肪酶活性和前肠蛋白酶活性也均有显著影响,这也显示出壳聚糖具有一定促进消化的作用。本试验中VC和VB2联用可显著提高黄颡鱼肠道脂肪酶活力以及前肠、后肠的蛋白酶活力,但对肠道淀粉酶活力影响并不显著,这与王菲等[16]、刘扬等[34]的研究结果类似。本试验中配伍组T6组的肠道消化酶活力最高,T7组次之,可见四种添加剂联用对促进黄颡鱼消化能力具有一定协同效果,且肠道消化酶活性并未随添加剂量的提升而升高。有研究表明,由于壳聚糖具有螯合作用,因此较高剂量的壳聚糖的摄入会影响机体对水溶性维生素的吸收[35],据此可推测本试验中配伍组T7组的壳聚糖剂量较高从而可能对VC和VB2的吸收利用产生影响,限制了其促消化的效果。
3.3 四种添加剂对黄颡鱼抗氧化能力的影响
检测动物SOD、CAT和GSH-Px等抗氧化酶及氧化产物的变化能比较准确地反映机体内的抗氧化系统的情况,以此来评价机体的抗氧化能力[36-41]。姜黄素结构骨架主要包括两个苯丙烯酰基,一个酚羟基和一个甲氧基各位于两个苯环上,丙烯基与一个β-双酮(烯醇式)结构相连,其抗氧化活性被认为与此结构密切关联,而作为一种天然抗氧化剂,其抗氧化活性可与花青素等相比,且经研究证明,姜黄素抗氧化能力优于常规的维生素[42-45]。本试验发现,姜黄素可以显著提高黄颡鱼体内的SOD、GSH-Px活性和GSH含量,降低体内MDA含量,这与胡忠泽等[46]、王雅慧等[47]、张滕闲等[10]的研究结果相互印证。壳聚糖具有多种生理功能,其抗氧化活性也被大量研究证明。有研究表明,壳聚糖体外对O2-的清除率可达到73.1%[48]。本试验发现,T3组(壳聚糖组)SOD、GSH-Px活力显著升高,MDA含量显著降低,这与部分壳聚糖的应用研究结果类似[49-51],可见壳聚糖对黄颡鱼的抗氧化能力具有一定的促进作用,而壳聚糖提高黄颡鱼的抗氧化能力可能是由于其具有螯合作用,从而促进了机体对金属离子的吸收,增强了抗氧化酶的合成性能。VC本身可在机体内直接清除自由基,同时VC可以补充机体内的GSH,维持其还原状态,并保持机体疏基酶的活性,从而在抗氧化系统中发挥重要作用[52-53]。VB2在生物体内主要以FAD和FMN这两种形式存在,而FAD作为多种抗氧化酶的辅酶在抗氧化系统中起着重要作用[54-55]。本试验结果表明,VC和VB2联用可以显著提高黄颡鱼体内部分组织的SOD、CAT、GSH-Px活力以及GSH含量,降低MDA含量,这与部分VC和VB2在畜禽以及水产动物中的报道一致[16,26,56-59]。有研究表明,VC 和 VB2联用可协同提高小鼠肝脏中GSH-Px的活力,促进小鼠的抗氧化能力[60],据此可初步推测VC和VB2联用对提高黄颡鱼的抗氧化能力也可能具有一定协同增效作用,具体作用机制还有待进一步探讨。本试验中,配伍组(T5、T6、T7组)抗氧化酶活力要高于其余试验组,配伍组T6组的抗氧化酶活力最高,可见四种添加剂在提高黄颡鱼体内抗氧化酶活力方面具有协同效果,而在提高抗氧化性能方面并未随着剂量的增大而持续增强,这可能是由于高剂量壳聚糖的螯合作用干扰了其他成分的吸收利用,从而降低了其他添加剂抗氧化活性的作用效果,其具体原因还有待进一步研究。
4 结论
① 添加姜黄素、壳聚糖、VC、VB2四种添加剂,养殖黄颡鱼60 d后,发现壳聚糖在促生长方面的效果优于姜黄素以及VC和VB2联用。而四者联用具有一定协同效果,且T6组效果最为显著。
②从消化能力分析四者配伍效果较好,且配伍组T6组效果最佳,这与促生长方面的效果基本一致,这一点也充分说明了消化能力的强弱与生长性能密切相关。
③从抗氧化方面分析,VC和VB2联用效果优于姜黄素和壳聚糖,配伍组T6组的效果最为显著。
综上所述,从生长、消化和抗氧化三个方面分析,本试验中配伍组T6组[饲料中添加姜黄素150 mg/kg,壳聚糖4 500 mg/kg,VC 709 mg/kg(总量1 409 mg/kg)、VB240 mg/kg(总量72 mg/kg)]效果最佳。

