50例初诊急性早幼粒细胞白血病患者6种PML/RARα异构体定量分析
韩兰秀, 林江, 钱军,*
(1. 江苏大学附属医院检验科, 江苏 镇江 212001; 2. 江苏大学附属人民医院中心实验室, 江苏 镇江 212002; 江苏大学附属人民医院血液科, 江苏 镇江 212002)
绝大多数急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)患者具有特征性t (15;17) (q22;q12-21),形成PML/RARα融合基因[1]。根据PML上断裂位点的不同,该融合基因分为3种亚型,即长型(bcr1)、短型(bcr3)和变异型(bcr2)。我们的前期研究发现,长型和变异型患者体内还存在着P4R3重排(PML第5、第6外显子缺失)、P46R3重排(PML第5外显子缺失)[2],与Pandolfi等[3]的报道一致。后者的研究还发现短型患者体内存在PML外显子2和RARα外显子3(P2R3)重排。然而有关这几种异构体临床意义的报道并不多,因此我们应用本课题组前期建立的6种特异性异构体实时定量PCR(RQ-PCR)检测方法[4],检测了50例初诊APL患者的cDNA标本,并结合临床特征,分析其临床意义。
1 对象与方法
1.1 病例来源
APL初诊患者50例,均来自我院血液内科的住院及门诊病例,男23例,女27例,中位年龄为16岁。诊断符合血液病诊断及疗效标准[5]。其中包括长型患者32例,变异型患者3例,短型患者15例。染色体核型分析均为t(15,17)。选取20例胸外科肿瘤患者肋骨中的骨髓标本作为正常对照。
1.2 骨髓单个核细胞分离、总RNA提取及逆转录
骨髓单个核细胞的分离使用Ficoll密度梯度离心法。按Trizol说明书一步法提取总RNA。紫外分光光度仪检测RNA浓度和纯度, RNA标本2.0 μg逆转录合成第一链cDNA。40 μL的逆转录体系中含200 U MMLV逆转录酶、dNTP、10 mmol/L DTT和25 U RNA酶抑制剂。37 ℃逆转录1 h、95 ℃灭活5 min得到cDNA标本。
1.3 RQ-PCR引物、探针的合成及阳性模板的制备
6种特异性异构体的上游引物由Primer 5.0软件设计。bcr1/2的上游引物在PML外显子5上,以便同时扩增长型和变异型异构体转录本[4]。用6种特异性异构体RQ-PCR体系扩增相应的APL患者cDNA标本,得到产物后进行纯化、转化、克隆,测序。确定测序结果正确后抽提质粒、比色定量、倍比稀释,建立108~101拷贝/μL阳性模板浓度梯度。
1.4 RQ-PCR检测患者cDNA标本中特异性异构体含量
RQ-PCR反应体系为25 μL,含2.5 μL缓冲液、4.0 mmol/L MgCl2、0.2 mmol/L dNTPs、0.5 μmol/L引物、0.2 μmol/L探针、1.0 U Taq酶、0.5 μL 50×ROX 和50 ng cDNA。RQ-PCR反应条件为95℃ 5 min,94 ℃ 15 s、60℃ 1 min,45个循环。将所建立的标准曲线、正常对照、空白对照和患者的cDNA标本一起进行检测。以ABL作为内参照,患者PML/RARα融合基因各种异构体的值都以相对量表示,即NPML/RARα= PML/RARα异构体的拷贝数/ABL拷贝数×100%。
1.5 统计学分析
采用SPSS 13.0软件对数据进行统计学处理。符合正态性分布或近似正态分布时,两组间均数比较选用t检验。不符合该条件时,用Mann-WhitneyU检验。相关性分析选用Spearman秩相关。P<0.05为差异有统计学意义。
2 结果
2.1 初诊APL患者不同PML/RARα融合基因异构体的表达水平及患者的临床特征
50例初诊APL患者不同类型PML/RARα融合基因异构体的相对表达量及相关临床参数见表1(由于bcr1和bcr2阳性患者均同时伴有P4R3和P46R3异构体,因此将之并为一组)。短型患者的白细胞总数显著高于长型和变异型患者(P=0.036),异构体bcr1/2的表达水平也明显高于bcr3。而两组患者的年龄、血红蛋白含量等参数均无明显差异(均P>0.05)。PML/RARα融合基因bcr1/2、bcr3、P4R3、P46R3及P2R3异构体的表达水平与患者的性别、年龄、外周血白细胞计数、血红蛋白含量、血小板计数及骨髓异常早幼粒细胞比例均无相关性(均P>0.05)。异构体bcr1/2、P4R3和P46R3在所有长型和变异型患者体内都有表达,但表达水平无统计学意义(P=0.364),特异性异构体bcr1/2及P4R3的表达含量均与P46R3相关(r=0.73,P<0.01;r=0.50,P=0.04),但bcr1/2与P4R3的表达水平无相关性(r=0.34,P=0.063)。15例短型患者P2R3的表达水平明显低于bcr3(P<0.01),但无相关性(r=0.11,P=0.714)。
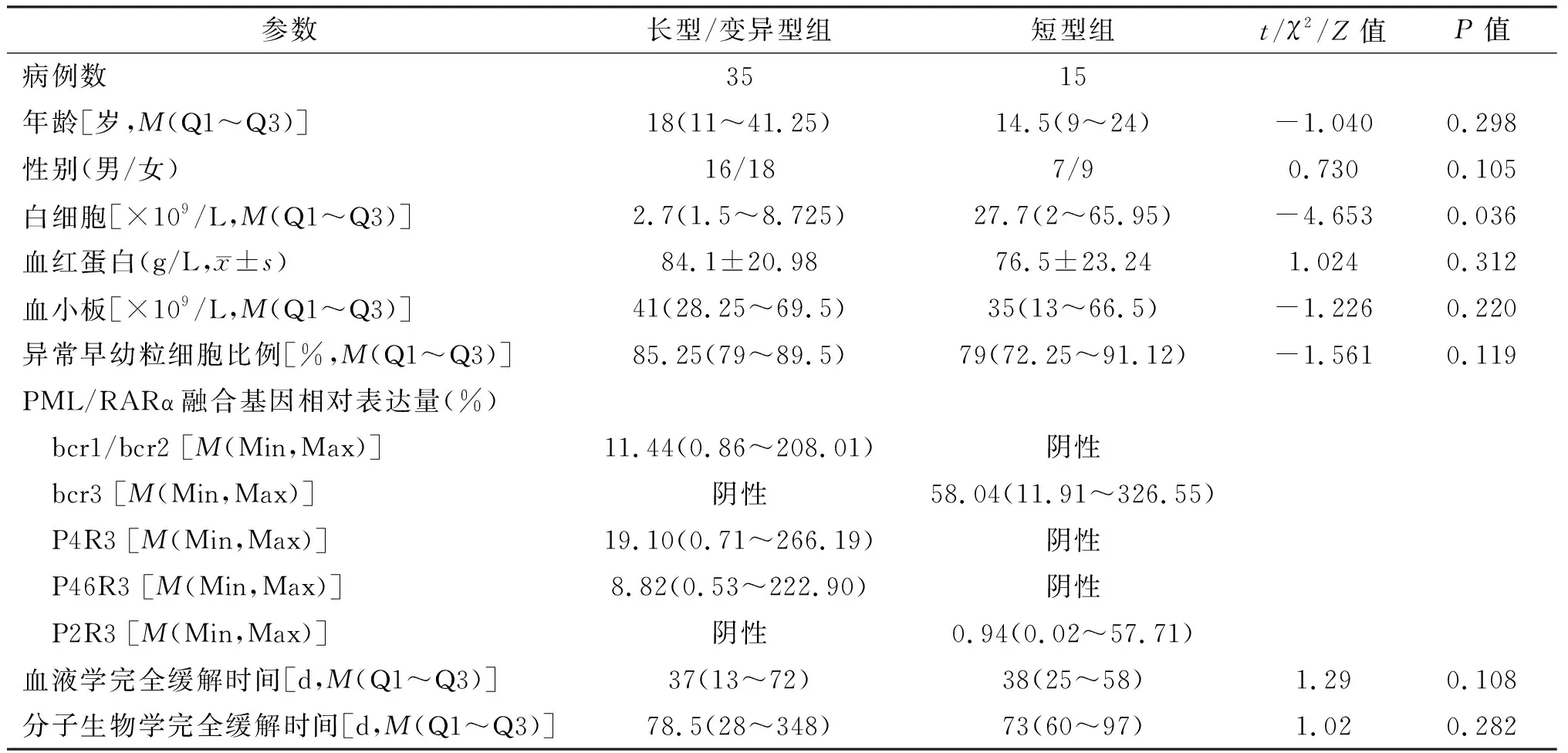
表1 初诊APL患者临床与分子生物学特性
2.2 危险度分级
根据文献[6]对50例患者进行危险度分级,其中高危组(白细胞数>10×109/L)16例,中危组(白细胞数≤10×109/L;血小板计数≤40×109/L)17例,低危组(白细胞数≤10×109/L;血小板计数>40×109/L)17例。3组患者间5种融合基因异构体的表达水平无统计学差异。见表2。
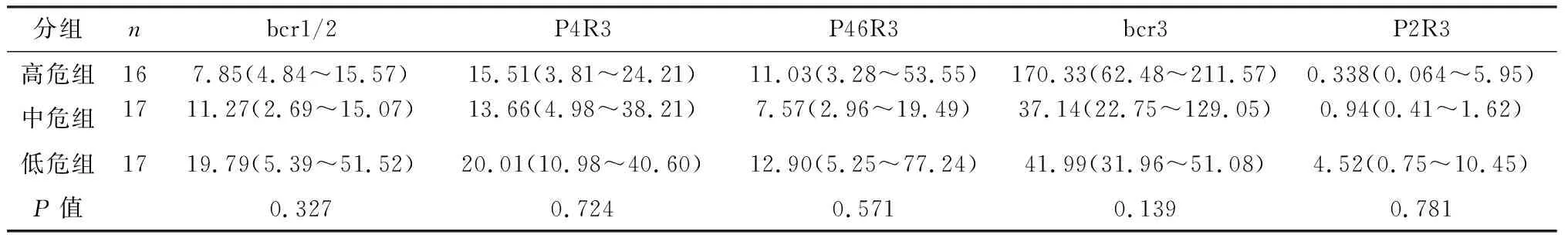
表2 不同危险度患者间异构体相对表达量的比较 M(Q1,Q3)
2.3 患者随访分析
对其中32例患者的随访结果显示,患者达到初次血液学完全缓解和分子生物学完全缓解时间与6种融合基因异构体含量无明显相关性(均P>0.05)。
3 讨论
由于全反式维甲酸、亚砷酸及传统的蒽环类药物为基础的化疗规范化应用,APL的预后得到极大改观。但仍有约10%患者会复发[7]。PML/RARα融合基因在APL患者的诊断和微小残留病的监测中至关重要,但大多研究仅针对bcr1、bcr2和bcr3这3种常见PML/RARα转录本[8-9],对已发现多年的P4R3、P46R3和P2R3等异构体研究甚少[3]。本研究结果显示,所有长型和变异型患者都同时表达bcr1/2、P4R3和P46R3,并且P46R3的表达水平均与bcr1/2和P4R3相关,但是相关意义仍不明确。另外我们发现几种异构体的表达水平与患者性别、年龄及外周血细胞计数等临床参数没有相关性,可能与样本量较少有关,需要进一步扩大样本病例数以明确这几种异构体的临床意义。
以往认为P4R3和P2R3异构体编码异常的截断PML蛋白[3],但我们认为这是长型和变异型PML/RARα融合基因的不同剪接异构体,即选择性拼接。选择性拼接是与转录和蛋白质多样化有关的重要调控机制,影响了大约90%的人类基因组[10]。异常的选择性拼接经常出现在癌症和白血病中,但确切机制仍未明确[11-12]。既然几种不同的选择性拼接可以共存,那么既往用实时定量PCR方法检测PML/RARα转录本的表达水平,所得结果是一种还是几种异构体的共同表达?这样是否会影响对真实结果的判断?本研究获得的是每个异构体的独立表达水平,对于研究各异构体在APL发病、治疗和预后等方面更加严谨。另外本研究还显示,P4R3和P2R3异构体表达水平较低,都含有提前出现的终止密码子(PTC),且符合PTC规则[13]。因此,这两种异构体可能触发了无义介导的mRNA降解,从而参与PML/RARα融合基因水平的调节。
综上所述,本研究初步分析了几种异构体在初诊APL患者中的临床意义。但几种异构体在APL发病、进展和复发中究竟发挥了怎样的作用,还需进一步的探讨。

