抑制中性粒细胞PD-L1表达对脓毒症T淋巴细胞功能的影响
于垚, 孙辉, 柳益书, 戚欣欣, 刘璐, 孙炳伟
(1. 江苏大学医学院, 江苏 镇江 212013; 2. 南京医科大学附属苏州医院烧伤与整形外科, 江苏 苏州 215008)
近期研究表明,中性粒细胞不但可以诱导机体的先天性免疫应答,还具有免疫抑制功能,引发免疫耐受,调节适应性免疫[1]。在脓毒症的发展中,部分感染状态下的中性粒细胞发挥免疫抑制功能,通过抑制T淋巴细胞的增殖和活化,减少淋巴细胞对病原菌的杀伤作用,导致脓毒症死亡率增高[2]。
程序性死亡配体1(programmed death-ligand 1,PD-L1)是一种免疫系统跨膜蛋白,在肿瘤细胞中高表达,并且与受体PD-1结合传递免疫抑制信号,使得淋巴细胞处于“免疫失能”状态,帮助肿瘤细胞逃逸[3-4]。在脓毒症中中性粒细胞如何发挥免疫抑制功能,其是否高表达PD-L1以及是否通过PD-L1途径调节获得性免疫尚不完全清楚。本研究通过建立模拟脓毒症的体外培养系统,旨在了解和阐明中性粒细胞如何利用PD-L1发挥免疫抑制,并探讨中性粒细胞和淋巴细胞相互作用的机制。
1 材料与方法
1.1 材料
脂多糖(lipopolysaccharide,LPS,美国Sigma公司),使用前用D-Hank平衡盐溶解(美国Gibco公司),母液浓度为1 mg/mL;高糖RPMI 1640培养基、小牛血清(美国Gibco公司);Ficoll-Paque PLUS(美国GE公司);红细胞裂解液,CD3e/CD28功能抗体,PE标记鼠抗人CD274抗体,PE标记鼠抗人CD69,PE-cy7标记鼠抗人CD71,APC标记鼠抗人CD3流式抗体,IFN-γ和IL-2 CBA试剂盒,细胞凋亡试剂盒均为美国BD公司产品;CellTraceTMCFSE 细胞增殖试剂盒,抗PD-L1功能阻断性单克隆抗体均为近岸科技有限公司产品;CO2培养箱(美国Thermo公司);FACS Canto Ⅱ流式细胞仪(美国BD公司);其他试剂如果无特殊说明均为美国Sigma公司产品。
1.2 人外周血中性粒细胞的分离
招募健康成年男性志愿者,采血前2周未服用任何药物;采集其空腹肘部静脉血8 mL,置于4个乙二胺四乙酸二钾抗凝管中,每管加入2 mL 3%葡聚糖沉降红细胞;20 min后取上清液,500×g于15 ℃离心5 min;用6 mL不含Ca2+、Mg2+的HBSS溶液重悬;将等体积的Ficoll-Paque PLUS溶液加入细胞悬液底部,500×g于15 ℃离心35 min;收集PBMC层用于淋巴细胞分离,弃去多余上清液;剩余细胞用红细胞裂解液孵育1 min后离心(500×g,15 ℃,5 min),即得中性粒细胞。
1.3 人外周血淋巴细胞的分离
将密度梯度离心后收集的PBMC层离心(500×g,15℃,5 min)后计数。每2×107/L个细胞加入100 μL 小鼠淋巴细胞阴选抗体包被孵育20 min;加入5 mL缓冲液,300×g,15 ℃,离心7 min;沉淀的细胞用与阴选抗体等体积的磁珠抗体重悬,孵育30 min后转入无菌流式管并置于BD IMagant磁力架,静置6~8 min使磁珠完全吸附。淋巴细胞为阴性分选,收集未被吸附的细胞,并用1 mL 缓冲液清洗3次;将收集的液体,500×g,15 ℃,离心5 min。
1.4 实验分组与细胞培养
提前12 h用CD3e功能抗体包被96孔U型培养板,用PBS稀释抗体至5 μg/mL,每孔60 μL;接种细胞前,将包板的液体吸出。将淋巴细胞分为4组,对照组,LPS组,中性粒细胞组,LPS+中性粒细胞组。对照组:在未干预过的培养基中培养;LPS组:用脂多糖(1 μg/mL)与细胞共培养模拟体外脓毒症状态模型;中性粒细胞组:按淋巴细胞 ∶中性粒细胞为1 ∶2比例共培养;LPS+中性粒细胞组:将LPS刺激过的中性粒细胞按淋巴细胞 ∶中性粒细胞为1 ∶2比例与淋巴细胞共培养。保持每孔细胞数量为(1~5)×105个,每孔细胞体系为200 μL,培养基中加入CD28功能抗体,浓度为2 μg/mL,放入孵箱中培养。
1.5 检测指标
1.5.1 淋巴细胞凋亡的检测 用PBS将96孔U型培养板中的细胞洗出,离心(300×g,15 ℃,7 min);弃上清液,加入100 μL PBS溶液重悬;加入4 μL Ly-6G荧光抗体避光室温孵育20 min;加入1 mL PBS重悬后离心(300×g,15 ℃,7 min),弃上清液。按照细胞凋亡检测试剂盒说明书进行操作,用流式细胞仪检测淋巴细胞凋亡率。每组至少重复3次。
1.5.2 淋巴细胞增殖的检测 操作同“1.5.1”,重悬Ly-6G荧光抗体染色后的细胞,按照细胞增殖检测试剂盒说明书进行操作,用流式细胞仪检测淋巴细胞的增殖代数。
1.5.3 淋巴细胞活力的检测 用PBS将板中的细胞洗出,离心(300×g,15 ℃,7 min),弃上清液;加入100 μL PBS溶液重悬沉淀;分别加入4 μL CD3、CD69、CD71,荧光抗体避光室温孵育20 min;加入1 mL PBS重悬后离心(300×g,15 ℃,7 min),弃上清液;用100 μL PBS重悬,用流式细胞仪检测淋巴细胞活化比例和平均荧光强度MFI。每组至少重复3次。
1.5.4 淋巴细胞炎症因子浓度的检测 按照CBA试剂盒操作说明书建立IFN-γ和IL-2的标准品曲线。吸取24、48 h 96孔板中的上清液,按照CBA操作说明书进行操作,测量各组样品中淋巴细胞IFN-γ和IL-2的浓度。每组至少重复3次。
1.5.5 中性粒细胞表面PD-L1表达的检测 将中性粒细胞分为对照组和LPS组,LPS组用1 μg/mL LPS 模拟体外脓毒症状态。将中性粒细胞按1×106/L密度接种至24孔板,培养12 h;用PBS将2组细胞从培养板中洗出,离心(300×g,15 ℃,7 min),弃上清液;加入100 μL PBS溶液重悬沉淀,加入4 μL CD274,荧光抗体避光室温孵育20 min;加入1 mL PBS重悬后离心(300×g,15 ℃,7 min),弃上清液;用100 μL PBS重悬沉淀,流式细胞仪检测表达CD274的中性粒细胞比例。每组至少重复3次。
1.5.6 PD-L1单抗对于淋巴细胞活性影响的检测 淋巴细胞按照干预的PD-L1单抗浓度的不同分为低、中、高浓度3组,在中性粒细胞与淋巴细胞的培养体系中分别加入5,10,15 μg/mL的PD-L1单抗,培养24 h;PBS洗涤,离心后(300×g,15 ℃,7 min) 弃上清液,加100 μL PBS溶液重悬沉淀,加入4 μL CD3荧光抗体避光室温孵育20 min;加入1 mL PBS重悬后离心(300×g,15 ℃,7 min),弃上清液;用100 μL PBS重悬沉淀。重悬后的细胞按照细胞凋亡检测试剂盒说明书进行操作,用流式细胞仪检测淋巴细胞凋亡率。每组实验至少重复3次。
1.6 统计学分析
2 结果
2.1 淋巴细胞凋亡比例变化
结果显示,4组淋巴细胞凋亡比例的差异有统计学意义(F=165.00,P<0.05)。与对照组相比,LPS组细胞凋亡无明显改变(t=0.63,P>0.05),中性粒细胞组(t=21.89,P<0.01)和中性粒细胞+LPS组(t=30.30,P<0.01) 细胞凋亡比例显著增高;与LPS组相比,中性粒细胞+LPS组细胞凋亡比例明显增加(t=34.2,P<0.01)。由此说明,中性粒细胞可促进淋巴细胞的凋亡,减弱细胞活性,在脂多糖刺激作用下抑制作用更为显著。见图1。
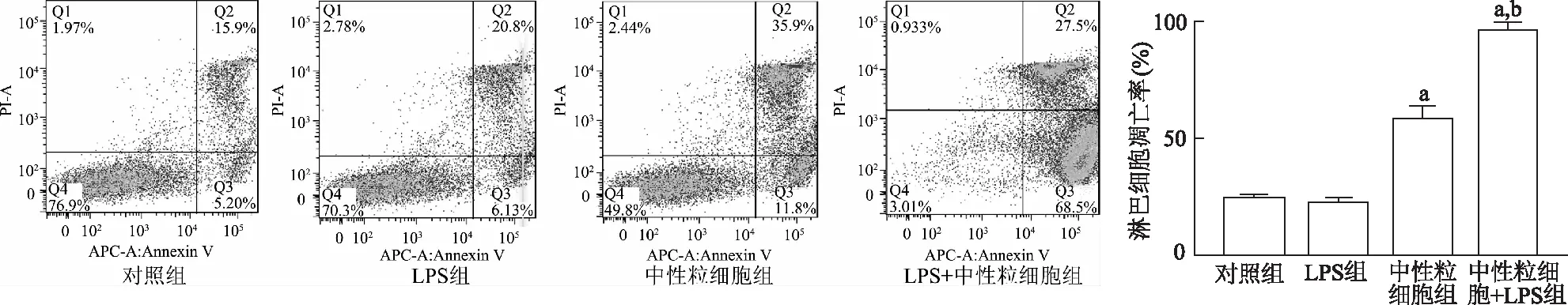
a:P<0.01,对照组比较;b:P<0.01,与LPS组比较
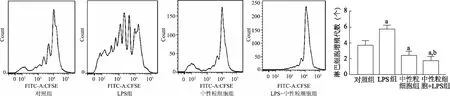
2.2 淋巴细胞增殖变化
4组淋巴细胞增殖的差异具有统计学意义(F=22.40,P<0.05)。与对照组相比,LPS组淋巴细胞增殖明显增加(t=4.24,P<0.05),中性粒细胞组和LPS+中性粒细胞组淋巴细胞增殖明显降低(t=2.83,P<0.05);与LPS组和中性粒细胞组相比,LPS+中性粒细胞组淋巴细胞增殖明显减少(t=8.48,4.23,P<0.05)。由此说明,中性粒细胞能够抑制淋巴细胞增殖,阻止感染状态下的淋巴细胞活化。见图2。
2.3 淋巴细胞活化指标变化
结果显示,各组淋巴细胞的阳性率差异均具有统计学意义(CD69阳性率F=54.16,CD69 MFIF=59.66,CD71阳性率F=50.66,CD71 MFIF=40.20;P均<0.05)。与对照组相比,LPS组淋巴细胞活化指标CD69、CD71阳性率和MFI明显升高;中性粒细胞组和LPS+中性粒细胞组CD69、CD71表达百分比明显降低,MFI明显下降(P均<0.05);与LPS组相比,LPS+中性粒细胞组淋巴细胞活化比例明显降低(P均<0.05)。由此说明,中性粒细胞能抑制淋巴细胞的活化,在脂多糖刺激作用下抑制作用更加明显。见图3。
a:P<0.05,对照组比较,b:P<0.05,与LPS组比较
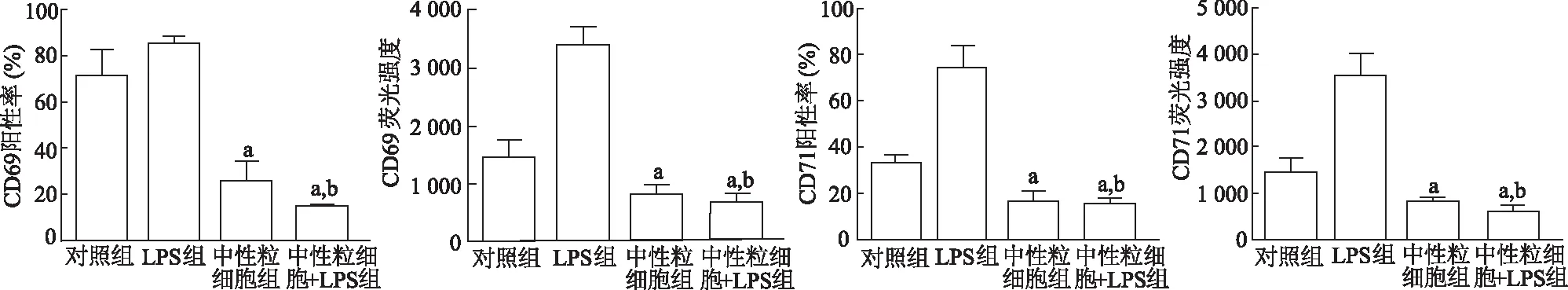
a:P<0.05,对照组比较;b:P<0.05,与LPS组比较
2.4 淋巴细胞炎症因子浓度的比较
结果显示,各组淋巴细胞炎症因子的浓度差异均具有统计学意义( IFN-γ:F24 h=284.70,F48 h=189.60;IL-2:F24 h=206.30,F48 h=296.10;P均<0.05)。与对照组相比,LPS组IFN-γ和IL-2明显增加,中性粒细胞组和LPS+中性粒细胞组淋巴细胞因子浓度则明显降低(P均<0.05),其中LPS+中性粒细胞组降低最明显。与LPS组相比,LPS+中性粒细胞组淋巴细胞细胞因子浓度明显减少(P均<0.05)。由此说明,脂多糖刺激状态下,中性粒细胞能明显抑制淋巴细胞炎症因子的释放。见图4。
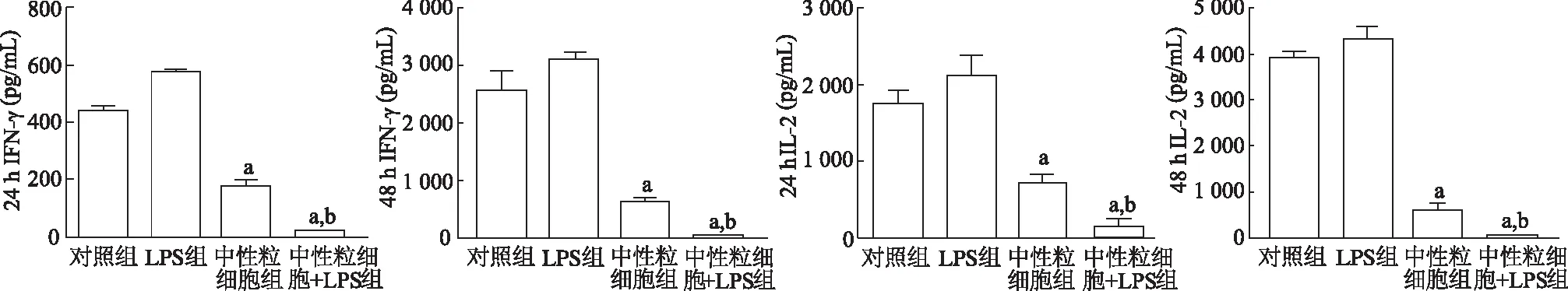
a:P<0.05,对照组比较;b:P<0.05,与LPS组比较
2.5 中性粒细胞表面PD-L1表达的比较
流式细胞术检测结果显示,LPS组中性粒细胞CD274(PD-L1)的表达明显高于对照组(t=7.674,P<0.05)。由此说明,在脂多糖刺激的感染状态下,中性粒细胞PD-L1表达升高。见图5。
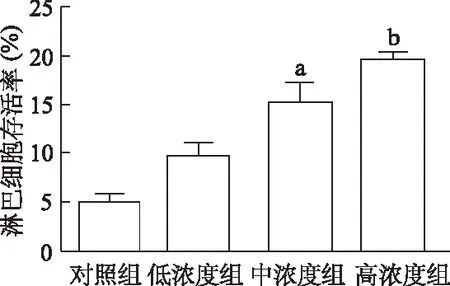
2.6 PD-L1单抗对淋巴细胞活性的恢复
与对照组相比,低浓度组淋巴细胞存活率差异无统计学意义(t=4.12,P>0.05),而中、高浓度组淋巴细胞存活率均明显升高(t=6.41,16.46,P<0.05或<0.01),呈一定的浓度依赖性。由此说明,阻断PD-L1能恢复部分由中性粒细胞导致的淋巴细胞活性抑制,PD-L1通路可能为中性粒细胞介导的免疫抑制的关键通路之一。见图6。
3 讨论
中性粒细胞是人体固有免疫中最重要的免疫细胞[5],生理情况下,未被激活的中性粒细胞在外周血中巡逻,一旦细菌侵入发生感染,第一时间趋化到感染部位,发挥抗菌抗感染作用[6]。中性粒细胞具有异质性、可塑性,长期生存的同时具有调节获得性免疫的作用[7-9]。已证实中性粒细胞与淋巴细胞间的相互作用包括免疫促进和免疫抑制,前者涉及直接和间接的抗原递呈,后者主要涉及抑制淋巴细胞激活和促进淋巴细胞凋亡两个方面[10],具体的机制尚未完全明确。本研究结果表明,在脓毒症严重感染状态下中性粒细胞对淋巴细胞有免疫抑制的作用,且发现阻断PD-L1通路可以逆转免疫抑制状态。

图5 流式细胞术检测各组中性粒细胞表面CD274的表达
a:P<0.05,b:P<0.01,与对照组比较
研究发现,先天性免疫和获得性免疫系统影响着脓毒症的发生、发展和转归[11]。脓毒症时的免疫抑制状态致病情不断恶化,目前研究[12]表明脓毒症的严重程度与免疫细胞息息相关。本研究发现,中性粒细胞有免疫抑制作用,成为一个可能的脓毒症时免疫调节的靶点,通过分析淋巴细胞凋亡、增殖、活化和细胞因子释放4个方面,发现脓毒症状态下的中性粒细胞能促进淋巴细胞凋亡,抑制淋巴细胞增殖、活化以及IFN-γ和IL-2两种炎症因子的释放,发挥免疫抑制作用,调节脓毒症时的免疫微环境,为脓毒症的免疫治疗提供可能。与其他调控脓毒症时淋巴细胞的研究相比,本研究调控中性粒细胞所引起的对免疫稳态的改变远小于对淋巴细胞的调控,因为中性粒细胞是一种终末细胞,受到调节的中性粒细胞在外周血中存活时间短,免疫治疗的不良反应少。
近来研究发现,PD-L1和PD-1的抗体可以提高脓毒症小鼠的生存率,阻断PD-L1和PD-1信号通路可增强淋巴细胞活性、减少淋巴细胞凋亡、促进淋巴细胞增殖,同时增加淋巴细胞因子的释放,使淋巴细胞的功能增强[3]。所以阻断PD-L1和PD-1信号通路可能成为改善脓毒症患者生存率的有效治疗措施。本研究发现,与淋巴细胞相互作用时,中性粒细胞发挥免疫抑制作用,且在脂多糖刺激后免疫抑制作用更加明显,与其他研究[13]相一致。此外还发现,脂多糖刺激后的中性粒细胞高表达PD-L1,且加入PD-L1单克隆抗体阻断部分PD-L1/PD-1信号通路可使淋巴细胞活性增加,并且效果随着单抗的浓度增加而增强,与他人研究结果相一致[14],因此中性粒细胞很有可能在脓毒症中通过 PD-L1/PD-1信号抑制淋巴细胞作用。本实验中尝试使用PD-L1的抗体来阻断该信号通路,发现淋巴细胞的活性得到恢复,凋亡数量减少,由此推断,脓毒症晚期导致的中性粒细胞耐受性因素中涉及PD-L1和PD-1的相互作用,但验证仅涉及凋亡这一方面且淋巴细胞活性仅得到部分恢复,完全恢复可能还涉及其他机制,此外关于淋巴细胞其他功能的恢复,还有待后续研究。
综上所述,脓毒症状态下中性粒细胞抑制淋巴细胞的活性,包括增加凋亡、抑制增殖、减少活化和抑制炎症因子释放;感染状态下的中性粒细胞高表达PD-L1分子,PD-L1抗体通过阻断PD-L1/PD-1信号通路,可以恢复中性粒细胞导致的淋巴细胞免疫抑制。

