2型糖尿病血糖波动水平与脂蛋白a和血尿酸的关系
邢春燕, 姚新明, 高家林, 翟清, 孟祥健
(皖南医学院弋矶山医院内分泌科, 安徽 芜湖 241001)
近年来,随着人口老龄化加剧,糖尿病发病率逐年上升,我国糖尿病的发病人数已位居全球首位[1];随之而来的是糖尿病肾病的发病率迅速增长,20%~40%的糖尿病患者发展为糖尿病肾病[2]。糖尿病肾病患者早期表现为肾脏增大、肾小球滤过功能亢进、微量蛋白尿,但不易被察觉,容易漏诊。随着病情进展,患者肾小球滤过率持续下降,最终发展成为尿毒症,甚至引起死亡。即使部分患者可通过控制血脂、血糖、血压,实现控制肾脏血供、减少微量蛋白尿或达到蛋白转阴目的,但对于进展至临床蛋白尿阶段的患者,病变逆转几无可能[3]。研究显示,慢性持续性高血糖和慢性波动性高血糖是导致糖尿病慢性血管并发症的主要因素;且波动性高血糖在慢性血管并发症发生和发展过程中的作用更大[3]。因此,严格控制血糖对糖尿病肾病防治及控制具有重要意义。糖尿病肾病患者的脂代谢异常,脂蛋白a显著升高,会进一步加重肾功能损害;血尿酸作为糖尿病肾病的独立危险因素,较白蛋白能更好地预测肾脏损害。因此,本研究应用动态血糖监测系统评估血糖波动,探讨血糖波动与脂蛋白a和血尿酸的关系,以期为糖尿病肾病的防治提供参考。
1 对象与方法
1.1 临床资料
选取2016年1月至2017年12月间在我院住院的2型糖尿病伴蛋白尿[尿微量白蛋白(U-mALB)≥25 mg/L]患者50例作为观察组,另选取U-mALB<25 mg/L的2型糖尿病患者50例作为对照组。排除标准:其他任何原因引起的蛋白尿;无发热、创伤、手术等应激情况;无急性心脑血管疾患、酮症酸中毒等。两组患者性别比例、年龄间差异均无统计学意义(均P>0.05)。见表1。
1.2 治疗方法
所有患者明确诊断后,依据《中国2型糖尿病防治指南(2013年版)》[4]中的方法控制血糖、血压和血脂。
1.3 血液生化指标检测
两组受试者禁食禁水12 h后,次日清晨采集前臂静脉血,室温下3 000 r/min 离心20 min,分离血清,保存于-70 ℃冰箱。采用全自动糖化分析仪检测糖化血红蛋白(HbA1c),采用日立7600全自动生化仪检测三酰甘油、总胆固醇、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、脂蛋白a、血尿酸及U-mALB。
1.4 动态血糖监测
分别于三餐前、三餐后2 h及晚睡前(22:00),采用罗氏快速血糖仪检测指尖微量血糖,根据全天7次血糖计算出血糖水平标准差(standard deviation of blood glucose, SDBG)、平均血糖波动幅度(mean amplitude of glucose excursion, MAGE)、最大血糖波动幅度(largest amplitude of glycemic excursions, LAGE)及平均餐后血糖波动幅度(mean postprandial blood glucose excursion, MPPGE)。SDBG:血糖测定值与平均血糖标准差;MAGE:三餐前后血糖波动幅度的均数;LAGE:最大和最小血糖之差;MPPGE:三餐后血糖与平均血糖差的均数。监测期间患者饮食情况与以往基本一致,降糖方案根据血糖情况调整。
1.5 统计学方法

2 结果
2.1 两组一般情况对比
两组平均病程、2hPG、三酰甘油、总胆固醇、HDL-C、LDL-C、血尿酸、脂蛋白a和U-mALB间的差异均有统计学意义(P<0.01)。两组患者的HbA1c均<9%,且无显著性差异(P>0.05)。见表1。
2.2 两组血糖波动参数对比
观察组MAGE、LAGE、SDBG、MPPGE均显著高于对照组,差异均有统计学意义(P<0.01)。见表2。
2.3 脂蛋白a、血尿酸与各参数相关性分析
Pearson相关分析显示,U-mALB与脂蛋白a、血尿酸均呈显著正相关(r分别为0.886,0.943,均P<0.05),总胆固醇、MAGE与脂蛋白a呈显著正相关(r分别为0.560,0.965,P均<0.05),SDBG和MAGE与血尿酸水平呈显著正相关(r分别为0.641,0.495,P均<0.05)。
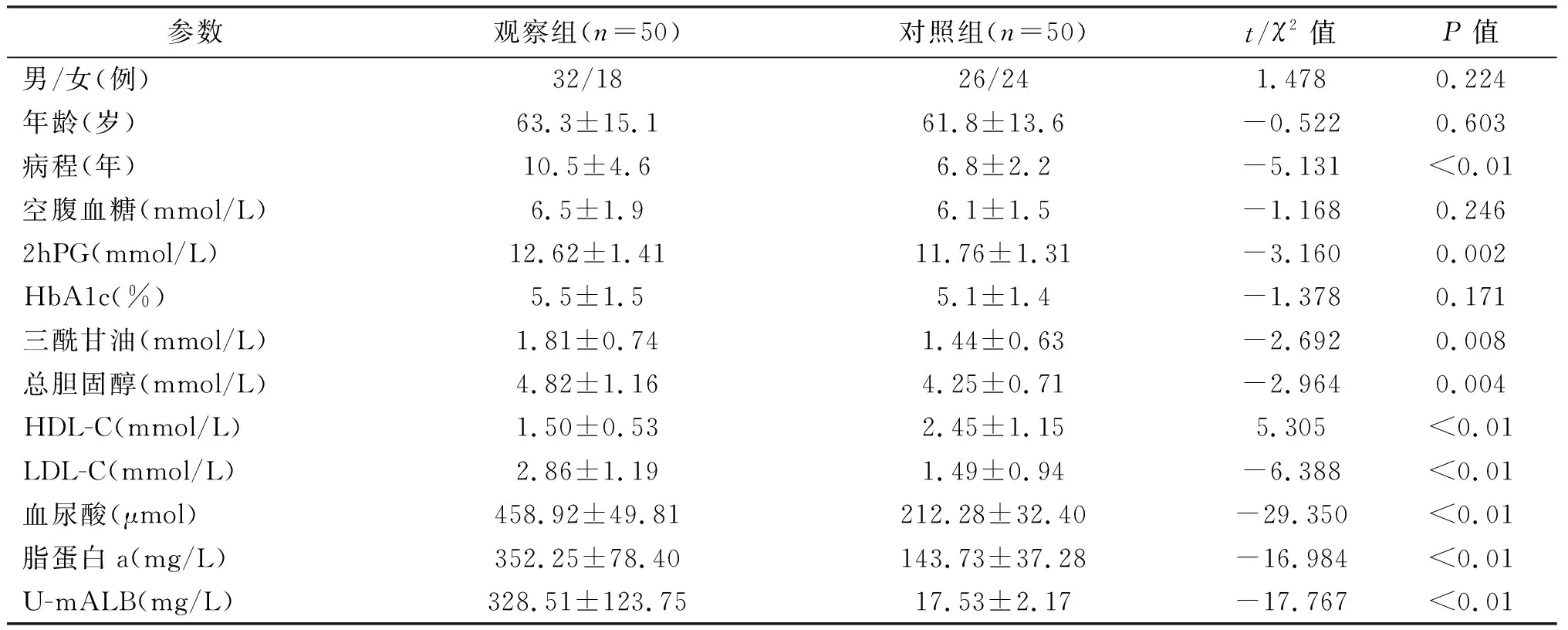
表1 两组一般情况对比

表2 两组血糖波动参数比较 mmol/L
2.4 多元逐步回归分析
以脂蛋白a为因变量,以平均病程、2h PG、三酰甘油、总胆固醇、HDL-C、LDL-C、U-mALB、MAGE、LAGE、SDBG、MPPGE为自变量进行多元逐步回归分析。结果显示,总胆固醇、MAGE与脂蛋白a独立相关(Y=-65.647×总胆固醇+36.648×MAGE)。见表3。
以血尿酸为因变量,以平均病程、2h PG、三酰甘油、总胆固醇、HDL-C、LDL-C、U-mALB、MAGE、LAGE、SDBG、MPPGE为自变量进行多元逐步回归分析。结果显示,SDBG和MAGE与血尿酸独立相关(Y=4.011×SDBG+3.421×MAGE)。见表4。
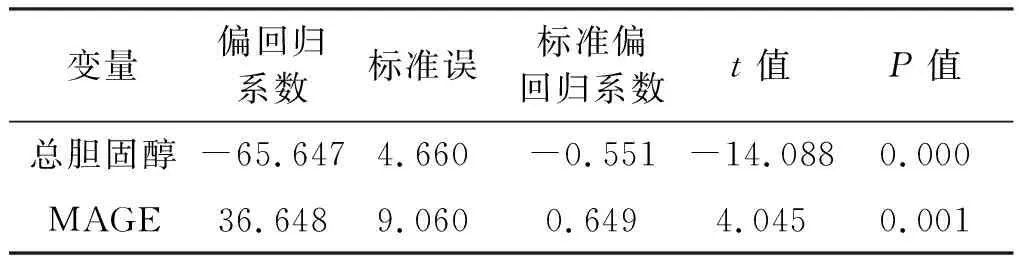
表3 影响脂蛋白a的各因素逐步回归分析结果

表4 影响血尿酸的各因素逐步回归分析结果
3 讨论
近年来研究发现,糖尿病患者即使血糖浓度相同,微血管并发症的风险也不相同[5]。HbA1c是公认的长期血糖控制的金标准,但并不能反映血糖波动幅度和频率[6]。HbA1c控制达标的2型糖尿病患者,血糖波动同样会导致糖尿病慢性并发症的发生[7],血糖波动越大,微血管病变的发生率越高且预后越差[8]。
本研究评估2型糖尿病患者血糖波动水平,结果显示糖尿病并发蛋白尿患者与单纯糖尿病患者平均病程、2 h PG、三酰甘油、总胆固醇、HDL-C、LDL-C、血尿酸、脂蛋白a和U-mALB的差异均有统计学意义;两组患者的HbA1c均<9%,且无显著性差异。2型糖尿病伴微蛋白尿患者MAGE、LAGE、SDBG、MPPGE均显著高于单纯糖尿病患者,提示蛋白尿患者胰岛细胞功能减退,血糖波动幅度增大,出现蛋白尿的概率增大。多元逐步回归分析显示,总胆固醇、MAGE与脂蛋白a独立相关,SDBG和MAGE与血尿酸独立相关;Pearson相关性分析结果显示,U-mALB与脂蛋白a、血尿酸均呈显著正相关,总胆固醇、MAGE与脂蛋白a呈显著正相关,SDBG和MAGE与血尿酸水平呈显著正相关。
蛋白质在长期高糖环境中会发生糖基化,特别是载脂蛋白。脂蛋白a是发生糖基化受体识别的主要蛋白。受糖基化的影响,脂蛋白a中央蛋白质会失去对卵磷脂胆固醇酰基转移酶的激活作用,脂蛋白a受体识别发生功能障碍,使低密度脂蛋白过多摄取,增加肝外胆固醇的返回难度,影响逆向转运,引起胆固醇代谢紊乱。
尿酸是嘌呤代谢的终产物,有研究认为血尿酸较白蛋白能更好地预测肾脏损害。 Zoppini等[9]研究发现血尿酸浓度与糖尿病微血管病变有关,可作为糖尿病肾病的独立危险因素。2型糖尿病患者发生胰岛素抵抗,引起继发性高胰岛素血症,一方面影响近端肾小管排钠,另一方面影响尿酸的排泄[10];而尿酸浓度升高可增加血小板凝聚,诱发内皮功能损害,刺激白细胞产生细胞因子,加重肾小管损害及增生[11];而且也可形成尿酸结石沉积于肾脏,增加微血管血栓危险性。糖尿病肾病患者多伴有不同程度的脂代谢异常,易引起肾小球基底膜中磷酸脂成分发生葡萄糖胺糖化,增强肾小球的超滤能力,使尿蛋白的排出增加,血清中白蛋白显著下降,诱发肝组织合成更多脂蛋白a,使血清中脂蛋白a浓度显著增加;增高的脂蛋白a一方面可与血尿酸结合引起血管炎症,另一方面脂类物质可诱发肾小球硬化,进一步损伤肾功能[12]。因此,2型糖尿病肾病患者应注意监控尿酸和脂蛋白a浓度,积极进行防治,以防进一步损害肾功能。
高尿酸和高血脂的糖尿病患者更易患糖尿病肾病,随着血糖、血压、血脂等水平的增高及体重增加,2型糖尿病并发症的发生风险、发展速度以及危害程度也会显著增加。因此,针对2型糖尿病患者应采用科学、合理、基于循证医学的综合性治疗策略,早期评估血糖波动幅度,尽早实施包括降糖、降压、调脂、抗凝等措施的个体化治疗方案,必要时可采用药物等辅助治疗。HbAlc一般情况控制在7%以下,尽可能接近正常水平(6%),但也应避免因过度放宽控制标准而出现急性高血糖等相关并发症。降低患者脂蛋白a和血尿酸水平,减少对肾脏损害,有效控制血糖波动,才是糖尿病肾病防治的关键。

