不同糖代谢状态下体重指数与胰岛β细胞功能的相关性
邹彩艳, 刘学奎, 梁军, 吴庆强, 司冬芹, 窦连军, 王犇, 金霄
(1. 徐州市中心医院内分泌科, 江苏 徐州 221009; 2. 徐州医科大学临床学院, 江苏 徐州 221004)
研究表明,胰岛素抵抗与胰岛素分泌缺陷是糖尿病发生的主要病理生理机制[1],而胰岛β细胞功能状况在其中有着至关重要的作用。研究发现,不同糖代谢状态下,胰岛β细胞功能状况存在差异,这种差异的产生机制目前尚不明了[2]。体重指数(BMI)作为衡量人体肥胖程度的指标与糖尿病密切相关[3],流行病学调查显示,随着BMI的增高,糖尿病患病率呈增高的趋势[4],这表明BMI在糖尿病的发展过程中有着重要的作用,这种作用机制可能影响了胰岛β细胞功能状况。有研究显示[5],肥胖糖耐量异常患者存在较为明显的内脏脂肪蓄积、脂代谢紊乱、胰岛素抵抗等症状,肥胖组胰岛素水平明显高于糖耐量异常体重正常组,HOMA稳态模型胰岛素抵抗指数(Homeostasis Model Assessment-Insulin Resistance index,HOMA-IR)明显高于糖耐量正常组。BMI与肥胖患者胰岛素抵抗关系密切,但不同糖代谢状态下尤其是糖尿病前期人群中BMI水平与胰岛素抵抗、胰岛素分泌缺陷之间关系尚不完全清楚。本研究探讨不同糖代谢状况下BMI与胰岛β细胞功能状况,为糖尿病的预防和治疗提供理论依据。
1 对象与方法
1.1 对象
选择2013年于徐州市中心医院常规体检的江苏徐州地区人群为研究对象,所有的检测指标由徐州市中心医院完成。研究对象年龄20~88岁,平均年龄(50.1±11.5)岁。共包括2 298例体检者,剔除肿瘤、严重心肺肾功能不全者以及资料不全者,共2 082例体检者纳入研究。该研究经徐州市中心医院伦理委员会批准。
1.2 方法
1.2.1 人体测量学 体检表格统一设计,由培训合格的医师进行询问,并记录受检者一般情况、性别、年龄、既往史等。受检者脱鞋,单衣测量体重、身高;受检者取站位,双脚分开25~30 cm,使体重均匀分配,测量腰围和腰臀比。各指标测量3次取平均值。受检者静坐5 min后用汞柱式标准袖带血压计测量右上臂收缩压及舒张压,手臂与心脏在同一水平,间隔30 s测量3次,取其平均值。
1.2.2 75 g OGTT+胰岛素释放试验 受检者晚餐后禁食10 h以上,次日清晨空腹采肘静脉血,并行75 g OGTT+胰岛素释放试验,采用酶法在日立7600全自动生化分析仪上测定空腹血糖(FPG)、血清尿酸及服糖后 2 h血糖(2hPG)等生化指标,化学发光法测定血清空腹胰岛素和服糖后2 h胰岛素。
参照文献[6]计算HOMA稳态模型, HOMA-IR=空腹血糖×空腹胰岛素/22.5;胰岛β细胞功能(HOMA-β)=20×空腹胰岛素/(空腹血糖-3.5);胰岛素敏感指数(HOMA-ISI)=1/(空腹血糖×空腹胰岛素)。
1.2.3 分组 不同糖代谢人群的划分,正常糖代谢组:空腹血糖<6.1 mmol/L且2hPG<7.8 mmol/L;糖代谢异常组:空腹血糖6.1~7.0 mmol/L和(或)2hPG 7.8~11.1 mmol/L;糖尿病组:空腹血糖≥7.0 mmol/L和(或)2hPG≥11.1 mmol/L[7]。
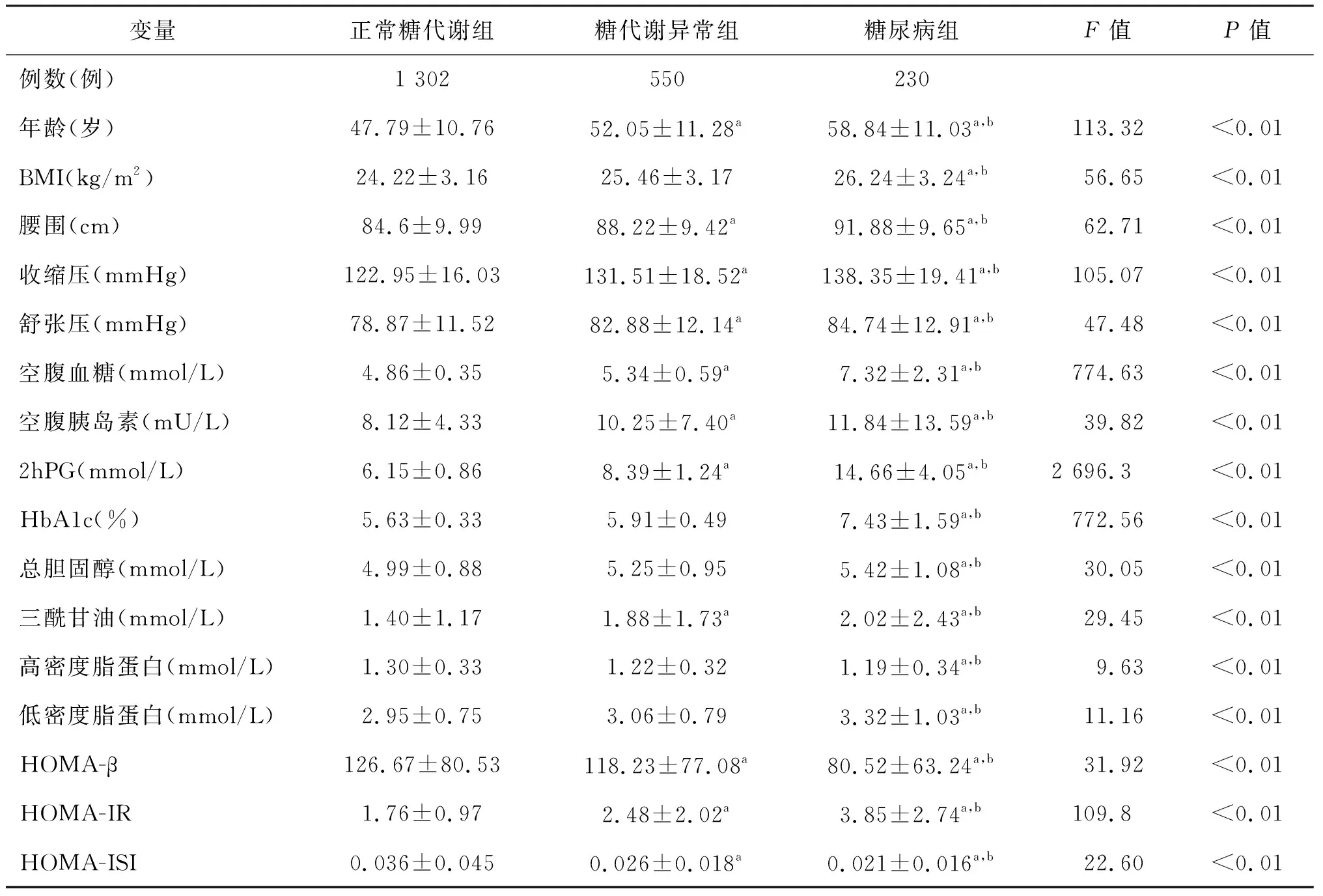
按照BMI的水平分为3组,正常组:18.0(kg/m2) 不同糖代谢人群的各指标间存在差异,糖尿病组患者的年龄、BMI、腰围、收缩压、舒张压、空腹血糖、空腹胰岛素、2hPG、HbA1c、三酰甘油、总胆固醇、低密度脂蛋白及HOMA-IR均明显高于正常糖代谢组和糖代谢异常组,差异有统计学意义(P<0.05)。而糖尿病组的高密度脂蛋白、HOMA-β及HOMA-ISI明显低于正常糖代谢组和糖代谢异常组,差异亦有统计学意义(P<0.05)。见表1。 表1 不同糖代谢人群的一般状况 a:P<0.05,与正常糖代谢组比较;b:P<0.05,与糖代谢异常组比较 校正性别、年龄、血压、血脂等代谢因素后,随着BMI 的增大HOMA-β和HOMA-IR也随之增大(P<0.01),但HOMA-ISI逐渐降低(P<0.01),趋势均有统计学意义。见表2。 表2 不同BMI人群胰岛细胞的功能 校正性别、年龄、血压、血脂等代谢因素后,在正常糖代谢组和糖代谢异常组中,HOMA-β和HOMA-IR均随着BMI 的增大而增大(P<0.01),HOMA-ISI随着BMI 的增大而降低(P<0.01);而在糖尿病人群中,HOMA-ISI随着BMI 的增大而降低(P<0.01),HOMA-β和HOMA-IR随BMI的变化趋势无统计学意义(P>0.05)。见表3。 表3 不同糖代谢人群BMI与胰岛细胞功能的关系 胰岛β细胞具有分泌胰岛素功能,而胰岛素是调节血糖浓度、促进合成代谢、调节细胞分化和生长发育的重要激素,体内胰岛素的绝对或相对不足,将导致糖尿病的发生发展[7]。因此,评估胰岛β细胞功能对糖尿病的分型、诊断和治疗有重要的临床意义。目前,用于人群大规模调查胰岛β细胞分泌功能及胰岛素敏感性的公式主要是稳态模型,包括HOMA-β和HOMA-ISI、HOMA-IR[8]。 本研究中,不同糖代谢水平的人群HOMA-IR、HOMA-β和HOMA-ISI存在统计学差异,提示随着糖代谢异常的出现,胰岛β细胞功能发生了变化,这种变化也间接反映了糖尿病发生发展的过程。研究发现[9],在糖耐量减低的人群中胰岛素抵抗已经出现,还伴随有胰岛素敏感性降低,这与本研究中糖代谢异常人群HOMA-IR高于糖代谢正常人群,而HOMA-ISI低于糖代谢正常人群的数据是一致的。同时朱柏乐[10]发现糖代谢异常人群在空腹状态下已经出现β细胞分泌受损,这与本研究结果一致,HOMA-β在正常糖代谢的人群中最高,糖代谢异常者次之,糖尿病患者最低。 流行病学调查显示[11],肥胖和2型糖尿病相伴流行,提示肥胖在糖尿病的发病过程中有着重要的作用。研究发现,肥胖虽多伴有胰岛素抵抗,但是大部分肥胖患者始终保持着正常的血糖水平,究其原因主要在于胰岛β细胞数量和胰岛素分泌的代偿性增加[12],这与我们研究结果一致。在西方国家,60%~90%糖尿病患者发病与肥胖密切相关[13]。BMI是目前最常用的肥胖程度评价指标,其与2型糖尿病的发生风险呈显著正相关。刘峰等[14]的一项研究表明,BMI、腰臀比和糖尿病患病率有着密切的关系,对糖尿病发病有一定的预测功能。安雅莉等[12]对不同BMI水平新诊断2型糖尿病患者胰岛素分泌和胰岛素抵抗状况调查发现: ① 在血糖水平相似的各组中,肥胖亚组的胰岛素敏感性更差,但是胰岛素分泌能力都优于相应的非肥胖亚组。② 纠正高糖毒性后肥胖者胰岛素分泌功能改善显著,而非肥胖者的胰岛素敏感性改善更佳。 本研究共纳入2 298例体检者,剔除肿瘤、严重心肺肾功能不全者以及资料不全者,共2 082例体检者作为研究对象,统计学分析发现,在BMI≥28 kg/m2的人群中,HOMA-β高于BMI较低的两组人群。进一步统计分析发现,在正常糖代谢组和糖代谢异常组中,HOMA-β和HOMA-IR均随着BMI 的增大而增大,HOMA-ISI随着BMI 的增大而降低;在糖尿病组中,HOMA-ISI随着BMI 的增大而降低,而HOMA-β和HOMA-IR随BMI的变化趋势无统计学意义。换言之,糖耐量异常组随着BMI的增加,胰岛素抵抗加重,胰岛素敏感性降低,同时胰岛β细胞出现代偿性分泌。但胰岛β细胞的这种代偿性分泌在糖尿病的人群中并不明显。其原因可能是 ① 糖尿病患者的胰岛β细胞受损严重,已不能进行代偿性分泌增加。研究显示,2型糖尿病患者同时存在胰岛素分泌缺陷和胰岛素抵抗,造成β细胞数量的丢失或功能不足,最终在多因素损害下导致β细胞衰竭,β细胞的分泌缺陷和数量缺失可导致胰岛素供给缺乏,机体代谢障碍[15]。② 由脂肪组织产生的众多细胞因子通过自分泌、旁分泌和内分泌等途径影响胰岛素作用的各个环节,在糖尿病发病机制中起重要作用[16]。研究发现[17],脂肪细胞能特异性分泌一种多肽—抵抗素(resistin),其与糖代谢密切相关,在人体能降低细胞对葡萄糖的摄取量;由于体内刺激胰岛素分泌最主要的方式是葡萄糖刺激,而葡萄糖可以自由进入胰岛β细胞,并在β细胞中代谢,可直接刺激胰岛素的合成与分泌,但抵抗素可降低细胞对葡萄糖的摄取,这可能是抵抗素损害或抑制胰岛β细胞分泌胰岛素的一种机制[18]。 综上所述,在不同糖代谢状态下,BMI对胰岛β细胞功能的作用存在差别,正常糖代谢和糖代谢异常人群中,BMI的增大可使胰岛β细胞功能代偿性增加,而糖尿病人群中这种代偿性机制已经得到破坏。因此,超重或肥胖患者、糖尿病前期人群包括糖耐量异常及空腹血糖调节受损者的胰岛素抵抗及胰岛素敏感性降低即已启动,在这一阶段做到早期干预包括控制体重及生活方式、药物等多因素干预,减轻胰岛素抵抗,改善胰岛素敏感性,进而延缓糖尿病的发生发展,具有重要意义。本研究不足之处在于未应用高胰岛素-正葡萄糖钳夹技术金标准评估胰岛细胞功能,且为横断面研究,尚需前瞻性研究进一步证实。1.3 统计学处理

2 结果
2.1 不同糖代谢人群的一般状况
2.2 不同BMI人群胰岛细胞的状况

2.3 不同糖代谢人群BMI与胰岛细胞功能的关系

3 讨论

