CNa42+团簇的结构及其储氢性能研究
林雪麒,方子剑,冯五强,温在国,阮 文
CNa42+团簇的结构及其储氢性能研究
林雪麒,方子剑,冯五强,温在国,*阮文
(井冈山大学数理学院,江西,吉安 343009)
氢是一种理想的二次能源,它将成为化石燃料最有希望的替代能源之一,也是亟待开发的重要能源。而氢能的储存成本高,危险性大是急需解决的问题。理论上预测CNa42+的储氢性能, 通过理论分析,发现了每个CNa42+团簇最多可与16个H2分子有效结合,获得23.5%的质量储氢密度。在B3LYP理论水平上,H2分子与CNa42+团簇的平均相互作用能在2.107~4.948 Kcal/mol之间。由于CNa42+的质量储氢密度在7.1~23.7 wt%之间,符合美国能源部的要求目标(5.5 wt%)。研究结果表明,CNa42+在一定环境条件下可逆吸放氢性能良好,可作为潜在的理想高容量储氢材料。
密度泛函理论;CNa4和CNa42+团簇;储氢性能
0 引 言
氢能技术可以缓解能源短缺的问题,如氢燃料电池和氢内燃机等[1],可以稳定高效地提供无污染的动力。但是氢要作为常规能源,就要解决储存问题。目前最常见的物理储氢法是加压将其压缩在钢瓶中,然而一个40 L钢瓶只能存储0.5 kg氢。可见物理方法具有储存量小,耗能高,还有潜在的爆炸等缺点。而化学储氢法常以金属氢化物的形式出现,利用这些氢化物材料的高比表面积特点进行氢能储存。但以上物理和化学储氢方法都不满足美国能源部制定的2015年目标(5.5 wt%)和2020年目标(7.5 wt%)。
为了实现这一目标,近年来,人们进行了大量研究,开发了一些新型高比表面积储氢材料,如石墨烯、碳纳米管和金属-有机骨架等材料。然而这些材料与氢分子结合较弱,这意味着它们工作时必须是在低温条件下进行。虽然这些材料低温下达到了储氢目标,但不符合成本效益。因此,增加氢分子的结合能以确保新型储氢材料能够在常温下达到储氢目标是实现应用的关键。目前,一些方法,如通过电荷转移诱导极化机制吸附氢分子[2],或通过Kubas相互作用增强过渡金属与H2分子结合[3-4],使其相互作用能在0.2~0.6 eV间,介于强化学吸附与弱物理吸附之间[5],由此产生的结合能可在理想范围内,如稳定在碳纳米结构(如C60或纳米管)上的过渡金属原子Ti,最多能吸附4个氢分子,结合能为2.094~4.948 Kcal/mol/H2分子。然而,由于Ti原子均匀包覆SWNT(单壁纳米管)/C60表面可能会发生聚集,因此合成Ti修饰纳米管/C60的结构是非常困难的[6]。各种碱金属修饰碳材料也被提出用于储氢,如锂主基团元素星状团簇C5Li7+、Si5Li7+和Ge5Li7+都被设计用于储氢[1,7]。在这样的系统中,这些Li中心通过静电相互作用与分子氢结合。理论结果表明,这些类星状团簇具有良好的储氢性能。Tai等人还发现,B6Li8团簇具有较高的稳定性,储氢密度达24%的理论极限,最大结合能为0.099 eV,有望成为储氢材料的发展方向[8]。因为Na和Li为同族元素,因此我们将探讨Na修饰碳材料储氢能力,采用了杂化密度泛函B3LYP理论方法,这是一种研究大基态系统(例如含电子结构)的有效的电子结构方法[9],且具有很强的静态关联效应。本文对CNa4和CNa42+团簇的储氢性能进行了理论研究,获得了在室温和中压下可逆储氢满足的条件,即在B3LYP理论水平下计算CNa42+可以有效吸附16个H2分子且相互作用能为2.107~4.948 Kcal/mol, 储氢质量密度可达23.7 wt%。
1 计算方法
理论表明,采用杂化密度函数B3LYP方法研究CNa4和CNa42+团簇的结构和储氢性能是有效并常用的方法之一[10]。本文利用了Gaussian09程序[11],用经典扩展基组6-311+g(d,p)对CNa4和CNa42+团簇进行了理论计算。在B3LYP理论水平上优化几何结构的基础上,再利用B3LYP泛函对非共价相互作用进行了可靠的预测,通过能量和频率分析得出稳定的CNa4和CNa42+团簇结构,考虑长程相互作用的吸附能,并且对CNa4和CNa42+团簇的理论计算做了相互比较;然后,再研究H2在CNa42+表面的吸附情况;最后,研究此结构下吸氢的物理化学性质。设置力梯度、能量、位移等收敛标准,结合振动频率分析存在虚频的体系,利用消虚程序优化并调整结构。
计算过程中的氢分子平均吸附能ad由以下公式定义[12]:
ad= [(CNa42+) +m(H2)(CNa42+∙mH2)]/m
其中,(CNa42+)、(CNa42+)、(H2)和(CNa42+∙mH2)分别代表了CNa42+、H2和CNa42+∙mH2的团簇的基态能量。
2 结果和讨论
我们先分别对CNa4和CNa42+团簇体系进行计算,结果表明CNa4和CNa42+团簇都具有高度的稳定性。但当H2分子吸附在Na原子周围时,CNa4与H2分子的距离均在5 Å以上(如图1(a))。很明显,这是典型的物理吸附,并且吸附能较低仅为-0.051 Kcal/mol,表明需要加热反应才能吸附H2分子,很难在标准环境下有效地吸附H2分子。在标准环境条件下,它不是理想的储氢材料,在储氢方面不太有希望。因此,CNa4团簇不可能是高容量的储氢材料。
在此,我们进一步研究了CNa42+团簇的吸氢情况。当一个H2分子吸附时,CNa42+和H2分子的距离在2.4~2.6 Å之间如图1(b),且分散在Na原子周围,这样有利于H2分子的吸附与释放,同时经济效益也较高。
为了更进一步了解H2分子在CNa42+团簇表面的吸附,我们考虑到了1到5个H2分子吸附到同一个Na原子周围的情况,同时研究CNa42+团簇的储氢稳定性。在B3LYP/6-311+g(d,p)水平上,一个自由的H2分子的预测键长为0.744 Å,与实验值0.742 Å相近[13]。对H2分子吸附前CNa42+的构型进行了优化,Na原子的部分电荷分别转移到C原子上,从而在Na原子周围形成较强的静电场,这为H2分子的吸附创造了有利条件。当H2分子靠近CNa42+团簇表面,H2很容易被静电场极化而吸附。通过振动频率检测,我们证实了氢吸附的弛豫都是局部稳定的。氢分子吸附后体系的几何优化结构(如图2(a-e))表明,CNa42+团簇上的每个Na原子可有效吸附4个H2分子,当每个Na原子吸附第五个H2分子时,则有1个H2分子距离最近的Na原子超过3.9 Å,且此时H2分子的平均吸附能也变得很小,仅为1.566 Kcal∙mol-1,转变为纯粹的物理吸附,即不适合常温下储存氢气了,故我们认为在自然条件下不可以用于有效储氢[14]。
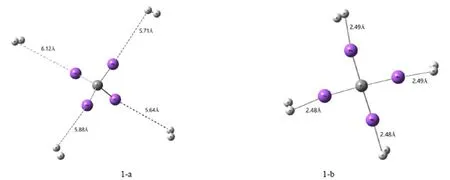
图1 CNa4 ∙4H2(a)和CNa42+ ∙4H2(b)的几何结构
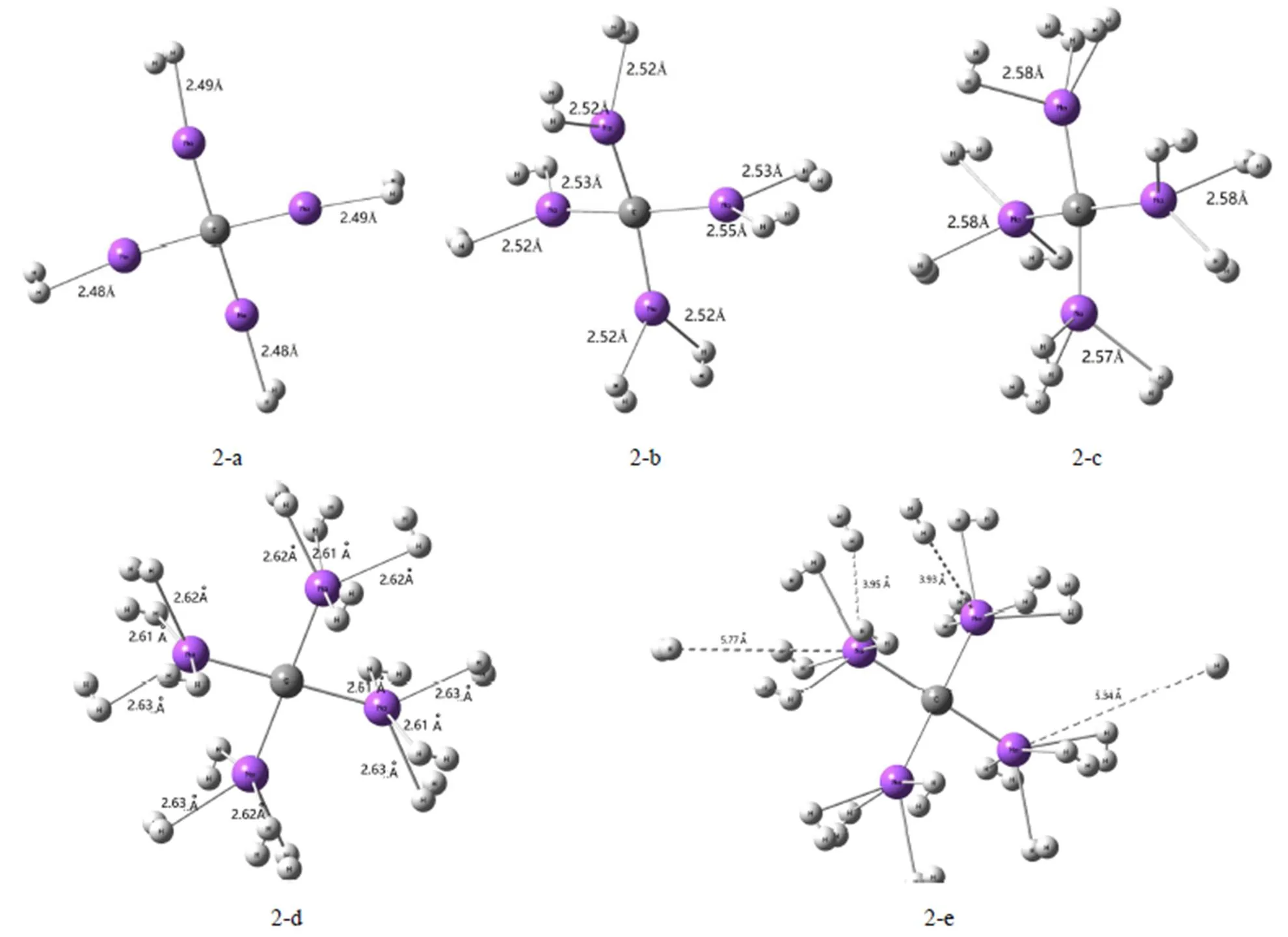
图2 CNa42+ ∙mH2的几何结构(m=4,8,12,16,20)
CNa42+体系吸氢后的物理化学性质,具体情况如表1。自由的H2分子的键长由相同的计算方法和基组算出为0.744 Å。从表中可以发现,吸附在CNa42+团簇上的H2分子的平均键长都有增大,变化范围在0.747 Å~0.750 Å之间,这是因为H2分子和Na原子发生了相互作用,从而使得一部分H2分子成键轨道的电子转移到Na原子上。使H2分子失去部分的电子,同时,Na原子部分电子又反馈给氢分子的反键轨道上,导致吸附在CNa42+团簇上的H2分子中的氢原子与原子之间的相互作用比自由H2分子中的氢原子与原子之间的相互作用要小,故其平均键长比自由H2分子键长都有增大。同时不难发现,随吸附H2分子数目的增大,H2分子的平均键长增大越来越小,表明吸附数量增大导致氢分子与Na原子间相互作用下降。表1还可见H2-Na的平均键长随吸附H2分子数目的增大而增大,这也意味着H2分子与CNa42+团簇的相互作用也是趋于减小的。而氢分子的平均吸附能随吸附H2分子数目的增大而减小,则进一步直接表明相互作用的减小趋势。因此说明CNa42+团簇吸附H2分子是有一定饱和性的[15-16],当CNa42+团簇与H2分子相互作用过小时,H2分子将被直接排斥出去(如图2(e))。
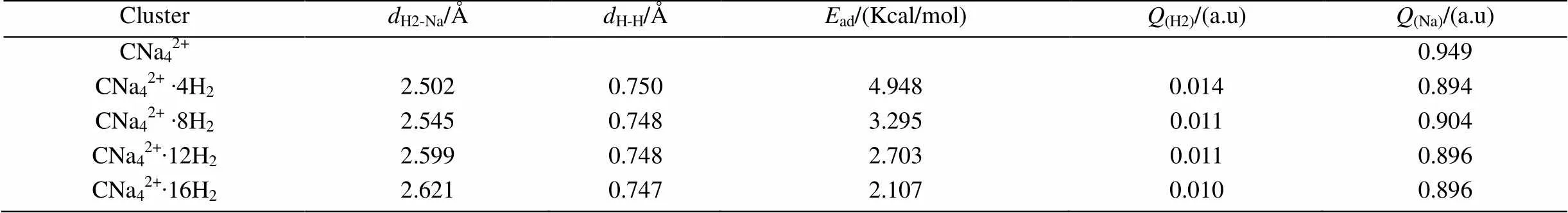
表1 CNa42+ ∙mH2团簇中H2-Na和H-H的平均键长及平均吸附能与自然电荷分布
由于CNa42+团簇能结合到4nH2分子(即每个Na原子可以结合一到四个H2分子),在理想范围内下,我们计算了相应的H2分子质量储氢密度H wt%[1]。
H wt% ={8n(H)/[8n(H) +(C)+ 4(Na)]}×100%
其中(H)、(C)和(Na)分别是H、C和Na的原子质量。从图2可知每个Na原子可以有效结合到4个H2分子,计算得出CNa42+团簇的质量储氢密度为23.7 wt%,远超美国能源部7.5 wt%的最终目标。然而,美国能源部的目标指的是完整的存储系统,包括存储材料、容器、绝缘、管道等,而不仅仅是存储材料。因此,这里获得的H wt%值也许不能与美国能源部目标直接比较。真正的H wt%值将取决于整个存储系统的设计,因此必须在考虑了所有这些问题之后做出决定。尽管如此,由于这里的H wt%值远高于美国能源部的最终目标,因此,理论上基于CNa42+团簇的整个储存系统很可能是高容量的储氢材料。
3 结论
采用密度泛函理论(DFT)方法研究了稳定CNa4和CNa42+的团簇,通过理论计算分析,获得了CNa42+团簇和H2吸附的成键性质,即主要是通过静电极化机制,使H2吸附在CNa42+团簇的Na原子周围。每个CNa42+团簇最多可与16个氢分子结合(即每个Na原子最多可以有效结合四个H2分子),得到23.7 wt%的质量储氢密度。由于CNa4团簇形成的静电场较弱,使H2分子极化强度不足,故CNa4团簇不能作为储氢的候选材料。而CNa42+团簇本身形成了足够强的静电场,使H2分子极化与其偶极相互作用达到了足够的强度。在B3LYP水平上,H2分子与CNa42+团簇间的相互作用能在2.107~ 4.948 Kcal/mol之间,该相互作用能满足自然环境条件下的热力学要求。而且对于CNa42+体系,其H2解离温度接近室温,质量存氢储密度在7.1~ 23.7 wt%之间,满足美国能源部的最终目标7.5 wt%。以上理论结果表明CNa42+体系可以作为自然环境条件下可逆吸放氢的理想储氢材料,在实验中有待进一步验证,希望本文的研究成果能为可逆储氢材料的研制和合成提供一定的帮助。
[1] 阮文,宋红莲,伍冬兰,等. 平面星形Li6Si6团簇的结构及其储氢性能的研究[J].原子分子物理学报,2018, 35(1):68-72.
[2] Srinivasu K,Ghosh S K. An ab Initio Investigation of Hydrogen Adsorption in Li-Doped closo-Boranes [J].J. Phys. Chem. C,2011,115:1450-1456.
[3] Meng Y, HanY, Zhu H Y, et al. Two dimetallocenes with vanadium and chromium: Electronic structures and their promising application in hydrogen storage [J].Int. J. hydrogen Energy, 2015, 40:12047-12056.
[4] Liu P P, Zhang H, Cheng X L, et al. Transition metal atom Fe, Co, Ni decorated B38fullerene: Potential material for hydrogen storage [J]. Int. J. hydrogen Energy, 2015,42:15256-15261.
[5] Kubas G J. Molecular hydrogen complexes: coordination of a bond to transition metals[J].Acc. Chem. Res., 1988,21(3):120-128.
[6] Sun Q, Wang Q, Jena P, et al. Clustering of Ti on a C60surface and its effect on hydrogen storage[J]. Am. Chem. Soc., 2005,127(42):14582-14583.
[7] Pan S, Merino G, Chattaraj P K. The hydrogen trapping potential of some Li-doped star-like clusters and super-alkali systems[J]. Phys Chem Chem Phys, 2012,14(29):10345-10350.
[8] Tai T B, Nguyen M T. A three-dimensional aromatic B6Li8complex as a high capacity hydrogen storage material[J]. Chem. Comm., 2013,49(9):913.
[9] Sonai S , Chai J D. Effect of Li Adsorption on the Electronic and Hydrogen Storage Properties of Acenes[J]. Scientific Reports, 2016, 6: 33081.
[10] 曹欣伟,姜振益,薛瑞波,等. Bn(n=2-8)团簇的结构和稳定性的密度泛函理论研究[J].原子分子物理学报, 2014,31: 902-908.
[11] Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian09, Revision A. 02[M]. Wallingford: Gaussian, Inc., 2009.
[12] Tang C M, Kang J, Zhang Z J, et al. The study of hydrogen storage capacity of the Ti atoms coated Si@Ga12clusters[J]. Int. J. hydrogen Energy, 2015,40:16278.
[13] Herzberg G F R S. Molecular Spectra and Molecular Structure I. Spectra of Diatomic Molecules [M]. New York : Van Nostrand Co, 1950.
[14] Meng S,Kaxiras E,Zhang Z Y. Metal-diboride nanotubes as high-capacity hydrogen storage media[J]. Nano. Lett., 2007,7(3): 663-677.
[15] 阮文, 伍冬兰, 罗文浪,等. 锂原子修饰硼原子链团簇的结构和储氢性能研究[J].原子分子物理学报, 2016, 33(5) :907- 912.
[16] 阮文, 罗文浪, 余晓光,等. 锂原子修B6团簇的储氢性能研究[J].物理学报,2013,62(5): 053103.
STRUCTURE AND HYDROGEN STORAGE PROPERTIES OF CNa42+cluster
LIN Xue-qi,FANG Zi-jian, FENG Wu-qiang, WEN Zai-guo,*RUAN Wen
(School of Mathematics and Physics, Jinggangshan University, Ji’an, Jiangxi 343009, China)
Hydrogen is an ideal secondary energy, it will become one of the most promising alternatives to fossil fuel, and presses for the development of the important sources of energy. However, the high cost and risk of hydrogen energy storage method is the urgent problems to be solved. Theoretically predict the hydrogen storage properties of CNa42+cluster shows that the stable CNa42+is a candidate material for hydrogen storage. Within the framework of density functional theory (DFT), it was found that it can bind to 16 H2molecules per CNa42+cluster with the highest gravimetric hydrogen storage capacity of 23.7 wt% . At the B3LYP theory level, the average interaction energy between H2and CNa42+clusters is in the range of 2.107~4.948 Kcal/mol. Accord with the requirement of the US department of energy's goal (5.5 wt %), the research results show that CNa42+cluster with the gravimetric hydrogen storage capacity is in the range of 7.1~ 23.7 wt%. Our results show that CNa42+can be used as an ideal high capacity hydrogen storage material under certain environmental conditions.
density functional theory; CNa4andCNa42+clusters; Hydrogen storage properties
1674-8085(2018)05-0022-05
O641
A
10.3969/j.issn.1674-8085.2018.05.005
2018-05-29;
2018-06-21
国家自然科学基金项目(11364023)、江西省自然科学基金项目( 20171BAB201020);江西省教育厅科技研究项目(GJJ160737);井冈山大学第六批大学生创新创业训练计划项目(31)
林雪麒(1996-),女,福建南平人,井冈山大学数理学院物理2014级本科生(E-mail:1009030185@qq.com);
方子剑(1996-),男,安徽合肥人,井冈山大学数理学院物理2014级本科生(E-mail:498977389@qq.com);
冯五强(1994-),男,河南开封人,井冈山大学数理学院物理2014级本科生(E-mail: 852490926@qq.com);
温在国(1995-),男,海南儋州人, 井冈山大学数理学院物理2015级本科生(E-mail:1134541612@qq.com);
*阮 文(1970-),男,江西吉安人, 教授, 博士, 主要从事分子结构和原子团簇的研究(E-mail:ruanwensongyan@126.com).

