棕榈酸通过上调受体Frizzled-2及Ror-2表达抑制胰岛β细胞系INS-1增殖*
吴杏儿, 郑 磊, 孙世珺
(1中山市人民医院分子诊断中心, 广东 中山 528403; 2南方医科大学南方医院检验科, 广东 广州 510515)
脂代谢异常与2型糖尿病密切相关,血脂异常可出现于糖尿病前期,成为促进2型糖尿病发病的因素之一[1]。血循环中游离脂肪酸(free fatty acids,FFAs)升高对胰岛β细胞的损害,一方面表现为长期脂毒性导致胰岛素分泌功能减退[2],另一方面则表现为引起胰岛β细胞数量明显减少。动物及人类成体胰岛β细胞数量的维持依赖于细胞增殖及凋亡平衡[3]。体外实验发现, FFAs对啮齿类动物及人的胰岛β细胞同时产生诱导凋亡及抑制增殖的效应[4-5]。迄今已有大量研究阐释FFAs如何诱导β细胞凋亡,例如在多种不同来源的胰岛β细胞中神经酰胺通路已被证实与β细胞凋亡关系紧密[4]; FFAs介导线粒体膜损伤导致一系列细胞因子(如细胞色素C)释放,可诱导β细胞凋亡[6]。然而,FFAs抑制胰岛β细胞增殖的机制尚不清楚。进一步研究FFA抑制胰岛β细胞增殖的可能机制,不仅对了解脂毒性参与糖尿病发病和发展有所帮助,更有助于未来可能的药物开发甚至治疗策略的改进。
Wnt信号通路是一类参与调节器官发育和细胞有丝分裂等多方面的重要信号通路,该通路不同层面的信号分子,包括Wnt配体及其受体,如卷曲蛋白受体(Frizzled receptors)和受体酪氨酸激酶样孤儿受体(receptor tyrosine kinase-like orphan receptor,Ror)等在胰腺组织中均有不同程度的表达[7]。我们的前期研究发现,Wnt配体家族成员之一Wnt5a在β细胞系及小鼠胰岛中基础表达丰度高,并可显著抑制β细胞增殖[8]。然而,在不同类型的组织细胞中Wnt5a对细胞增殖的影响截然不同,这种现象可能是因为Wnt5a与不同受体结合将激活不同的信号通路[9],因此明确β细胞中介导Wnt5a调控细胞增殖的受体类型具有重要意义。体外实验中,我们发现受体Frizzled-2(Fzd-2)及Ror-2可介导Wnt5a激活钙/钙调蛋白依赖性蛋白激酶Ⅱ(calcium/calmodulin-dependent protein kinase Ⅱ, CaMKⅡ)通路,从而下调细胞周期因子cyclin D1表达,最终抑制β细胞增殖。近来研究发现Fzd-2与脂代谢异常密切相关,Fzd-2介导Wnt5a参与调控脂肪性肝硬化发展过程[10]。但受体Fzd-2及Ror-2是否参与介导脂毒性抑制胰岛β细胞增殖,目前尚无相关报道。因此本实验采用饱和脂肪酸棕榈酸(palmitic acid, PA)刺激大鼠胰岛β细胞系INS-1,采用RT-qPCR、Western blot及免疫共沉淀(co-immunoprecipitation,Co-IP)技术,检测棕榈酸对INS-1细胞Fzd-2和Ror-2表达的调控作用,并运用siRNA干扰受体Fzd-2及Ror-2表达,再予棕榈酸刺激,采用EdU标记法明确受体Fzd-2及Ror-2在棕榈酸抑制INS-1细胞增殖中的作用,为探索脂毒性抑制β细胞增殖机制提供理论依据。
材 料 和 方 法
1 主要材料
大鼠胰岛β细胞系INS-1购自ATCC。小牛血清和RPMI-1640培养基购自Gibco;棕榈酸、BSA、2-巯基乙醇、HEPES和二甲基亚砜购自Sigma;siRNA由广州吉捷生物科技有限公司合成提供;EdU试剂盒购自广州市锐博生物科技有限公司;转染试剂LipofectamineTM2000购自Invitrogen;羊抗人Fzd-2抗体(交叉抗大鼠)购自Abcam;兔抗人/鼠Ror-2抗体、兔抗鼠Wnt5a抗体和兔抗鼠GAPDH抗体购自Cell Signaling Technology;抗Wnt5a单克隆抗体购自Santa Cruz;辣根过氧化酶标记IgG购自弗德生物技术有限公司;Pierce Direct IP Kit试剂盒购自Thermo Fisher Scientific;EastepTM通用型总RNA提取试剂盒、GoScriptTM反转录试剂盒和GoTaq®qPCR Master Mix购自Promaga。荧光定量PCR仪7500购自ABI;倒置荧光显微镜购自Olympus。所有引物均由Invitrogen合成。
2 方法
2.1细胞培养 将INS-1细胞培养在37 ℃、 5% CO2培养箱中,每100 mL细胞培养液含有10%小牛血清、1%青/链霉素、2-巯基乙醇贮存液35 μL、碳酸氢钠0.2 g和10 μmol/L HEPES 0.1 mL。以含0.25%胰酶消化细胞传代,每隔24 h更换1次培养液。
2.2EdU标记染色法检测细胞增殖率 细胞分为无意义siRNA转染+溶剂BSA(阴性对照,negative control, NC)组、无意义siRNA转染+棕榈酸(NC+PA)组和siRNA-Fzd-2/Ror-2转染+棕榈酸组(针对Fzd-2和Ror-2各设置2组不同有效序列siRNA转染)。转染36 h后予500 μmol/L棕榈酸继续培养24 h。
各组细胞以每孔4×104的密度种植至铺有盖玻片的24孔板,细胞贴壁后更换培养基,进行转染或共培养,离观察终点2 h前往培养基中加入EdU溶液(终浓度为50 μmol/L),按试剂盒说明固定细胞、染色及铺片。使用倒置荧光显微镜,观察Appolo 567染色使用550 nm激发光,观察Hoechst 33342染色使用350 nm激发光,放大倍数为400。每复孔等分4象限,每象限随机拍摄3张不同视野照片均计数,分别计算Hoechst(细胞核)及Appolo(增殖细胞)染色细胞数,Appolo/Hoechst比值为细胞增殖率,每复孔Hoechst染色阳性细胞计数>1 000个。同组设3个复孔,取增殖率平均数及标准差。
2.3细胞转染 除按照EdU标记实验的分组外,另设无意义siRNA转染组、siRNA-Fzd-2-1转染组、siRNA-Fzd-2-2转染组、siRNA-Ror-2-1转染组和siRNA-Ror-2-2转染组。按LipofectamineTM2000转染试剂盒操作说明,分别将含有1 μg无意义siRNA、siRNA-Fzd-2-1(5’-UGCAUCAAUUCUACCCGCUGGUGAAd-Td-3’,5’-UUCACCAGCGGGUAGAAUUGAUGCAdTd-3’)、siRNA-Fzd-2-2(5’-CGUCCUAUCUCAGCUAU-AAGUUUCUdTd-3’, 5’-AGAAACUUAUAGCUGAGA-UAGGACGdTd-3’)、siRNA-Ror-2-1(5’-CCAUUGACACCUUGGGACAACUUGAdTd-3’,5’-UCAAGUUGU-CCCAAGGUGUCAAUGGdTd-3’)及siRNA-Ror-2-2(5’-CCAUUACCGCCACUGGUGUUCUGUAdTd-3’,5’-UA-CAGAACACCAGUGGCGGUAAUGGdTd-3’)的稀释液加入含无血清培养基的EP管中混匀,缓慢加入含1 μL LipofectamineTM2000的50 μL无血清培养基中,混匀后室温静置20 min形成转染复合物。使用转染复合物培养细胞6~8 h后吸出转染复合物,换含有血清的培养基继续培养。收集细胞用于Western blot检测或EdU标记染色进行细胞增殖率计数。
2.4免疫共沉淀 按Pierce Direct IP Kit试剂盒说明将抗Wnt5a单克隆抗体通过共价偶联结合到琼脂糖树脂。细胞经BSA或200 μmol/L棕榈酸刺激6 h后弃培养液,用试剂盒中1×Coupling Buffer洗涤细胞1次,冰上操作加入IP裂解液裂解5 min,裂解物转移至离心管中13 000×g离心10 min,转移上清至离心管中,留取部分进行蛋白定量及Western blot分析,其余按试剂盒说明进行免疫共沉淀。免疫沉淀反应后,按试剂盒说明用洗脱缓冲液洗脱蛋白,室温孵育10 min后离心收集洗脱液,用于后续Western blot分析。
2.5RT-qPCR实验 细胞共分5组:BSA溶剂对照组及200 μmol/L棕榈酸刺激3 h、6 h、12 h和24 h组。按试剂盒说明于冰面操作提取对数生长期细胞总RNA,再反转录为cDNA。按试剂盒说明进行反转录,反应条件:25 ℃退火5 min,延伸1 h,70 ℃灭活15 min。cDNA样本-20 ℃保存备用。RT-qPCR反应总体系为20 μL,包括反转录产物样本5 μL、无酶核酸水4 μL、引物0.8 μL、Master Mix (2×)10 μL和CXR(100×)0.2 μL。反应条件: 95 ℃ 10 min; 95 ℃ 15 s、 60 ℃ 1 min(40个循环)。Fzd-2及Ror-2相对表达量采用2-ΔΔCt方法计算,内参照为β-actin。引物序列见表1。
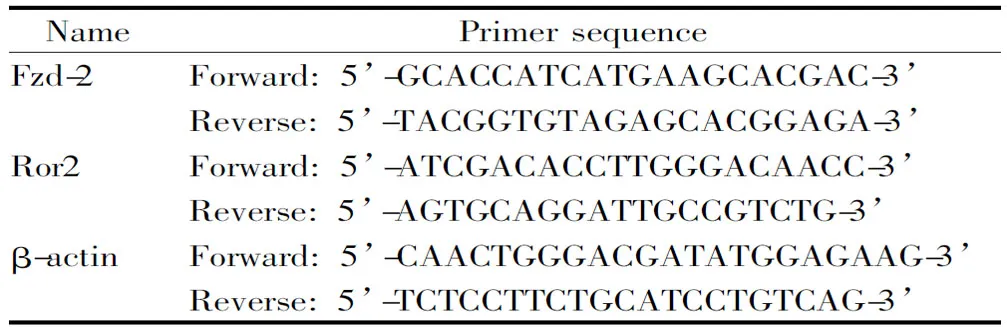
表1 RT-qPCR引物序列
2.6Western blot实验 时间梯度实验分6组:BSA溶剂对照组及200 μmol/L棕榈酸刺激1 h、3 h、6 h、12 h和24 h组;浓度梯度实验分4组:BSA溶剂对照组及200、500和1 000 μmol/L棕榈酸刺激6 h组。至观察终点弃去培养基加入RIPA裂解液提取细胞总蛋白。12% SDS-PAGE分离蛋白质,转膜,4% BSA封闭2 h,PBS洗膜3次后加 I 抗(1∶1 000),4 ℃孵育过夜,洗膜3次加 II 抗(1∶5 000)室温孵育1 h,洗膜后再在暗室中加入发光剂,显影后定影。以GAPDH为内参照,ImageJ软件灰度扫描图像检测Fzd-2及Ror-2蛋白表达的差异。
3 统计学处理
采用SPSS 11.0统计软件处理数据。每组设置3次重复独立实验,结果均以均数±标准差(mean±SD)表示。多组间差异比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 棕榈酸诱导INS-1细胞受体Fzd-2和Ror-2的mRNA表达
RT-qPCR检测结果显示,经棕榈酸刺激后INS-1细胞受体Fzd-2及Ror-2 mRNA水平升高。与溶剂对照组相比,细胞自棕榈酸刺激6 h后Fzd-2的mRNA表达水平显著升高(P<0.05),且随刺激时间延长逐渐增加;经棕榈酸处理3 h后, Ror-2的mRNA表达水平升高,刺激12 h后达峰值(P<0.05),见图1。
2 棕榈酸促进INS-1细胞受体Fzd-2和Ror-2的蛋白表达
Western blot检测200 μmol/L棕榈酸处理细胞后Fzd-2及Ror-2蛋白随时间表达变化,结果显示INS-1细胞中的Fzd-2及Ror-2蛋白表达水平逐渐增加(P<0.05),见图2A;使用不同浓度棕榈酸刺激细胞6 h,结果显示细胞Fzd-2及Ror-2的蛋白表达水平随棕榈酸刺激浓度升高而增加(P<0.05),见图2B。
3 棕榈酸促进INS-1细胞中Wnt5a与受体Fzd-2、Ror-2结合
Co-IP检测棕榈酸刺激下细胞中Wnt5a与受体Fzd-2和Ror-2结合的变化,结果显示,与BSA溶剂对照组相比,200 μmol/L棕榈酸刺激6 h可显著促进Wnt5a募集Fzd-2和Ror-2(P<0.05),见图3。
4 沉默Fzd-2和Ror-2表达对棕榈酸抑制INS-1细胞增殖的影响
siRNA瞬时转染沉默Fzd-2及Ror-2,转染36 h后Western blot 检测结果显示siRNA序列有效降低Fzd-2和Ror-2表达,见图4A、B。分别使用siRNA-Fzd-2和siRNA-Ror-2转染细胞36 h后予500 μmol/L棕榈酸继续刺激细胞24 h,EdU标记法检测细胞增殖率,结果显示转染无意义siRNA的情况下,棕榈酸显著降低细胞增殖率(P<0.05),沉默Fzd-2及Ror-2均能减弱棕榈酸抑制细胞增殖的效应(P<0.05),见图4C、D。

Figure 1.Palmitic acid (PA) activated the mRNA expression of Fzd-2 and Ror-2 in INS-1 cells. INS-1 cells were exposed to 200 μmol/L PA for 3 h, 6 h, 12 h and 24 h, and the mRNA levels of Fzd-2 and Ror-2 were detected by RT-qPCR. Mean±SD. n=3. *P<0.05 vs control group.
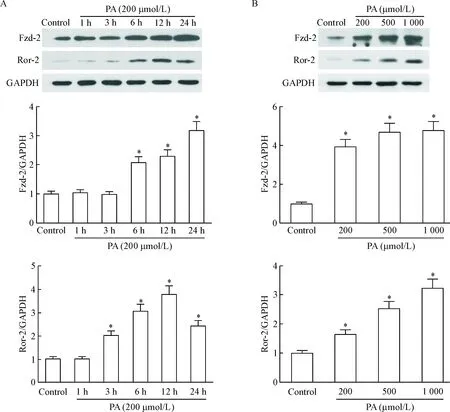
Figure 2.Palmitic acid (PA) up-regulated the protein expression of Fzd-2 and Ror-2 in the INS-1 cells. INS-1 cells were exposed to 200 μmol/L PA for the indicated time points (A) or to various concentrations of PA for 6 h (B). Mean±SD. n=3. *P<0.05 vs control group.

Figure 3.Palmitic acid (PA) promoted the interaction between Wnt5a and Fzd-2/Ror-2 in INS-1 cells. The cells were treated with BSA or PA (200 μmol/L) for 6 h. The results of co-immunoprecipitation demonstrating the interaction between Wnt5a and Fzd-2/Ror-2. The cell lysates were first immunopurified using monoclonal anti-Wnt5a antibody. Wnt5a and co-immunoprecipitated Fzd-2/Ror-2 were determined by Western blot. Mean±SD. n=3. *P<0.05 vs control group.
讨 论
Wnt信号通路在细胞繁殖和生物发育过程中发挥着重要作用。Wnt基因编码一类分泌型糖蛋白,既可与自身细胞膜受体结合,也可与邻近细胞的膜受体结合。不同的Wnt蛋白既可起相同作用,也可产生不同的效应[11]。本课题组前期研究通过体内外实验,发现GLP-1受体长效激动剂exendin-4促进INS-1细胞及小鼠胰岛β细胞增殖过程中,Wnt5a是所有19个Wnt配体中唯一一个基础表达丰度高但其表达却随细胞增殖率升高显著下调的亚型。我们发现在INS-1细胞中Wnt5a通过激活非经典Wnt/CaMKⅡ通路抑制β-catenin转录活性,下调cyclin D1表达,这揭示了Wnt5a可能是抑制胰岛β细胞增殖的重要调控因子。有趣的是,既往文献报道Wnt5a对不同组织来源细胞增殖活性作用不一。在乳腺上皮细胞和非小细胞肺癌中Wnt5a表现促细胞增殖效应[12-13];然而在B淋巴细胞瘤和结直肠癌等组织细胞中Wnt5a却表现为抑制细胞增殖[14-15]。这种复杂作用可能是由于Wnt5a通过结合不同的特异性受体发挥活性作用引起的[16]。我们的前期实验发现了受体Fzd-2及Ror-2均参与介导Wnt5a调控INS-1细胞增殖,并且发现棕榈酸可通过调控Wnt5a信号通路抑制β细胞增殖。因此,本实验中着重关注了Wnt5a受体Fzd-2及Ror-2在棕榈酸抑制β细胞增殖过程中的作用。
Wnt蛋白的受体Fzd蛋白是一组7次跨膜蛋白,具有与G蛋白偶联受体相似的结构,广泛表达于多种器官组织。Fzd蛋白高度保守的富含半胱氨酸配体结合区是Fzd与Wnt相结合的部位,不同Fzd受体倾向于不同的信号通路。Slusarski等[17]于斑马鱼胚胎异位表达Fzd-2受体及Wnt5a,发现Wnt5a可通过Fzd-2受体促进胞内钙释放。胞内钙浓度升高激活CaMKⅡ, 有研究者通过体内外实验证实Wnt5a激活小鼠B淋巴细胞的CaMKⅡ通路下调cylcin D1表达而抑制细胞增殖。然而异位表达大鼠Fzd-1不能增加胞内钙离子浓度,也无法激活CaMKⅡ。我们的前期实验发现,基础状态下Wnt5a经受体Fzd-2介导可激活CaMKⅡ通路抑制INS-1细胞增殖,并发现Wnt5a参与介导棕榈酸抑制INS-1细胞增殖。因此本研究使用棕榈酸刺激INS-1细胞,并检测细胞Fzd-2 mRNA及蛋白水平的表达变化。鉴于棕榈酸具有较强的细胞毒性,为避免损失过多细胞以提取足量RNA及蛋白,时间梯度实验中采用较低浓度(200 μmol/L)棕榈酸处理细胞;此外前期实验发现500 μmol/L棕榈酸抑制INS-1增殖更为显著,故siRNA转染实验中采用该浓度棕榈酸刺激细胞。本实验发现棕榈酸在抑制细胞增殖的同时可显著上调受体Fzd-2的表达,并促进配体Wnt5a募集该受体,提示我们受体Fzd-2作为Wnt5a信号通路的一环,是介导脂毒性抑制β细胞增殖的重要调控因子。至于Fzd-2是否仍通过介导Wnt5a/CaMKⅡ信号通路参与棕榈酸抑制β细胞增殖,尚待我们进一步的实验探索。

Figure 4.The effects of Fzd-2 and Ror-2 silencing on palmitic acid (PA)-induced inhibition of INS-1 cell proliferation. A and B: the protein expression of Fzd-2 and Ror-2 was determined by Western blot analysis; C and D: quantification of EdU incorporation assay and representative images were showed (×400). Mean±SD. n=3. *P<0.05 vs NC group; #P<0.05 vs NC+PA group.
本研究首次发现棕榈酸可通过调控受体Fzd-2表达抑制INS-1细胞增殖,然而目前尚无相关报道揭示棕榈酸调控Fzd-2表达的具体分子机制。我们对大鼠Fzd-2基因序列进行启动子元件分析,发现在Fzd-2启动子区域可能存在与转录因子c-Fos结合的序列。Roche等[18]发现棕榈酸刺激INS-1细胞可显著上调c-Fos蛋白表达,这提示棕榈酸可能通过上调c-Fos转录因子的表达促进Fzd-2基因表达。前期实验中我们发现棕榈酸上调INS-1细胞的Wnt5a表达,而前人研究表明Wnt5a可引起胞内钙释放,棕榈酸募集c-Fos又需要胞内钙浓度升高[18]。这提示我们Wnt5a既是受体Fzd-2的配体,也可能参与介导棕榈酸调控Fzd-2表达,形成了一个调控网络。
Ror受体家族是一类Ⅰ型跨膜蛋白酪氨酸激酶,在无脊椎及脊椎动物中基因序列高度保守,其胞外结构具有与Fzd蛋白相似的CRD,也是Ror受体与Wnt蛋白结合的重要区域。在哺乳类动物中Ror-2受体可与Wnt5a结合,直接抑制依赖β-catenin的经典Wnt信号通路[19]。本课题组前期研究发现Ror-2参与介导Wnt5a抑制INS-1细胞增殖,Wnt5a信号通路的激活不仅降低全细胞β-catenin浓度,同时也抑制β-catenin与TCF/LEF结合成有效的转录复合物,最终下调下游cyclin D1表达。本研究首次报道受体Ror-2参与介导棕榈酸调控INS-1细胞增殖,棕榈酸刺激细胞后显著上调Ror-2 mRNA及蛋白水平的表达,并促进Wnt5a募集 Ror-2,从而抑制细胞增殖。我们的前期研究发现在介导Wnt5a抑制INS-1增殖的过程中,受体Fzd-2可能比Ror-2占更重要的地位。而本研究中使用siRNA沉默Fzd-2比沉默Ror-2更能显著地减弱棕榈酸对细胞增殖的抑制作用。这一现象与我们的前期研究结果相符,并提示在介导棕榈酸抑制β细胞增殖中Fzd-2受体可能更重要。
综上所述,本研究首次明确了棕榈酸通过上调受体Fzd-2及Ror-2表达,并促进其与调控β细胞增殖的重要因子Wnt5a结合,从而抑制INS-1细胞增殖。

