微小RNA-497抑制甲状腺乳头状癌细胞活力、侵袭和迁移*
张莉君, 叶 颖, 张遂亮, 庄菊花, 夏 伟
(上海中医药大学附属第七人民医院, 上海 200137)
甲状腺乳头状癌 (papillary thyroid cancer,PTC)由滤泡或滤泡旁甲状腺细胞形成,是甲状腺最常见的肿瘤类型,占甲状腺恶性肿瘤的80%左右[1]。目前,随着标准治疗的发展,绝大多数PTC患者预后良好,然而约10%~15%的患者会出现复发和转移的情况[2]。此外,晚期PTC患者经常出现周围结构转移,例如喉咙、气管、会厌、食管和宫颈血管等[3]。有鉴于此,必须了解PTC进展的机制,为该疾病患者研究制定新的治疗方法。
微小RNA(microRNA,miRNA,miR)是一系列小型内源性非编码高度保守的RNA分子,主要以碱基配对的方式直接结合其在3’非翻译区(3’-untranslation region,3’UTR)的靶基因,起到转录后调控因子的作用,从而导致mRNA断裂或翻译抑制[4]。众所周知,单个miRNA可以通过靶向特异性的丰度和发散度对大量的靶基因进行负调节[5]。几十年来,miRNA已被证实在多种细胞生物过程中发挥着重要作用,如细胞增殖、细胞凋亡、细胞周期、发育、分化、侵袭、转移和肿瘤生成[6]。最近,miRNA被发现在多种人类肿瘤中表达异常,如PTC、胃癌、神经胶质瘤、膀胱癌和结直肠癌等[7-11]。此外,新近研究表明miRNAs具有肿瘤抑制因子或癌基因功能,在PTC形成和进展过程中起着关键作用。这些发现表明miRNA可作为PTC治疗的潜在治疗靶点。
在此,我们对miR-497的直接靶基因进行了预测和验证,并对基于靶基因miR-479抑制甲状腺乳头状癌细胞的增殖、侵袭和迁移的作用机制进行了探讨。
材 料 和 方 法
1 材料
胎牛血清、青霉素、链霉素和DMEM培养基均购自Gibco;TRIzol试剂、PrimeScript RT试剂盒、Lipofectamine 2000、pGL3-AKT3-3’UTR Wt、pGL3-AKT3-3’UTR Mut、miR-497模拟物(miR-497 mimics)和阴性对照miRNA模拟物(negative control miRNA, miR-NC)均购自上海吉玛基因;抗体购自Santa Cruz;AKT3 siRNA和NC siRNA购自广州锐博生物科技有限公司;MTT试剂购自Sigma;Transwell小室购自Corning。
2 组织标本和细胞系
43例PTC患者手术切除的原发性PTC组织及相邻的甲状腺组织取自上海中医药大学附属第七人民医院,所有患者均未接受新的辅助治疗。所有组织在手术后立即快速冷冻并储存在-80 ℃的环境中。本研究由上海中医药大学第七人民医院伦理委员会批准,所有患者均上交了书面知情同意书。
2种人体PTC细胞系(TPC-1和HTH83)均购自美国菌种保藏中心,均由含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM培养基培养。
3 主要方法
3.1RT-qPCR反应 在液氮冷冻条件下,将标本组织研磨成粉末,每100 mg组织加入1.0 mL TRIzol裂解液,充分裂解后,4 ℃、 10 000 r/min离心3 min,取上清。向上清中加入200 μL氯仿,剧烈振荡30秒,室温放置3 min,4 ℃、 11 000 r/min离心15 min,小心吸取上层水溶液,加入等体积的异丙醇沉淀RNA,最后用DEPC水溶解沉淀,得到RNA溶液。使用NanoDrop 1000分光光度计评估总RNA的纯度和浓度,-80 ℃保存。使用PrimeScript RT试剂盒合成cDNA。使用SYBR Premix Ex Taq在Applied Biosystems 7900HT实时PCR系统中进行qPCR。设置GAPDH为内参照。引物序列见表1。
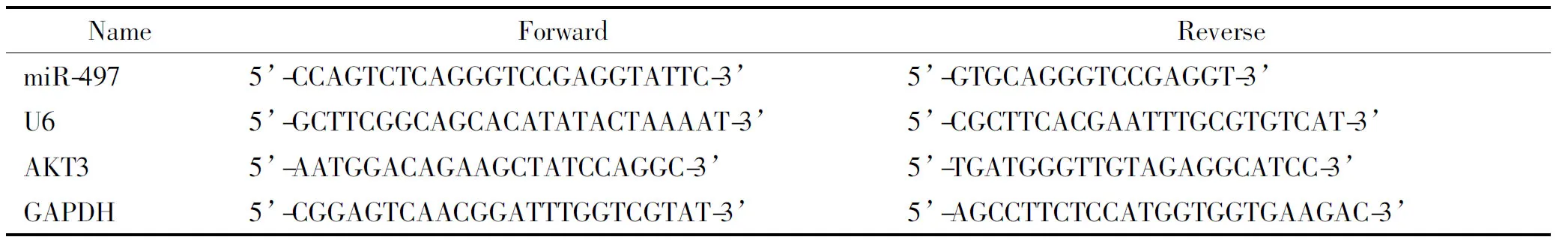
表1 RT-qPCR所用引物序列
3.2基因转染 用6孔板将细胞以60%~70%的密度接种到不含胎牛血清的DMEM中。黏附后,使用Lipofectamine 2000试剂分别将miR-497 mimics、 miR-NC、AKT3 siRNA和NC siRNA转染细胞。培养6 h后,用含有10%胎牛血清的DMEM置换培养基。
3.3MTT法测定细胞活力 收集转染的细胞,并将其接种到96孔板中,密度为每孔4 000个。在培养箱中培养1、2、3和4 d之后,分别进行MTT测定。将10 μL MTT溶液(5 g/L)加入每孔中,在37 ℃下培育4 h。随后,移除培养基,加入150 μL二甲基亚砜。使用自动多孔分光光度计检测490 nm处的吸光度(A)值。
3.4细胞迁移和侵袭能力的测定 采用放置在24孔板中的含有8 μm膜的Transwell小室进行细胞迁移和侵袭测定。获取转染细胞并悬浮于无胎牛血清的DMEM中。在细胞迁移测定中,向Transwell小室上室加入5×104细胞,将含有20%胎牛血清的培养基加入下室。培养48 h后,使用棉签小心地取出未迁移的细胞。将迁移的细胞固定、染色并在空气中干燥。细胞侵袭检测除了用基质胶包被Transwell小室以外,其余步骤均与细胞迁移测定相似。倒置显微镜下拍照。
3.5萤光素酶报告基因检测 用TargetScan 6.0(www.targetscan.org/vert_ 60/)预测miR-497与靶基因3’UTR的结合位点。通过GenePharma合成野生型(pGL3-AKT3-3’UTR Wt)和突变型(pGL3-AKT3-3’UTR Mut)AKT3萤光素酶报告载体。将HEK293T细胞以40%~50%的密度接种在24孔板中。培养过夜后,使用Lipofectamine 2000将pGL3-AKT3-3’UTR Wt、 pGL3-AKT3-3’UTR Mut、miR-497模拟物或miR-NC转染细胞。每组设3个复孔,转染后48 h,使用双萤光素酶报告基因检测系统进行发光强度检测。相对萤光素酶活性用海肾萤光素酶活性进行归一化处理,重复3次。
3.6Western blot分析 收集转染的细胞,裂解,低温离心10 min,取上清。10% SDS-PAGE分离后,转膜,在含5%脱脂奶的TBST中封闭1 h,加入1∶1 000稀释的相应抗体, 4 ℃下孵育过夜。TBST洗膜3次后,在室温下用辣根过氧化物酶标记的山羊抗小鼠IgG孵育2 h,成像。以GAPDH为内参照。
4 统计学处理
用SPSS 13.0进行数据处理和统计分析。数据用均数±标准差(mean±SD)的方式表示,组间差异采用独立样品t检验,以P<0.05为差异有统计学意义。
结 果
1 AKT3是PTC中miR-497的直接靶标
萤光素酶报告基因检测发现野生型AKT3 3’UTR报告基因的萤光素酶活性明显降低(P<0.05),而突变型报告基因的萤光素酶活性未受影响。RT-qPCR和Western blot结果显示,与miR-NC转染细胞相比,转染miR-497 mimics的TPC-1细胞和HTH83细胞中AKT3的mRNA和蛋白表达水平显著降低(P<0.05),表明AKT3是PTC中miR-497的直接靶基因,见图1。
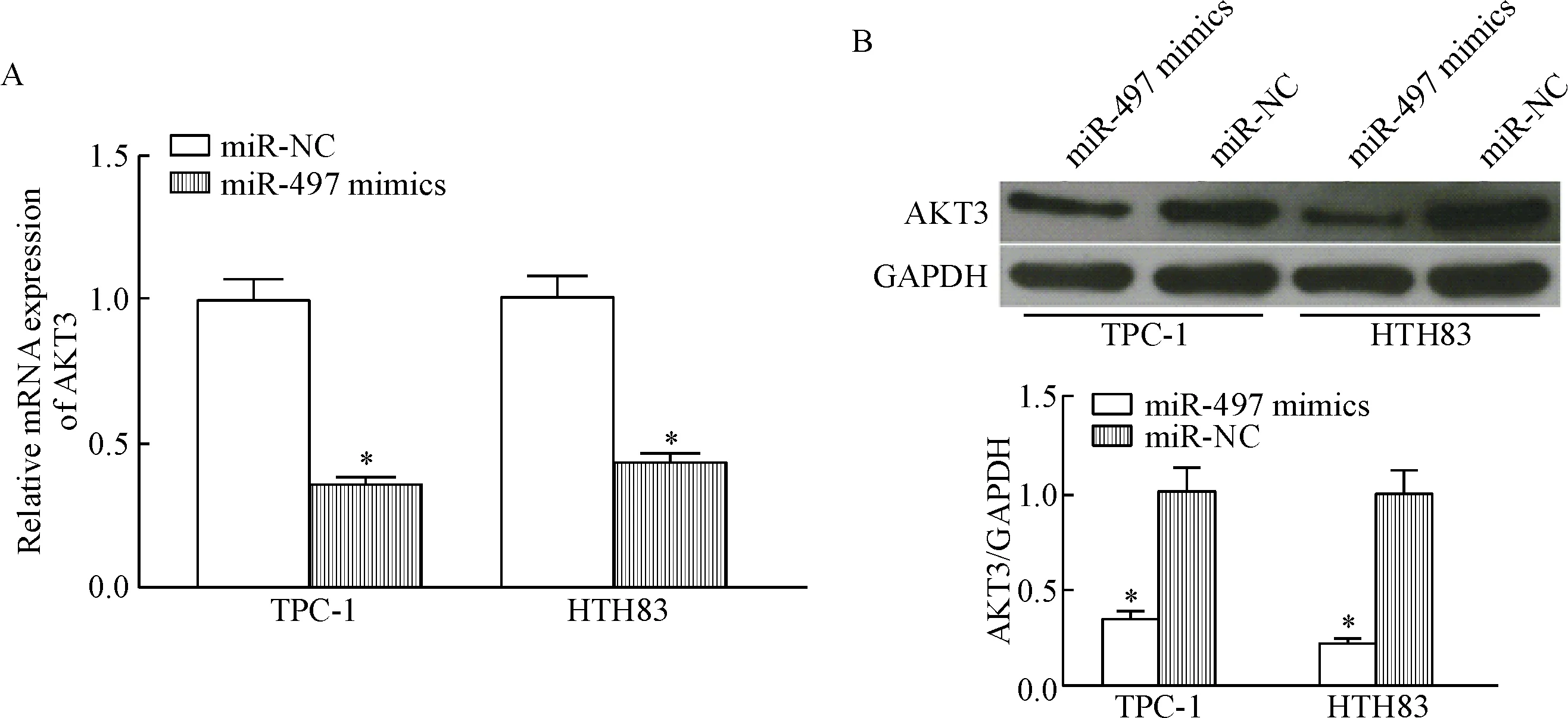
Figure 1.The expression of AKT3 at mRNA and protein levels in the TPC-1 cells and HTH83 cells after transfection with miR-497 mimics and miR-NC. A: RT-qPCR was performed to measure the mRNA expression of AKT3 in the TPC-1 cells and HTH83 cells after transfection with miR-497 mimics or miR-NC; B: Western blot was performed to measure the protein expression of AKT3 in the TPC-1 cells and HTH83 cells after transfection with miR-497 mimics or miR-NC. Mean±SD. n=3. *P<0.05 vs miR-NC group.
2 AKT3与PTC中miR-497的表达呈负相关
与邻近甲状腺组织相比,PTC组织中miR-497的表达显著下调(P<0.05),而AKT3的表达显著上调(P<0.05), miR-497和AKT3 mRNA在PTC组织中的表达呈负相关性(r=-0.573 7,P<0.01),见图2。
3 miR-497高表达抑制PTC的细胞活力、侵袭和迁移
miR-497模拟物转染TPC-1细胞和HTH83细胞后MTT实验和细胞侵袭迁移实验结果显示,miR-497的高表达显著抑制TPC-1细胞和HTH83细胞的活力、侵袭和迁移(P<0.05),见图3。
4 miR-497通过调节AKT3表达来抑制PTC细胞的活力、侵袭和迁移
MTT实验、细胞迁移和侵袭实验的检测结果发现,与NC siRNA组相比,敲减AKT3基因表达后, TPC-1细胞和HTH83细胞的活力、迁移和侵袭均受到了抑制,与miR-497的过表达具有相似作用(P<0.05),表明miR-497可能通过调节AKT3的表达来部分抑制PTC细胞的活力、迁移和侵袭,见图4。
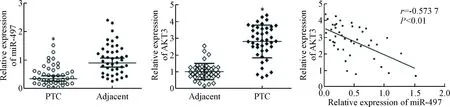
Figure 2.The expression levels of miR-497 and AKT3 mRNA in the PTC tissues. Mean±SD. n=43. *P<0.05 vs adjacent.
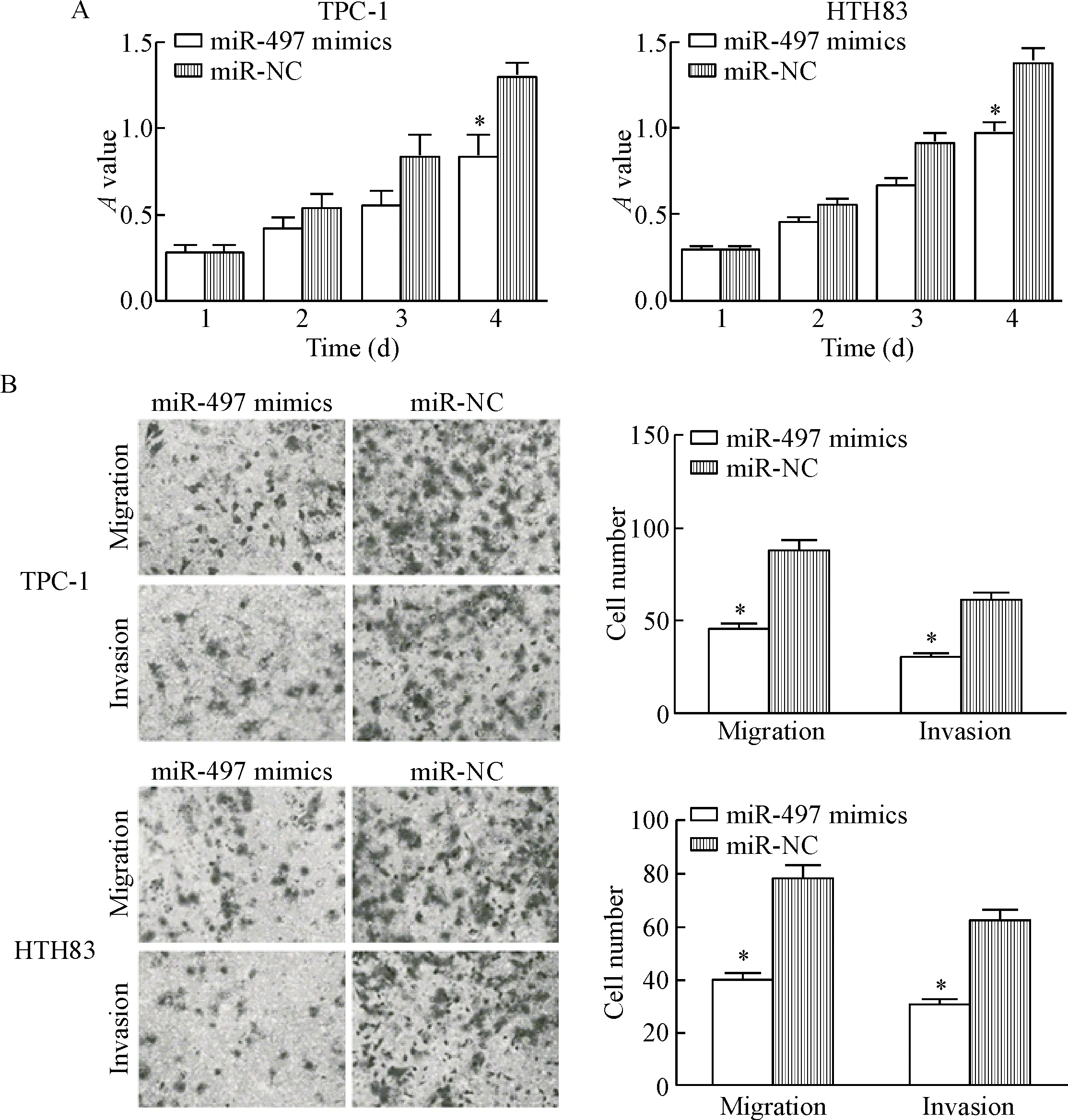
Figure 3.The suppressive roles of miR-497 in PTC cell viability, migration and invasion. A: MTT assay was used to evaluate the effect of miR-497 over-expression on the viability in TPC-1 cells and HTH83 cells; B: up-regulation of miR-497 suppressed the migration and invasion abilities of TPC-1 cells and HTH83 cells (×200). Mean±SD. n=3. *P<0.05 vs miR-NC group.
讨 论
越来越多的证据表明, miR-497在多种人类肿瘤的发展进程中起着关键作用。在乳腺癌中,miR-497的强制表达通过直接靶向多种基因如Raf-1、CCND1、Bcl-w、CCNE1、Bcl-2和VEGFR2来抑制肿瘤细胞的生长、迁移、侵袭,血管生成和上皮间质转化,同时可以增加凋亡[12-13];在结肠直肠癌中,miR-497的上调可以抑制体外细胞增殖,减少体内外的迁移、侵袭和转移,并通过封闭KSR1、IGF-1R和VEGFA来增强5-氟尿嘧啶治疗的化学敏感性[14];在子宫颈癌中,miR-497恢复表达可以通过调节细胞周期蛋白
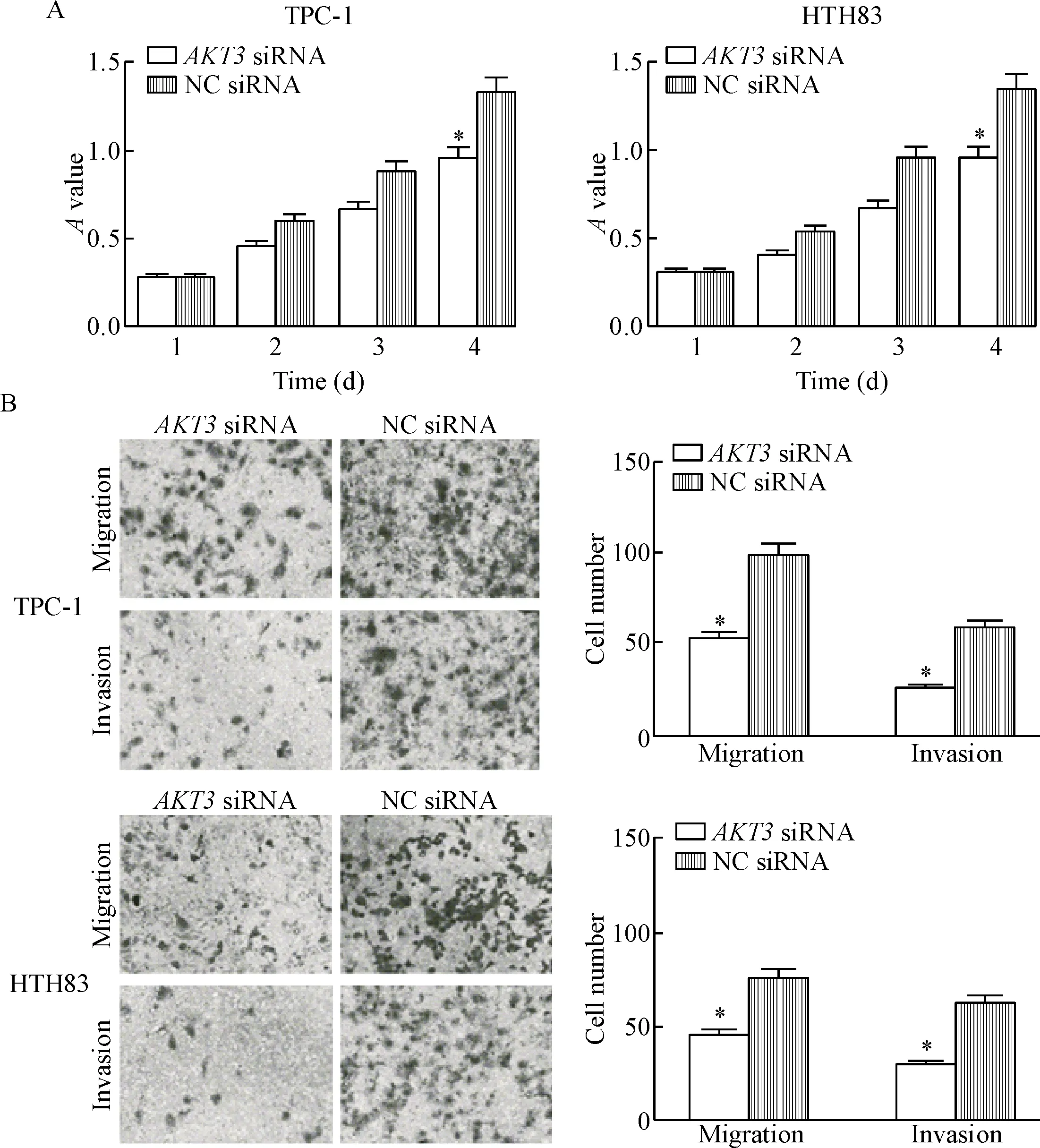
Figure 4.Down-regulation of AKT3 mimicked the roles of miR-497 over-expression in the viability, migration and invasion of PTC cells. A: the viability of TPC-1 cells and HTH83 cells was measured by MTT assay after transfection with AKT3 siRNA or NC siRNA; B: the migration and invasion abilities of TPC-1 cells and HTH83 cells were detected after transfection with AKT3 siRNA or NC siRNA (×200). Mean±SD. n=3. *P<0.05 vs NC siRNA group.
E1和IGF-1R来抑制细胞增殖,集落形成能力和运动力[15];在肝细胞癌中,miR-497过表达通过负调节YAP1、IGF-1R、VEGFA和AEG-1来阻滞细胞集落形成、增殖、血管生成、细胞转移和诱导细胞凋亡[16-17];在非小细胞肺癌中,miR-497重新表达通过下调HDGF,CCNE1,YAP1和VEGFA来减弱细胞增殖、集落形成、生长、侵袭和血管生成[18],以上表明miR-497在甲状腺乳头状癌形成和进展过程中起着关键作用。
AKT为PI3K/AKT通路的关键因子,可以调节多种细胞过程,如细胞增殖、凋亡、迁移、侵袭和代谢[19]。AKT家族成员AKT3已被发现在多种人类肿瘤中表达上调,例如肝细胞癌、前列腺癌、胰腺癌、神经胶质瘤、乳腺癌等[20-22]。Cheng等[23]发现,AKT3在PTC中被上调。功能测定还显示,AKT3低表达可以抑制PTC细胞生长和转移,并诱导细胞凋亡。在本研究中,我们发现miR-497通过直接靶向AKT3来抑制PTC细胞的活力、侵袭和迁移,说明基于miR-497/AKT3的靶向治疗对PTC来说可能是一种新颖有效的治疗策略。
总之,miR-497通过直接靶向AKT3抑制PTC细胞生长、迁移和侵袭,这种新型的miR-497/AKT3途径可为PTC提供新的治疗方法。

