丹黄消炎液对皮肤溃疡感染耐药鲍曼不动杆菌及TLR4作用
徐 阳,王 军,薛 田,张荣荣,沈凤娇
随着抗菌药物在临床的广泛应用,多重耐药和泛耐药菌株日益增多,细菌耐药性已成为一个日益严重的全球性公共卫生问题。我们的前期研究表明,丹黄消炎液对致病菌表现出显著的抑制作用,尤其是对某些泛耐药菌也有抑制作用,但其机制尚不明确。Toll样受体4(Toll-like receptors4,TLR-4)在免疫及炎症反应中有重要作用[1]。TLR-4信号转导通路被激活后,可介导下游细胞因子TNF-α和IL-1β的分泌[2]。当TLR-4的表达升高后,可将更多的活化信号传递到细胞内,促进细胞因子的分泌,参与机体的炎症反应[3],进而达到抑制细菌的作用。我们试图通过本研究,明确丹黄消炎液对皮肤溃疡感染耐药鲍曼不动杆菌的作用及机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 4月龄新西兰白兔30只,雄性,体质量2~2.5 kg,由北京海淀区兴隆实验动物养殖场提供,许可证号SCXK(京)2011-0006。
1.1.2 丹黄消炎液 为天津中医药大学第一附属医院院内制剂,由天津中医药大学第一附属医院药剂部提供(主要成分:黄芪、丹参、皂角刺、当归、银花、大黄、关黄柏。其中芦荟大黄素、大黄酸、大黄酚和大黄甲醚的总含量不少于生药的1.5%)。0.9%氯化钠溶液:天津大冢制药有限公司生产。医用无菌凡士林纱布油纱条:由河南新卫医疗器械有限公司生产。
1.1.3 实验仪器 高速离心机:Eppendorf公司,德国;转移脱色摇床TS-8:海门其林贝尔仪器制造公司;电泳仪、凝胶玻璃板、固定夹、垂直电泳槽DYCZ-20C、转移槽DYCP-40C:北京六一仪器厂;灌胃针、注射器(5 mL、10 mL)、10 mL玻璃瓶、止血钳、直剪、试管、吸管等。扫描电镜:韩国赛可,型号SNE-3200MB。
1.1.4 实验试剂 GeneCopoeia(Cat. No. AORT-0050)购于广州复能基因有限公司;Western Lightning®-ECL Enhanced Chemiluminescence Substrate:PerkinElmer;TLR-4抗 体、IL-1β 一抗:购于上海信裕生物科技有限公司;HRP标记二抗:购于武汉博士德生物工程有限公司;蛋白电泳Loading Buffer:购于武汉博士德生物工程有限公司。
1.1.5 菌株 泛耐药鲍曼不动杆菌由天津中医药大学第一附属医院细菌室分离,并由其保管、提供。
1.2 实验方法
1.2.1 实验分组 实验分组 4月龄新西兰白兔30只,适应性喂养1周。于背部脊柱左侧切除皮肤层,造皮肤溃疡模型,创面约10 cm×10 cm,创口内注入3 mL泛耐药鲍曼不动杆菌液(细菌浓度为105cfu/mL),自然暴露24 h后。伤口周围有红、肿表现,触摸皮温升高、按压痛叫,有脓性分泌物,做组织切片HE染色显示皮肤坏死、结构不清伴有脱失,表面为炎性渗出物及坏死物覆盖,皮肤附属器消失,溃疡较深达到肌层。溃疡底部胶原纤维中纤维母细胞轻度增生,血管内皮细胞肿胀增生,大量淋巴、浆细胞及嗜酸性、中性粒细胞浸润。确定感染泛耐药鲍曼不动杆菌皮肤溃疡模型建立成功。随机分为三组:空白组(n=10)、中药灌胃组(n=10)、中药外敷组(n=10)。
1.2.2 实验干预 空白组:在创面常规消毒后用0.9%氯化钠溶液湿纱布外敷,外涂药物凡士林,厚约2 mm,再外敷盖干纱布,绷带包扎固定,每日换药1次。同时给予0.9%氯化钠溶液10 mL/kg每日灌胃1次。中药灌胃组:新西兰白兔的等效剂量约为人体的10倍,予丹黄消炎液10 mL/kg每日灌胃1次,同时在创面常规消毒后用0.9%氯化钠溶液湿纱布外敷,外涂药物凡士林,厚约2 mm,再外敷盖干纱布,绷带包扎固定,每日换药1次。中药外敷组:创面常规消毒后在创口处将略大于创面之无菌纱布浸透丹黄消炎液,湿敷创面,再外敷盖干纱布,绷带包扎固定,每日换药1次。同时给予0.9%氯化钠溶液10 mL/kg每日灌胃1次。各组用药时间均为9 d。
1.3 检测分析
1.3.1 取材方法 分别于造模成功后用药前用药后第24、第48、第72 h及第10 d,取各组新西兰白兔伤口处组织。组织取材方法:先用75%酒精由内向外消毒创面2次。无茵状态下取一块皮肤及痂下组织,深达肌膜,大小为1 cm×1 cm。放入盛有无菌生理盐水的器皿中冲洗干净,保存。实验第72 h,蘸取伤口处脓性分泌物。分泌物取材方法:用1 mL生理盐水湿润无菌分泌物取材棉试子,在1 cm×1 cm的创面内擦拭,蘸取脓性分泌物,放入无菌管内,保存。
TLR-4以Western blotting检测,用Image Proplus图像分析系统对免疫组化和原位杂交阳性染色的强度(灰度值)进行半定量测定,灰度值与阳性强度成反比,灰度值越小,染色越强。IL-1β采用免疫组化法检测。扫描电镜观测各组分泌物鲍曼不动杆菌形态。
1.3.2 Western blotting检测TLR-4表达 将组织剪成小块,并置于匀浆器中。匀浆器中加入适量的含有蛋白酶抑制剂的蛋白裂解液,对组织样本进行匀浆处理,收集裂解后的细胞碎片及释放出的蛋白。配制分离胶为10%的SDS-PAGE凝 胶。 取 32μL总 蛋 白 +8 μL的 5×Loading Buffer,煮沸3 min,立即冰置3 min,上样,100 V电压电泳。电泳分离后的蛋白电转至硝酸纤维素 膜 上(Millipore,USA),350 mA,120 min,在4 ℃进行。封闭:将硝酸纤维素膜做标记以区分正反面及左右侧,浸入Blotto封闭液中,室温摇床上轻轻摇动1.5 h。在摇床上4 ℃轻轻摇动过夜。在1×TBST中摇动浸洗3次×5 min,洗去非特异结合的一抗。将上膜和下膜分别浸入含相应HRP标记二抗的Blotto中,室温轻轻摇动2 h。在1×TBST中摇动浸洗3次×5 min,洗去非特异结合的二抗。最后用Western Lightning®-ECL,Enhanced Chemiluminescence Substrate(erkinElmer,NEL100001EA)检测,显影。
1.3.3 免疫组化检测IL-1β表达 标本固定、包埋、切片后脱蜡处理,经一抗孵育、二抗孵育后DAB显色,其后复染、脱水、封片,以显微镜观察。镜观采相分析:以胞浆中出现棕黄色颗粒为阳性细胞。定量分析采用HPIAS-1000高清晰度彩色病理图文分析系统,每张切片在高倍镜下(×400)随机选取10个视野并摄像保存,采用IMAGE PRO PLUS软件设置阳性表达的宏程序,在同一条件下,分析不同组别IL-1β的含量,对阳性表达率进行组间比较。
1.3.4 扫描电镜检测细菌形态 采用棉拭子蘸取伤口脓性分泌物,并放入戊二醛中,形成菌液。将菌液吸入小离心管,离心后换入新鲜戊二醛固定。2.5%戊二醛2~4 h,磷酸缓冲液清洗3次,1%锇酸4~6 h,缓冲液清洗3次,乙醇梯度脱水,30%、50%、70%、85%、95%各 1次,100%乙醇2次,15~20 min/次,乙酸异戊酯置换2次,20 min/次。临界点干燥:普通定性滤纸裁成35 mm×18 mm的纸条,将长边35 mm平均分成3份,对折成小纸包,用订书钉将一端订牢,成小口袋状。将离心浓缩后的菌液滴入小纸包,立即用钉书器将另一端钉牢。放入临界点干燥器样品室,进行CO2临界点干燥。离子溅射金:沿两端书钉剪开滤纸包,将干燥后粉末状纯菌体倒入平皿,轻摇尽量分散菌体。碳导电胶带一面粘在1/4盖玻片上,另一面倒扣轻压在菌体粉末上,翻正后用镊子将菌体轻轻刮薄铺平。离子溅射金后,即可进行扫描电镜观察。
1.4 统计分析 以上研究数据,计量资料组间比较用方差分析,方差不齐采用非参数检验,以例数(N)、均数(Mean)、标准差(Std)、95%可信区间(95%CI)做描述性统计分析。计数等级资料用秩和检验,各组间整体比较检验水准α=0.05。显著性用P值表示,P<0.05为差异有显著性,P<0.01为差异有极显著性。采用SPSS17.0软件进行分析处理。
2 结果
实验过程顺利,前期造模及用药前新西兰白兔无死亡;后期实验过程中共死亡12只:空白组1只(原因不明考虑冻伤)、3只(腹泻),中药灌胃组2只(原因不明考虑冻伤)、2只(胃注致窒息),中药外敷组1只(原因不明考虑冻伤)、2只(腹泻)、1只(胃注致窒息)。
2.1 TLR-4表达情况 用药第24 h,3组TLR-4表达无明显差别;用药第48 h及用药第72 h,中药灌胃组及中药外敷组TLR-4表达较空白组明显升高(P<0.05),但中药灌胃组与中药外敷组TLR-4表达无明显差别(P>0.05),且用药第48 h TLR-4表达达到峰值。用药第10 d,3组TLR-4表达均回落,空白组TLR-4表达较中药灌胃组及中药外敷组高,中药灌胃组与中药外敷组TLR-4表达无明显差别(P>0.05)。见表1。
表1 3组动物TLR-4 Western blotting 检测结果比较()
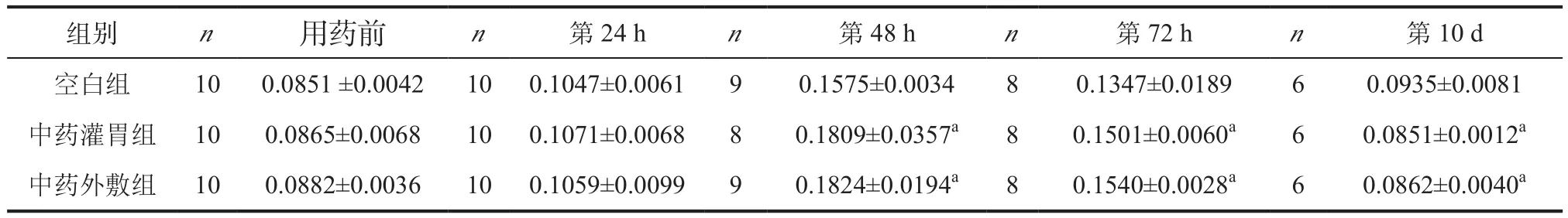
表1 3组动物TLR-4 Western blotting 检测结果比较()
注:与空白组同时间比较,aP<0.05;与中药灌胃组同时间比较,bP<0.05
组别 n 用药前 n 第24 h n 第48 h n 第72 h n 第10 d空白组 10 0.0851 ±0.0042 10 0.1047±0.0061 9 0.1575±0.0034 8 0.1347±0.0189 6 0.0935±0.0081中药灌胃组 10 0.0865±0.0068 10 0.1071±0.0068 8 0.1809±0.0357a 8 0.1501±0.0060a 6 0.0851±0.0012a中药外敷组 10 0.0882±0.0036 10 0.1059±0.0099 9 0.1824±0.0194a 8 0.1540±0.0028a 6 0.0862±0.0040a
2.2 TLR-4 灰度值检测及分析 用药前3组TLR-4表达无明显差异(P>0.05);用药后24 h,3组TLR-4表达均有所升高,但3组TLR-4比较表达无明显差异(P>0.05);用药后48 h,3组TLR-4表达较前明显升高,中药灌胃组、中药外敷组较空白组TLR-4升高存在差异(P<0.05),中药灌胃组与中药外敷组比较TLR-4表达无明显差异(P>0.05);用药后72 h,3组TLR-4表达较第48 h有所回降,但表达均仍高于用药前,中药灌胃组、中药外敷组较空白组TLR-4存在差异(P<0.05),中药灌胃组与中药外敷组比较TLR-4表达无明显差异(P>0.05);用药后10 d,空白组、中药灌胃组、中药外敷组TLR-4表达明显回降,中药灌胃组、中药外敷组较空白组TLR-4存在差异(P<0.05),中药灌胃组与中药外敷组比较TLR-4表达无明显差异(P>0.05)。见图1。
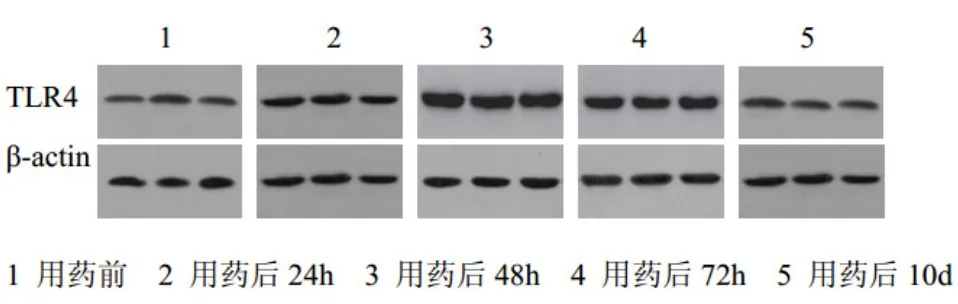
图1 TLR-4 灰度值检测结果
2.3 IL-1β免疫组化分析 用药第24 h,3组IL-1β表达无明显差别;用药第48 h及72 h,中药灌胃组及中药外敷组IL-1β表达较空白组明显升高(P<0.05),但中药灌胃组与中药外敷组IL-1β表达无明显差别(P>0.05),且用药第48 hIL-1β表达达到峰值。用药第10 d,3组IL-1β表达均回落,空白组IL-1β表达较中药灌胃组及中药外敷组高,中药灌胃组与中药外敷组IL-1β表达无明显差别(P>0.05)。见表2。
表2 3组动物IL-1β免疫组化检测结果比较()
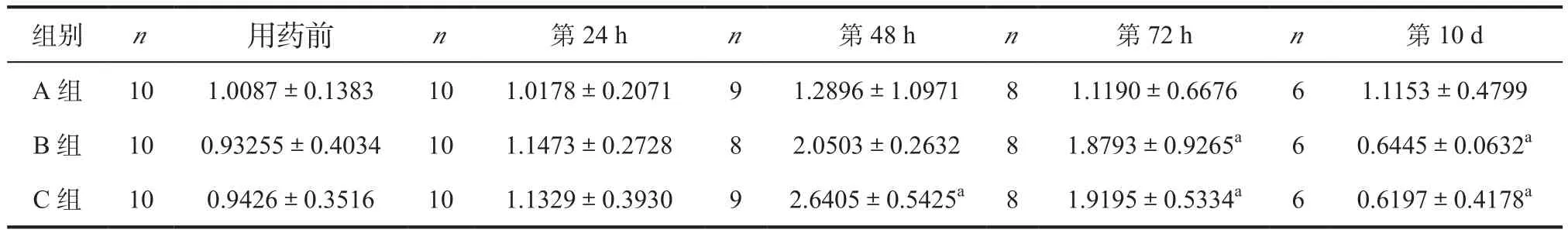
表2 3组动物IL-1β免疫组化检测结果比较()
注:与A组同时间比较,aP<0.05;与B组同时间比较,bP<0.05
组别 n 用药前 n 第24 h n 第48 h n 第72 h n 第10 d A 组 10 1.0087±0.1383 10 1.0178±0.2071 9 1.2896±1.0971 8 1.1190±0.6676 6 1.1153±0.4799 B 组 10 0.93255±0.4034 10 1.1473±0.2728 8 2.0503±0.2632 8 1.8793±0.9265a 6 0.6445±0.0632a C 组 10 0.9426±0.3516 10 1.1329±0.3930 9 2.6405±0.5425a 8 1.9195±0.5334a 6 0.6197±0.4178a
2.4 扫描电镜检测结果 30K电镜下鲍曼不动杆菌显示,实验原菌电镜图像(图3A)具有荚膜其外形呈圆形、卵圆形,细胞膜表面表面光滑,菌毛完整,单个、独立存在,细胞膜建构完整。空白组(图3B)鲍曼不动菌的菌株表面较光滑,菌毛完整,细菌菌体形态与对照比较没有明显变化,偶现单个细菌坏死,与周围菌体不粘连,考虑细菌自身代谢性衰亡。中药灌胃组(图3C)鲍曼不动杆菌菌体表面出现凹陷,细胞膜结构破坏,菌毛异常菌体之间形成粘液丝,相互粘连。中药外敷组(图3D)鲍曼不动杆菌可见菌体表面有类似皱褶样的凸凹不平,结构不完全,其外形不规则,伴有大量细菌坏死后的残余组织附着,菌体周围有大量粘稠物质,菌毛破坏。
5K电镜下鲍曼不动杆菌显示,实验原菌电镜图像(图4A)菌体非团簇状聚集,其细胞膜结构完整。空白组(图4B)菌体非团簇状聚集,其细胞膜结构完整。中药灌胃组(图4C),电镜下可见菌体之间相互粘连,菌体周围被粘液样物质包绕,相互密切粘连,成簇状,存在细菌破坏后残存组织粘连。中药外敷组(图4D)可见大量菌体呈团簇状坏死相互粘连,伴有大量菌体破坏后的残片,形成菜花样结构。
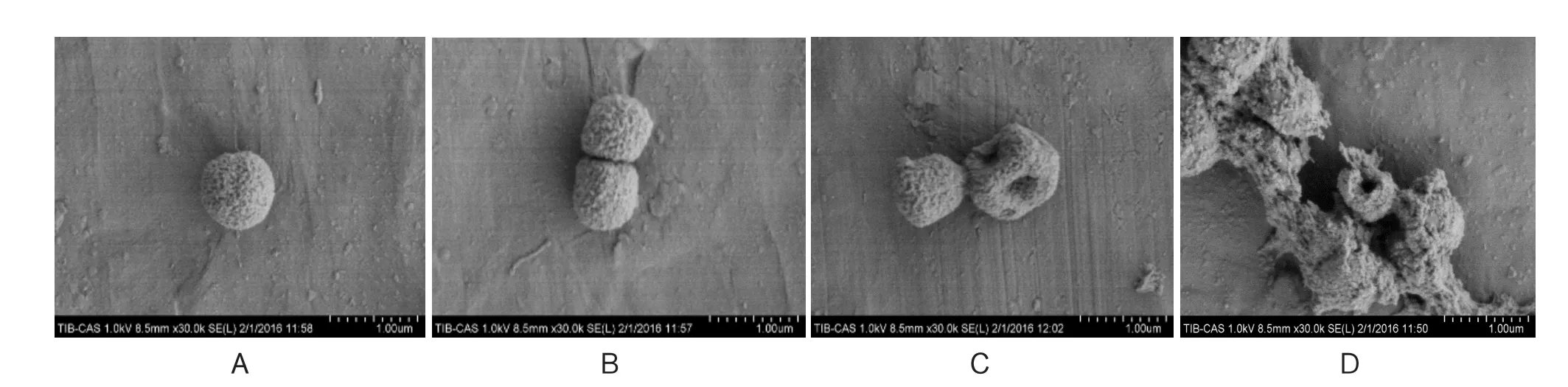
图3 30K电镜下鲍曼不动杆菌

图4 5K电镜下鲍曼不动杆菌
3 讨论
TLRs是一种模式识别受体,能够识别脂多糖、肽聚糖、酵母多糖及病原微生物的核酸等病原微生物进化中的保守分子,监测病原微生物的入侵并诱导机体免疫应答反应[4]。不同的TLR参与机体多种免疫防御,TLR是机体抗感染免疫的第一道防线,在启动早期天然免疫应答中至关重要[5]。TLR是联系天然免疫和获得性免疫的桥梁,对获得性免疫的发生和类型具有重要的调控作用[6]。TLR-4是介导内毒素、脂多糖应答的最主要受体[7]。TLR-4参与炎症反应的调节、细胞信号的转导、细胞凋亡中和组织纤维病变[8],TLR-4在免疫及炎症反应中有重要作用。TLR-4信号转导通路被激活后,可介导下游细胞因子TNF-α和IL-1β的分泌。当TLR-4的表达升高后,可将更多的活化信号传递到细胞内,促进细胞因子的分泌,参与机体的炎症反应。
IL-1β与许多的细胞活性相关,包括增殖、分化以及凋亡。研究表明IL-1β与炎症初始反应相关,起到调节因子的作用[9]。细菌的内毒素或者一些非细菌的炎症因子都会诱导IL-1β产生,然后被释放到局部组织,IL-1β含量升高表明机体内有组织损伤或者感染产生[10]。IL-1β活化后,可以诱导IL-2的释放、诱导成纤维细胞生长因子活性,通过这些影响可以刺激胸腺细胞增殖,进而影响机体的免疫反应。
中医药学认为,感染性疾病病机为机体正气虚损、邪毒内侵,常用治则为祛邪扶正[11]。当机体发生局部的损伤,皮破肉损会导致气滞血瘀、邪热郁结。中医常采用中药外洗方法来进行治疗[12]。丹黄消炎液成型于1997年天津市级科研项目《糖尿病足坏疽细菌学及中药外治的临床研究》,此研究发现,用药后丹黄消炎液对致病菌表现出显著的抑制作用,能有效改善创面红肿、减少脓腐、改善疼痛等[13]。丹黄消炎液组成为黄芪、丹参、皂刺、当归、银花、大黄、黄柏。诸药合用,针对疮疡营血不从逆于肉理蕴毒为患,共奏活血养血、泻热解毒、祛瘀生新之功。前期研究“十一五”国家科技支撑计划项目“糖尿病足溃疡期中医综合外治方案优化的多中心临床研究”中发现,中药丹黄消炎液对溃疡感染致病菌有显著的抑制作用,尤其是对某些泛耐药菌也有抑制作用[14-15]。
本研究发现,TLR-4、IL-1β在用药后48 h表达均明显升高,之后回降。用药后10 d空白组TLR-4表达明显高于中药灌胃组和中药外敷组。提示TLR-4、IL-1β的表达升高参与机体的炎症反应有关。用药后48 h,中药灌胃组、中药外敷组TLR-4、IL-1β表达均明显高于空白组,提示与丹黄消炎液干预有关。中药丹黄消炎液具有多组分的物质基础和多靶点的作用特性,可激活多种多糖作用的受体。实验表明,中药制剂丹黄消炎液外用于感染泛耐药鲍曼不动杆菌溃疡临床疗效良好,可能从抑制致病菌、调节局部免疫等诸方面共同作用的结果。
电镜检测结果显示,使用中药治疗后,中药灌胃组及中药外敷组细菌均大量坏死粘连,中药外敷组略优于中药灌胃组,其干预作用可能与用药途径有关。但不同剂型丹黄消炎液作用对TLR-4、IL-1β统计学未见明显差异,这可能与实验时间较短,实验动物数量有限有关。不同用药途径对丹黄消炎液作用是否有影响,何种途径效果更优,仍需大量的实验及数据支持,值得进一步研究。

