1例胎儿羊水过少的基因诊断及植入前诊断
丁红珂 余丽华 曾玉坤 刘玲 卢建 张彦 尹爱华
(广东省妇幼保健院 医学遗传中心、妇幼代谢与遗传病重点实验室,广东 广州 511442)
羊水过少是妊娠常见并发症,发病率约0.5%~5.5%[1],常见于妊娠晚期。在没有泌尿生殖系统结构异常的情况下,中孕期晚期超声检查显示羊水过少,应考虑肾小管发育不良(renal tubular dysplasia,RTD,OMIM:#267430)的可能[2]。RTD是一种以围产期死亡为主要特征的常染色体隐性遗传性疾病,是由于肾素-血管紧张素系统(renin-angiotensin system,RAS)的任何一种基因失活所致,其中血管紧张素Ⅰ转换酶(ACE)就是其中之一[3]。ACE是一种金属肽酶,属于谷胱甘肽金属蛋白酶家族[3]。人类循环和组织中的ACE水平部分由ACE基因多态性决定[4]。
在小鼠中,ACE基因完全失活是可存活的,而在人类则导致严重低血压、肾灌注不足和RTD,这是一种以出生时无尿或严重肾功能不全、缺乏肾近端小管分化和常见的围产期死亡为特征的严重肾脏疾病[5]。目前人类ACE基因突变的临床病例致病性报道比较有限。有报道称ACE基因的纯合突变或复合杂合突变会导致RTD的发生,临床表现主要为严重的羊水过少、出生时的肾功能不全及出生后短时间内的死亡[6]。在某些情况下,肾功能不全者需要出生之后的长期腹膜透析,例如发生Q1069R错义突变,导致ACE活性完全缺乏[7,8]。
本研究在1例两次妊娠均出现胎儿双肾回声增强、羊水过少的家系中,通过对核心家系的高通量测序发现胎儿ACE基因复合杂合突变c.1028G>A(p.W343*)和c.2948T>C(p.L983P),分别来自父母双方。其中c.2948T>C至今未在相关病例中报道过,为新发现的突变。2个位点在物种间均保守,其中c.1028G>A人群频率非常低,可导致蛋白截断,并在RTD病例中被报道过[6];c.2948T>C尚无人群数据,生物信息学预测为有害突变。针对发现的ACE基因突变该家系进行了PGD,植入不含有这2个突变的胚胎,并于妊娠18周抽取羊水进行基因确诊,证实胎儿未携带父母突变,同时超声监测也未发现胎儿羊水和肾脏的异常。据此判断,本研究发现的2个突变位点很可能就是导致胎儿异常的原因,扩充了ACE基因的突变谱。
1 对象与方法
1.1 研究对象 33岁孕妇,停经25+周时,外院超声发现胎儿双肾回声增强,羊水极度过少(最大羊水深度<20mm)来本院产前诊断中心就诊,分析胎儿预后不良可能,孕妇及家属决定终止妊娠,并对胎儿进行相关遗传学分析。既往史:曾因孕29周发现胎儿双肾回声增强、羊水过少引产1次。
1.2 方法
1.2.1 样本采集 经孕妇及家属知情同意,终止妊娠时抽取胎儿脐带血1ml及父母外周血2ml(EDTA-Na抗凝)进行相关遗传学检测,包括常规染色体及微阵列检测和必要时的高通量测序。PGD术后,孕18周时在超声引导下行羊膜腔穿刺术抽取胎儿羊水5~8ml,羊水DNA提取使用德国Qigen公司生产的Qiamp DNA Blood Mini Kit提取试剂盒进行基因组DNA提取。
1.2.2 染色体核型分析 采用G显带制备技术对脐血及外周血进行常规G显带(500~550条带)检测。
1.2.3 染色体微阵列分析(CMA) 使用美国Affymetrix公司生产的CytoScan 750k芯片和扩增、杂交试剂盒进行CMA检测。参照Infinium HD Assay标准操作流程进行操作,检测结果使用Chromosome Analysis Suite(Ch AS;version 2.1)软件进行分析。结果判读参照DGV、ISCA、OMIM、DECIPHER等数据库。
1.2.4 高通量测序 进行医学外显子(目前与人类疾病相关的4000个基因)父母胎儿(第二胎)核心家系高通量测序,包括50 584个编码区对应8 421 879个碱基,包含外显子与内含子交界区。使用HiSeq2000测序仪(Illumina, Inc., San Diego, CA)。
1.2.5 Sanger测序 针对高通量测序发现的疑似致病位点进行一代验证。同时该方法也用于PGD术后胎儿羊水DNA检测确定基因型。
1.2.6 序列比对 参考序列数据来自UCSC Genome Browser(http:∥genome.ucsc.edu)数据库,序列版本号:GRCh37/hg19。
1.2.7 植入前诊断 第二次妊娠异常胎儿发现基因突变后,告知单基因病致病位点意义不明确的相关遗传学再发风险,家属要求进行PGD。首先针对父母及第二次有问题的胎儿进行家系单倍型构建,以ACE基因(NM_000789.3 chr17:61554422-61575741 正向转录)编码区为目标区域,并在基因上下游选择若干SNP位点作为遗传标记,高通量测序,检测SNP 位点基因型,选择其中相应位点构建单体型,进行连锁分析。通过分析父母来源的疑似致病位点单倍型间接判断胚胎基因型,选择未携带父母疑似致病位点的胚胎移植。移植成功后,孕18周行羊膜腔穿刺进行基因确诊。
2 结果
2.1 常规遗传学检测 第一胎外院检测提示胎儿染色体、比较基因组杂交(CGH)结果未见异常,未做进一步基因检测。第二胎胎儿脐血染色体核型及染色体微阵列分析未见异常。
2.2 高通量测序及致病性分析 父母胎儿(第二胎)外显子测序发现胎儿ACE基因(NM_000789.3)复合杂合疑似致病突变c.1028G>A(p.W343*,rs200225958)和c.2948T>C(p.L983P),分别遗传自父亲(c.1028G>A)和母亲(c.2948T>C)。其中c.1028G>A位点,数据库收录的人群频率为:A=0.0002/1 (1000 Genomes)和A=0.00002/3 (TOPMED)。该位点突变属于无义突变,可导致第343位氨基酸密码子变为终止密码子,从而使肽链合成提前终止,最终形成比野生型蛋白少了963个氨基酸的截断蛋白,预测可严重影响蛋白功能。c.2948T>C位点数据库未见报道,该位点变异属于错义突变,可导致第983位氨基酸从亮氨酸(L)变为脯氨酸(P),生物信息学软件预测提示为有害突变(http:∥provean.jcvi.org/index.php)。
2.3 一代验证 分别针对ACE基因c.1028G>A和c.2948T>C位点进行父母胎儿的Sanger测序(图1)提示,胎儿复合杂合,父母均为杂合携带。
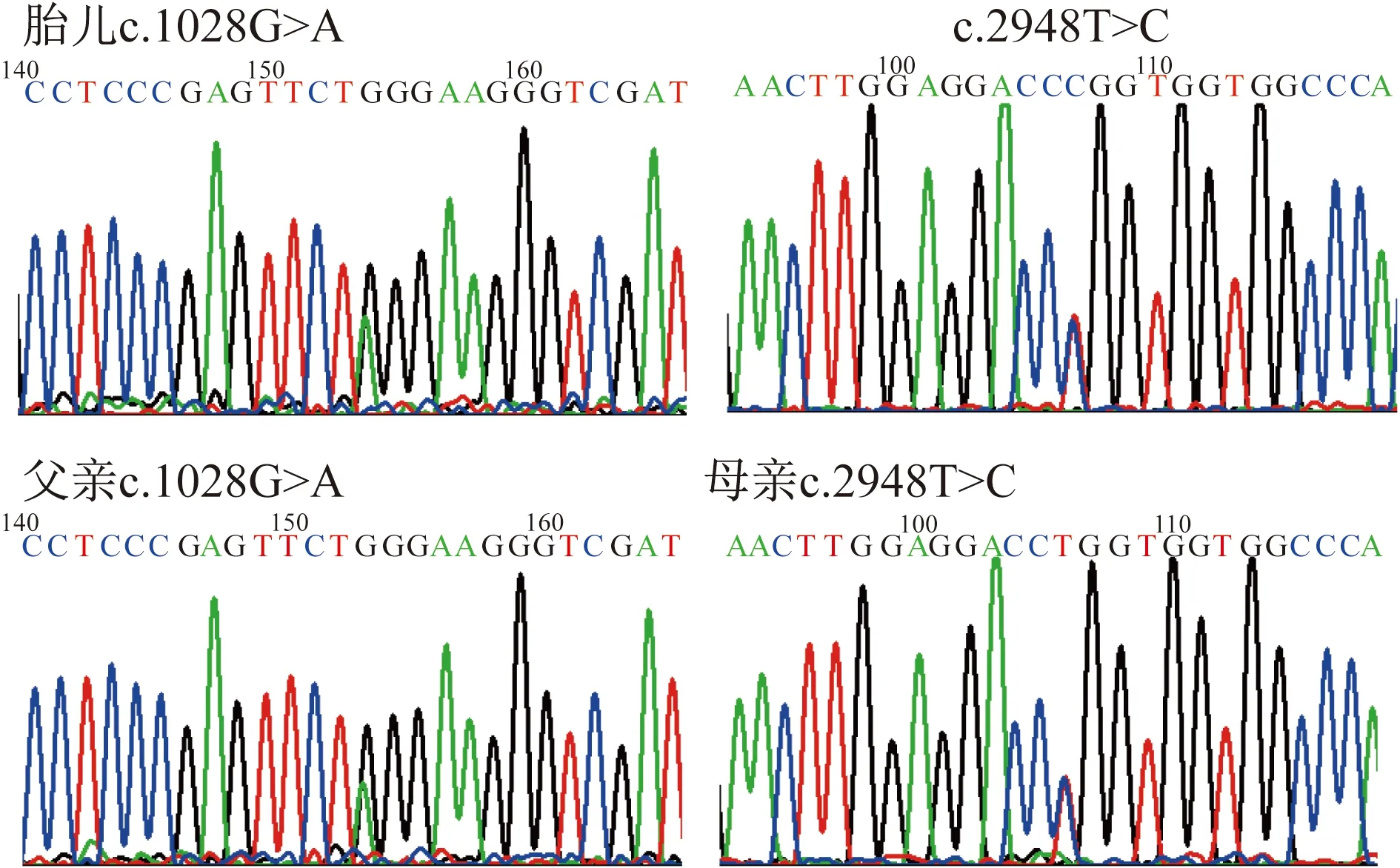
图1 家系一代验证测序图
2.4 位点保守性分析ACE基因c.1028G>A和c.2948T>C位点的物种间较保守性序列比对(图2),提示两位点在不同物种间高度保守。

图2 物种间保守性序列比对
2.5 PGD术前单倍型构建 选取其中8个ACE基因上下游SNP位点进行单倍型图绘制(图3,其余SNP位点未显示),红色(GCCTCTGT)和紫色(GCCTCTGT)分别代表来自父亲和母亲的致病单倍型。选取不含GCCTCTGT单倍型的胚胎植入(胚胎单倍型未画出)。

图3 家系单倍型构建
2.6 PGD术后胎儿羊水DNA检测 第三次妊娠胎儿未携带父母双方的疑似致病位点(图4箭头所指)。超声监测未发现胎儿肾脏和羊水量异常。
3 讨论
本研究在1例超声提示肾脏增大、羊水严重过少的胎儿中检测到ACE基因复合杂合变异,分别遗传自父母双方,符合常染色体隐性遗传规律。发现的c.2948T>C变异位点未见与疾病相关性报道,为本次研究新发现的变异位点,通过生物信息学及家系遗传学分析提示可能与疾病相关。在告知了单基因病致病位点意义不明确的相关遗传学风险之后,家属要求进行PGD,并对PGD术后妊娠胎儿进行基因检测,提示未携带父母双方变异位点,且超声未见肾脏和羊水量的异常情况,间接提示本研究发现的位点很可能就是导致该家系第一胎和第二胎发育异常的原因。
RAS表达于人类肾脏发育的早期,人类早在孕30~35天时就能检测到ACE及其他组成部分[9-11]。RAS在人类肾脏发育中的作用进一步被遗传性RTD的报道所证实,RAS组分中的任何一个主要基因失活均可能导致RTD[5]。Gribouval等[6]报道了17个RTD家系,其中由7个不同的ACE基因突变引起的RTD病例中,除1例外所有病人均有严重的羊水过少及出生后几小时内死亡,其中9个病例是ACE基因的纯合突变,3个病例是复合杂合突变。存活的个体出生时出现羊水过少和严重的肾功能不全(血浆肌酐为370 mmol/L),后肾功能出现自发性恢复,在出生后3周内血肌酐处于正常范围(45 mmol/L)[6]。本研究家系两次妊娠均出现胎儿羊水过少的情况,符合RTD的胎儿期临床表现,因胎儿均被引产未出生,无法准确评估胎儿的肾功能,且两次引产的胎儿家属拒绝行尸解及病理检测,我们并未了解胎儿肾小管发育情况,但根据超声提示胎儿双肾回声增强,不排除存在肾小管发育不良的可能,因为肾小管发育不良的个体中会有一部分病例表现为超声下肾实质回声增强[12]。该家系两次妊娠均表现为羊水过少,且超声未发现胎儿肾脏的明显结构异常,提示RTD可能性大,现有临床表现符合RTD文献描述。
本次实验发现的两个变异位点,c.1028G>A属于无义突变,已在RTD病例中被报道,在一个土耳其家系中发现该位点纯合突变,在一个挪威家系中发现了该位点与其他位点的复合杂合突变[6]。该突变可以使肾素表达明显增加,这可能是由于ACE的功能缺乏,以及血管紧张素Ⅱ的产生及其对肾素产生的负性调控所致[6]。c.2948T>C为错义突变,尚无人群频率数据, L983P 位于ACE 蛋白的C端

图4 植入胚胎产前诊断
结构域(L613-P1193),且距离催化中心位置(H959-H963)[3]非常近,推测L983P可能通过空间构象的改变影响ACE蛋白的催化功能,但以上两个变异位点如何真正影响蛋白功能仍需要进一步的功能验证和分析。

