躯干结合部严重创伤的院前止血技术进展
沈 岩
创伤导致的大出血是仅次于严重脑损伤的第二位创伤致死原因, 56%~87%的创伤患者由于大出血没能获得及时有效救治而死于院前,其中80%~90%因出血致死的创伤患者院前如果能获得及时恰当的处置是可以避免死亡的[1]。创伤后大出血导致的病死率也与救治时间密切相关,每耽搁3min可增加1%的病死率,约25%的战伤伤员死于送往医院的途中[2-3]。因此,院前有效控制或减缓活动性出血对降低院前病死率和赢得送往救治医院时间具有极其重要的作用。四肢、浅表头颅、鼻咽部的活动性出血一般通过压迫或止血带的应用容易得到控制,如能联合应用各种止血材料(止血粉、止血纱布等)可提高止血效能;但胸腹腔、腹盆股结合部、胸肩颈结合部等躯干部的大出血院前很难通过简单的压迫或止血带得到有效的控制。如何有效控制或延缓躯干部活动性大出血是降低院前病死率和赢得送往救治医院时间的关键,更是院前创伤救治的巨大挑战。躯干部的止血往往需要专业人员或经过专业培训人员和特殊设备才能实施,但目前能被采用的能成功对躯干部出血实施院前控制的措施非常有限,尽管有院前利用骨盆限制性包绕带、结合部止血带、复苏性主动脉腔内球囊阻断术和体外近端腹主动脉压迫术等技术成功救治躯干结合部创伤大出血的案例[4-6],但其能否显著降低院前创伤病死率、是否具备临床广泛推广性、各种技术的优缺点仍有待于大量的实践验证。本文就目前针对腹盆股结合部创伤大出血的院前止血技术的进展进行概括分析。
1 腹盆股结合部止血带(junctional tourniquet)的应用
腹盆股结合部是指躯干与下肢连接部,包括骨盆区、臀部、腹股沟区、会阴部。有研究显示,创伤患者院前8.2%~17.5%的死亡源自结合部大出血[7]。由于结合部创伤大出血难以通过简单的压迫和肢体止血带控制,一直是院前创伤救治中的难点和挑战。针对躯干结合部创伤而设计的结合部止血带的应用为院前控制腹盆股结合部创伤大出血提供了一种选择,其原理是通过止血带上特有的压迫装置对结合部受损血管产生稳定持续的机械压力,从而阻止或减少创伤区域活动性出血。迄今为止,结合部止血带的临床应用均为个案报道,且多为军事现场,更多的研究成果来自志愿者、智能模具或动物实验,但多数研究结果显示结合部止血带能有效地控制腹盆股结合部大出血,若与止血敷料联用则可提高止血效果。目前研究和报道较多的是美国FDA批准应用的4种结合部止血带,分别是:CRoCTM(Combat Ready Clamp)、JETTTM(Junctional Emergency Treatment Tool)、SAM-JTTM(SAM-Junctional Tourniquet)和AAJTTM(Abdominal Aortic Junctional Tourniquet)(表1,图1)。上述4种结合部止血带均有院前成功救治腹盆股结合部大出血患者的报道,既有战场案例,也有非战场案例,受救者使用结合部止血带后,活动性出血得到了有效的控制,从而赢得了等待救援和转运的时间。4种结合部止血带对骨盆均有固定作用,有助于减少骨盆骨折引起的活动性出血。CRoCTM仅能实施单侧腹股沟区止血, JETTTM和SAM-JTTM均能实施双侧腹股沟区止血,而AAJTTM还可以通过阻断腹主动脉控制整个骨盆区、盆腔内、双侧腹股沟区和下肢的活动性出血。4种结合部止血带的应用均比较容易掌握,经过简单训练后,单人均可在2min内完成安装和止血过程。Tovmassian等[4]报道应用CRoCTM在救治1例大腿根部截断的患者时,仅耗时90s便通过压迫腹股沟区血管成功控制了大出血;Gates等[8]报道在一项尸体模型研究中,应用JETTTM只需10s就能完成双侧腹股沟区动脉的阻断。但这4种结合部止血带也存在不足,如CRoCTM在移动伤者时容易发生移位,影响压迫止血效果;其余3种则存在牢度不够、压迫时间不宜过久、缺血再灌注损伤、下腔静脉受压影响血液回流(AAJTTM)等。临床研究结果建议,AAJTTM压迫时间应<1h,其余设备压迫时间<4h,长时间使用AAJTTM有可能导致肠管缺血坏死、皮肤坏死等风险。除AAJTTM一般孕妇、腹主动脉瘤禁用,穿透伤慎用[9-10]外,其他结合部止血带无明显禁忌证。虽然结合部止血带的成功运用报道多数为个案,缺少广泛的临床实践验证,但通过不断完善结合部止血带、规范化应用培训,在救治腹盆股结合部大出血时,选择结合部止血带不失为一种操作方便且有效的暂时性止血手段。

表1 结合部止血带的研究现状
2 复苏性主动脉腔内球囊阻断术

图1 四种结合部止血带
复苏性主动脉腔内球囊阻断术(resuscitative endovascular balloon occlusion of the aorta,REBOA)是通过穿刺技术将球囊导管置入主动脉内,利用充盈的球囊达到阻断主动脉血流的目的。1954年Hughes[11]首次描述了应用该技术在朝鲜战争期间于手术室内成功救治了1例腹内大出血伤员,此后该项技术陆续被成功应用在腹主动脉瘤破裂出血、产后大出血、上消化道大出血、盆腔手术大出血等临床救治实例中。REBOA在创伤救治中的应用起初并没有引起广泛关注,1989年Gupta等[12]研究发现REBOA在救治21例腹部穿透性损伤中虽有一定的效果但存在较多严重的并发症(主要是脏器缺血性损害、穿刺部位动脉并发症、导管并发症等)。但随着REBOA技术的不断实践和改进,REBOA在骨盆严重创伤、腹部钝性创伤导致难以控制的大出血救治中不乏取得高成功率的报道,如Ogura等[13]报道应用该技术在救治腹部创伤大出血患者中获得86%的止血成功率。目前认为REBOA技术为骨盆严重创伤、腹部钝性创伤难以控制大出血患者争取到时间实施动脉栓塞止血或手术止血起到了关键的桥梁作用。2014年前所有REBOA的临床研究均在医院内实施。2014年伦敦直升机急救医疗机构(HEMS)首次报道了院前运用REBOA成功控制了1例因骨盆骨折导致的大出血,使其得以有时间转运至救治医院[6]。这为院前控制腹内出血或腹盆股结合部大出血提供了又一种技术选择。院前实施REBOA在技术上是可行的,只要具备动脉穿刺技术、合适的球囊导管和专业培训人员即可实施。理论上只要球囊能顺利进入主动脉,则可以通过阻断不同的主动脉区域控制腹腔内、腹盆股结合部和双下肢难以控制的大出血。根据不同部位出血控制的需要,主动脉球囊阻断部位可分为3区(Ⅰ区:左锁骨下动脉和腹腔动脉间;Ⅱ区:腹腔动脉和肾动脉间;Ⅲ区:肾动脉以下。图2)。球囊置于Ⅰ区可达到控制全腹腔内所有脏器出血、腹盆股结合部和双下肢大出血的目的;球囊置于Ⅲ区可达到控制腹盆股结合部和双下肢大出血的目的。院前急救要求分秒必争,快速建立动脉通道、成功置入球囊导管对控制大出血非常重要,为此,2015年美国FDA批准应用的ER-REBOATM球囊导管置管时无需导丝引导,导管上有长度标记,可提高院前快速置管效率。熟练掌握血管介入技术的专业人员可在短时间内完成REBOA技术。 Brenner等[14]报道在急诊室只需花费4~6min便可快速实施REBOA;有研究表明,经过REBOA专门课程训练的学员,可在2min内完成建立动脉通道、置入球囊和完成球囊充气步骤。院内REBOA球囊位置往往在透视下完成定位,2010年Martinelli等[15]首次报道了无需利用透视设备为13例骨盆骨折伴休克患者成功实施REBOA,也为院前实施REBOA提供了技术可行性,球囊位置和血流阻断程度的判断也可以在创伤现场通过超声造影来确定。REBOA的不断改进为院前抢救腹内或腹盆股结合部难以控制的大出血提供了技术可能性。虽然REBOA有成功院前救治的案例,但其与体外近端腹主动脉压迫术、AAJTTM比较是否具有止血优势、何种阻断方式(完全阻断或不完全阻断)、合理的阻断时间、超声定位球囊位置和确定阻断效果的可靠性等方面均有待进一步确定。此外,院前实施REBOA也存在缺陷,如需要专业医生和专业设备,一般的救治培训人员无法完成,这就有一个等待救援过程,而且目前国内绝大多数救护车上不配备REBOA救治包、彩超设备,救护人员多不具备REBOA和超声技术,因此院前REBOA的推广在技术层面上难度最大、要求也最高。而且院前REBOA的研究均来自临床前研究,主要是动物研究,其研究结果是否适合创伤人群、相对安全的阻断时间、并发症的发生率等也有待于实践观察。随着REBOA设备的不断改进、院前流程的制定和不断优化、接受专业训练的救治人员的发展,针对骨盆严重创伤、腹部钝性创伤难以控制大出血患者实施院前REBOA救治是一项充满希望和前途的选择,其可为患者赢得送往救治机构实施动脉栓塞和手术确切止血的时间和机会。
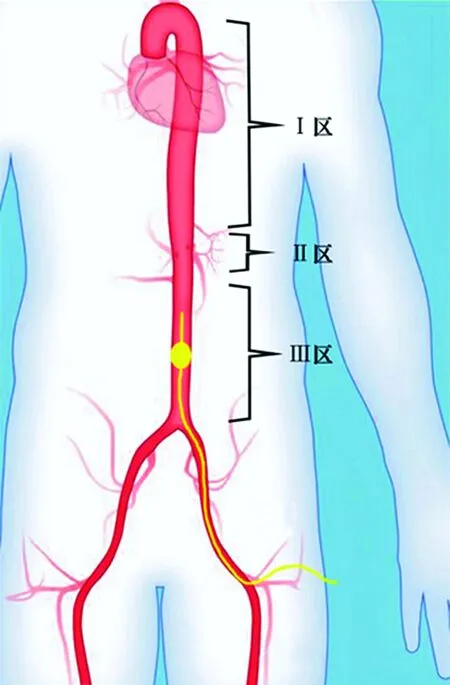
图2 REBOA的应用分区
3 体外近端腹主动脉压迫术
体外近端腹主动脉压迫术(proximal external aortic compression,PEAC)是在脐部略上方处利用外力压迫腹主动脉以阻断腹主动脉血流,以控制或延缓腹盆股结合部及双下肢的活动性出血。外力压迫可以通过救援人员手压(manual-PEAC,m-PEAC,图3),也可利用气压设备(device-PEAC,d-PEAC,图4)实施。该技术适用于盆腔内、腹股沟区、双下肢动脉性大出血。1997年Keogh等首次报道了通过压迫阻断腹主动脉血流成功救治了1例产后大出血的患者;2002年Kin等[16]应用该技术成功救治了1例腹主动脉瘤破裂患者。Douma等[6]2014年首次报道了1例腹盆股结合部多发性枪伤患者采用PEAC技术成功控制活动性出血,进而赢得时间送往急救机构。由于创伤发生时往往缺少必要的医疗救治设备和专业人员,因此,无需特殊设备的m-PEAC技术在腹盆股结合部动脉性大出血中成为越来越多被关注的救治手段。Douma等[17]通过一项志愿者的临床前研究得出结论:m-PEAC技术培训后易掌握,足够压力下主动脉阻断效果确切,适用于静止和质硬场地,体重大者效果更好等,但不适用于运动的救护车上。有研究显示,有效阻断腹主动脉血流需要36~64kg的压迫重力或103.5~114mmHg的压力[18]。有效应用m-PEAC有较多的影响因素:施救者训练与否、施救者体重、待救者肥胖程度、场地等。施救者体重较轻则较难达到足够的阻断压力,此时需要施救者将上身完全置于被救者伸直的上肢上方以增加压力,必要时可采取单膝跪压方法以获得持续足够的压力。m-PEAC技术与心肺复苏时的胸外按压有相似的操作要点,具有能迅速现场实施、无需设备、操作方便、易于掌握、无需花钱的优势。但由于施救者长时间施压容易疲劳,且在移动患者时或在行驶的救护车上无法获得有效的阻断效果,因此,当需要较长时间的等待或转运时将m-PEAC转换成d-PEAC是合理的。带有气囊的AAJTTM和类似的EI-Minia主动脉压迫装置(EACD)可以通过气囊持续稳定地压迫腹主动脉,从而发挥控制腹盆股结合部活动性出血的作用。
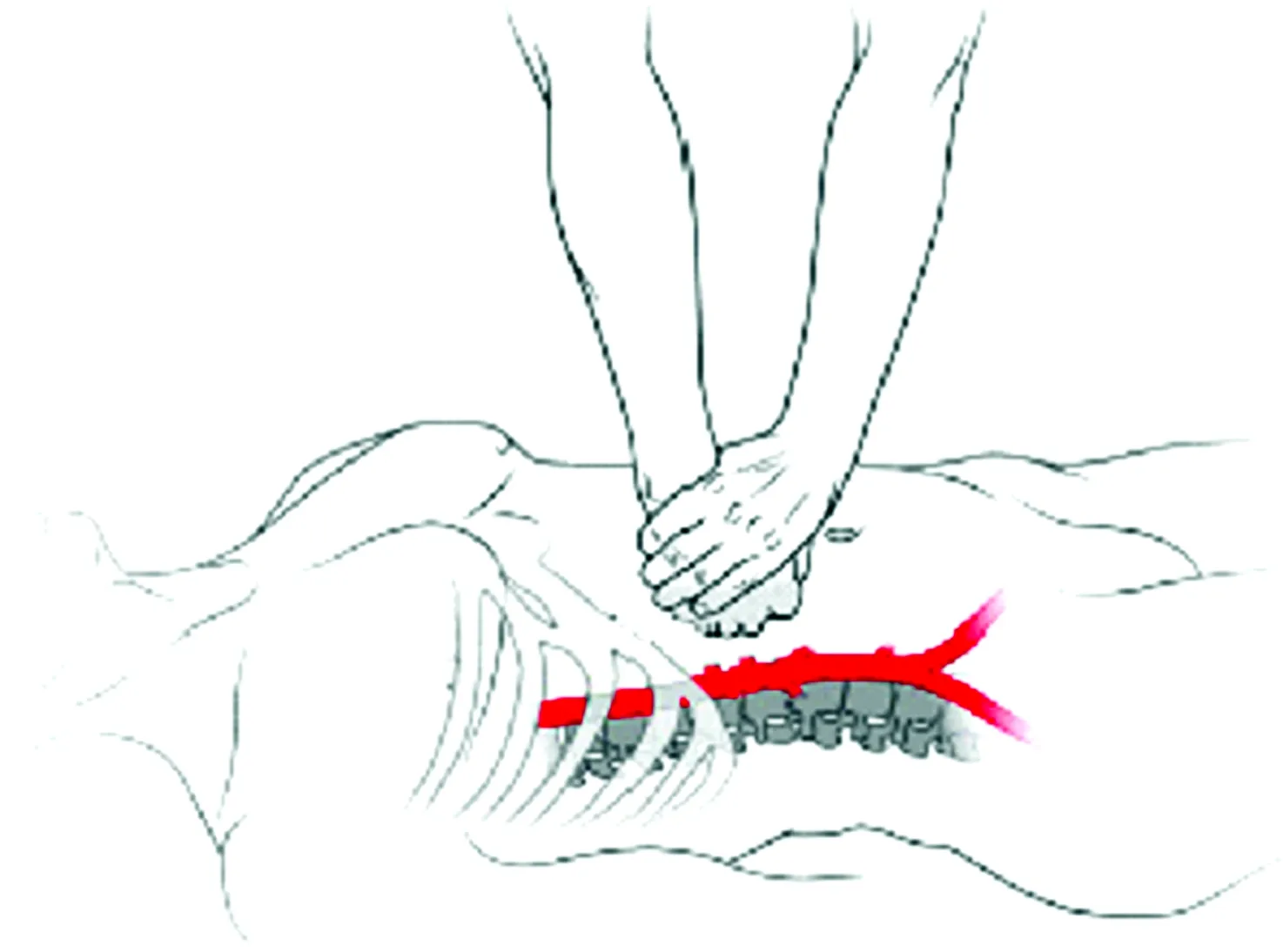
图3 m-PEAC示意图

图4 d-PEAC示意图
选择m-PEAC还是d-PEAC应视具体情况而定,当创伤现场没有医用设备可用或需要等待医疗救援时应即刻应用m-PEAC技术,为等待救援赢得时间;一旦专业救援到场,应替换成d-PEAC或AAJTTM,便于在转运患者或救护车运送时保持腹主动脉有效的压迫控制。但d-PEAC的应用也可导致一些不良反应,如加重腹腔内高压、限制呼吸、内脏缺血性损害、受压皮肤坏死等,因此应用时持续时间应<1h。但Soltan和Sadek[19]报道应用EACD持续时间在2.5h内未发生严重的并发症。PEAC技术虽然已有成功的院前救治案例,但毕竟缺乏大量的临床实践,也存在较多的影响因素,这些因素既来自施救者,也来自创伤患者,因此需要不断优化PEAC技术和流程,在缺乏专业救治设备情况下,其不失为一种对腹盆股结合部难以控制大出血实施紧急救治的方法,为等待专业救治或转运赢得时间和机会。Douma等[17]建议针对躯干结合部难以控制的大出血可实施以下救治模式:第一步:紧急实施m-PEAC;第二步:紧急呼叫救援系统;第三步:m-PEAC更换成d-PEAC或AAJTTM或REBOA;第四步:紧急转运至救援机构;第五步:院内确切止血。
腹部及腹盆部创伤后危及生命的大出血往往不能通过简单的压迫或止血带得到控制,如何通过有效的措施控制或延缓出血,为患者赢得送往医院的时间,是院前救治中的极大挑战。在有限的院前止血措施中,尽管存在各种各样的缺陷和不足,结合部止血带、REBOA、体外腹主动脉压迫术等仍有院前成功救治腹部和腹盆股结合部难以控制大出血的临床案例,这些技术通过不断改进和完善流程、因地制宜选择应用,不失为躯干结合部严重创伤大出血院前止血措施的合理选择,其是否具有临床推广性还有待于今后更多的临床实践。

