生物活性炭工艺对二氯乙腈生成势去除机理
颜 勇,谭怡雯,林 涛
(1.江苏长江水务股份有限公司,江苏扬州 225009;2.河海大学环境学院,江苏南京 210098)
为保障饮用水水质以实现饮用水安全,出厂前必须进行消毒以灭活水中的微生物。因为其成本较低、工艺成熟且消毒效果令人满意,给水厂消毒形式普遍采用氯化消毒,但随之而来的是各类消毒副产物。1974年和1976年研究发现氯化消毒后会形成三卤甲烷(THM)[1-2],随后在20世纪90年代,又发现了致突变、致畸和致癌作用更强的卤乙酸(HAA)[3]。近来,种类更多、毒性更大的含氮消毒副产物(nitrogenous disinfection by-products,N-DBPs)逐渐被研究发现[4]。
在饮用水中经常被检测到的一种重要N-DBPs是卤代乙腈(HANs),卤代乙腈易溶解于水,并通过饮用水进入人体。在加氯消毒后的自来水中,以二氯乙腈(DCAN)的检出率和浓度最高。在多个美国饮用水处理厂出水中,DCAN中位数高于4 μg/L[5]。在韩国的一些水厂出水中,DCAN经常被报道超过40 μg/L[6]。而根据世界卫生组织,DCAN的临时指导值为20 μg/L,美国环境保护局给出DCAN的终生非癌症参考剂量为8 μg/(kg·d)。相比于THMs和HAAs,DCAN及其他HANs具有更强的细胞毒性和基因毒性,除“三致”作用外,还会严重降低细胞密度,更会造成DNA损坏[7]。
一般来说,常规水处理过程对N-DBPs前体物去除率并不高[8-10],在20%到40%左右,这是因为常规水处理工艺对溶解性有机氮(DON)的去除率不高,而N-DBPs的前体物是DON的重要组成部分。而深度处理工艺被普遍认为是一种有效的去除DBPs前体物的一种工艺[11-12]。
本研究以太湖水源为依托,以苏州A水厂为研究对象,依据生物活性炭滤池前后的水质特点,结合分子量分布研究活性炭对DCAN的去除效果和DCAN生成势的去除规律和机理,为强化水厂对DCAN的控制提供理论支持。其中活性炭滤池有两种,一种是使用2年的A活性炭滤池(以下简称A炭池),另一种是使用4年的B活性炭滤池(以下简称B炭池)。
1 材料与方法
1.1 试验水样
选取以太湖贡湖湾为水源地的A水厂为试验基地,水样为该水厂的过程水。原水水质基本符合Ⅲ~Ⅳ类水体标准。A水厂所用混凝剂为聚合硫酸铝,投加量为60 mg/L。臭氧投加量为1 mg/L,炭滤池颗粒活性炭层高1.5 m,反冲洗周期为11 d。水样采用1 L的棕色广口瓶取得,为去除颗粒物对检测结果的干扰,用0.45 μm的水性微滤膜过滤,滤后水保存在4 °C的环境中备用。
1.2 测定指标与方法
在检测指标时,按照同样条件测定三次,最后结果取平均值。
1.2.1 二氯乙腈生成势
DCAN生成势测定采用充分氯化的方法[13]。氯化前,首先将水样通过0.45 μm的水性微滤膜过滤。消毒剂采用次氯酸钠溶液(氯浓度=20 000 mg/L),有效氯投加量如式(1)。
C=3C1+7.6C2+10
(1)
其中:C—Cl2投加量,mg/L;
C1—DOC,mg C/L;
C2—NH3浓度,mg N/L。
加氯后充分混合,用NaHCO3缓冲液将溶液调节至pH值=7,在20 ℃避光保存24 h,随后加入抗坏血酸(2 mmol/L)脱去水样中的余氯,并用0.1 mol/L HCl和NaOH将水样pH值调节到4~6,保证DCAN稳定不易水解。随后取水样100 mL加入10 g无水硫酸钠,液液萃取法富集水样中的DCAN,萃取剂为甲基叔丁基醚。DCAN检测采用Varian CP3800气相色谱-电子捕获检测器(GC-ECD),DB WAX色谱柱(30 m×0.32 mm×0.25 μm),初始炉温40 ℃,保持5 min,30 ℃/min速率升温至190 ℃,保持4 min;ECD检测器温度为300 °C;进样口温度为250 ℃;分流比为2,载气为氮气,流速为2 mL/min。使用该种检测方法,检测限低至0.1 μg/L,精度为0.01 μg/L。
1.2.2 DON
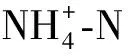
CDON=C3-C4-C5-C6
(2)
其中:CDON—DON浓度,mg/L;
C3—TDN浓度,mg/L;
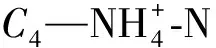
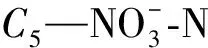
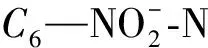
1.2.3 游离氨基酸、氨基糖、多糖和蛋白质
采用气质联用法检测水中20种基本氨基酸和氨基糖,无需柱前衍生。水样过0.45 μm的水性微滤膜过滤后取600 μL,加入600 μL乙腈涡旋混匀,13 200 r/min离心5 min,取1 000 μL上清液进样检测。
色谱条件为:BEH Amide色谱柱(100 mm×2.1 mm×0.5 μm),柱温为50 ℃,进样量1 μL,流动相A为Milli-Q级水(0.1%甲酸),流动相B为乙腈(5 mmol/L乙酸铵、0.1%甲酸)。各氨基酸和氨基糖检测限在1 ng/L左右,回收率在92%~110%,线性关系和检测精度好。
多糖和蛋白质检测分别采用苯酚-硫酸法[14]和改良的Lowry方法[15]。
1.2.4 高通量宏基因组微生物测序
对生物活性炭池中的微生物采用高通量宏基因组微生物测序进行研究,取生物活性炭池表层下10~15 cm下的活性炭50 mg,加入适量的1×细胞培养添加剂(PBS)溶液强烈震荡,取适量上清液12 000 r/min离心2 min,留取沉淀物进行提取。DNA提取采用OMEGA试剂盒E.Z.N.ATMMag-Bind Soil DNA Kit(D5625-01),然后进行两轮PCR扩增后,对回收的DNA精确定量,上机测序浓度为20 pmol,在MiSeq测序系统进行检测。
在对微生物进行测序时,覆盖率是指测序产出的数据覆盖到目标基因组上的比例,香农指数和辛普森指数分别通过个体的不确定性和随机两个个体不同种来反映测量群落的异质性,这两个指数越高,生物多样性越高。两个指数的计算如式(3)和式(4)。
(3)
(4)
其中:H—香农指数;
D—辛普森指数;
S—种数;
Pi—群落中第i种的个体比例,如第i种个体数目为ni,总个体数为N,则Pi=ni/N。
1.2.5 活性炭吸附值、生物量和生物活性的检测
从炭池取10 g活性炭经过充分灭菌后分别与标准浓度的碘溶液和亚甲蓝溶液混合,待吸附完全后,测定剩余溶液的浓度从而计算吸附值。生物膜的生物量以细胞中三磷酸腺苷(ATP)含量计。ATP检测采用BacTiter-GloTM微生物细胞活性检测试剂盒(Promega, USA)。生物活性是以生物量呼吸潜力为特征测量的,采用Urfer等[16]提出的的BRP(biomass respiration potential)法。
2 结果与讨论
2.1 生物活性炭工艺对二氯乙腈生成势的去除
为探究BAC工艺的去除效果,在2017年6月~12月对臭氧后出水、A炭池和B炭池出水进行DCAN生成势检测,结果如图1所示。总体上来看,无论是A或B炭池,出水中DCAN生成势夏季要高于冬季。DCAN的前体物主要是溶解性有机氮(DON),而太湖存在着富营养化和蓝藻的问题,在夏季藻类繁殖,产生大量的代谢产物,导致了较高的DON和DCAN生成势。
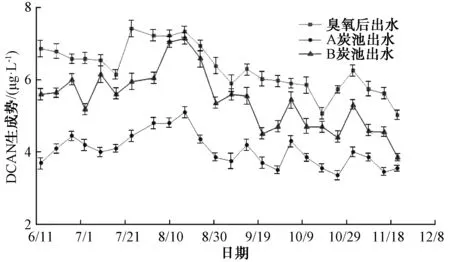
图1 臭氧氧化后A与B炭池出水中的二氯乙腈生成势Fig.1 DCAN FP in Effluent of Ozonation from A and B BAC Filters
A炭池对DCAN生成势的去除率为29.28%~46.06%,平均去除率35.85%,然而,B炭池对DCAN生成势的去除效能明显低于A炭池,在个别取样时间几乎没有去除效果,B炭池对DCAN生成势的去除率为2.35%~25.25%,平均去除率仅为14.22%。原水中DCAN生成势在8.44~9.47 μg/L,常规水处理工艺对DCAN生成势去除率为19.78%,臭氧工艺结合A炭池总的DCAN去除率平均为40.56%,臭氧工艺结合B炭池则平均为18.93%。
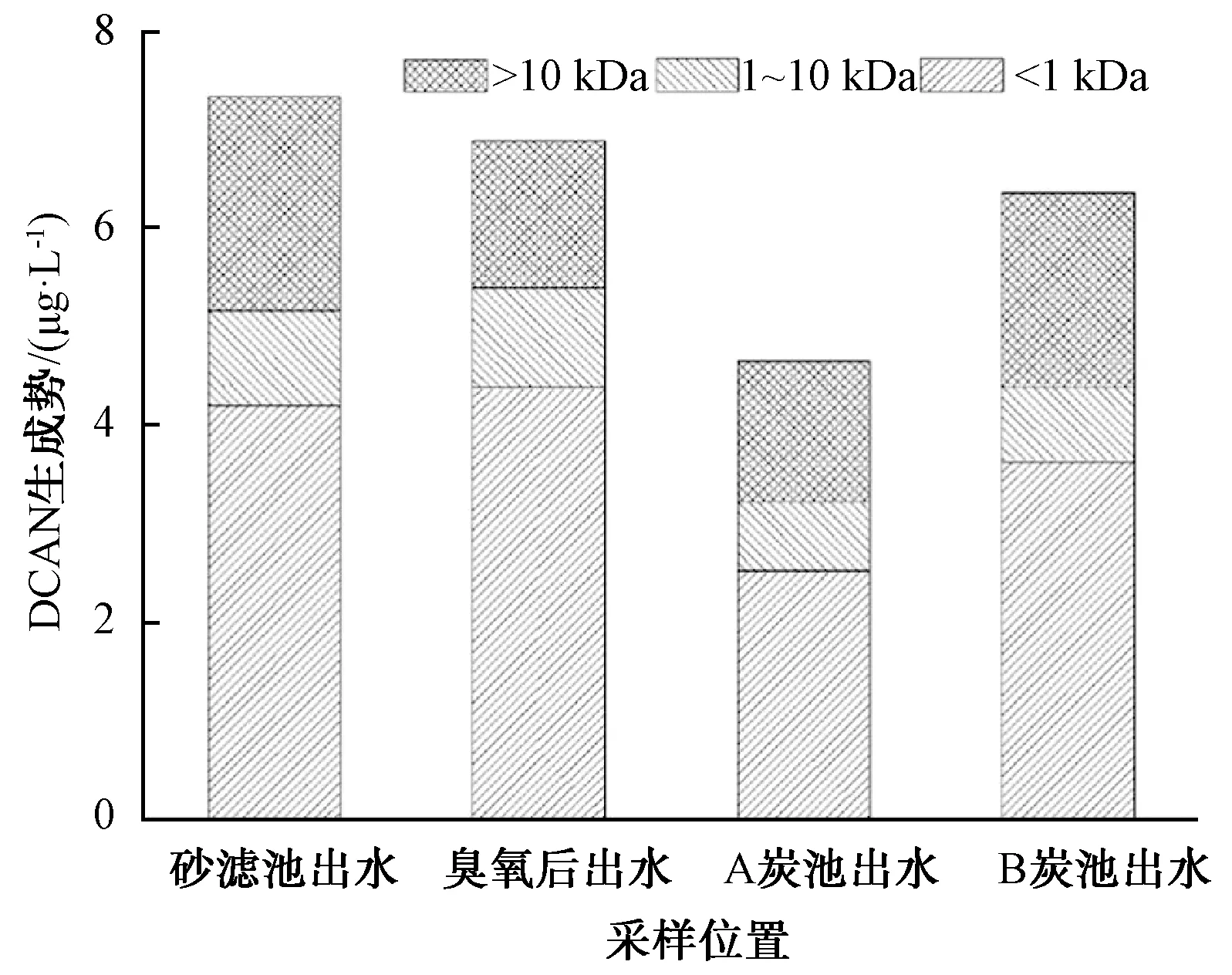
图2 不同分子量对DCAN生成势的贡献Fig.2 Contribution of Different Molecular Weights Related to DCAN Forming Potential
对A与B炭池出水进行筛分,然后检测DCAN生成势,结果如图2所示。臭氧氧化主要去除了DCAN前体物中分子量大于10 kDa的物质,去除率为37.8%,而A炭池大大降低了DCAN前体物的数量(去除率为44.2%),尤其是分子量小于 1 kDa的前体物的数量(去除率为52.4%)。而在B炭池出水中,分子量大于 10 kDa的DCAN前体物的数量不仅没有减少,反而从1.49 μg/L升高到了1.96 μg/L,表明B炭池产生了一些大分子的DCAN前体物。此外,分子量小于1 kDa的DCAN前体物降低也非常有限(0.74 μg/L)。
2.2 A与B炭池出水差异原因分析
为明确活性炭物理和生物作用对DCAN前体物去除的影响,从炭池中取5 L活性炭,使用叠氮化钠灭活微生物并充分反冲洗后,采用小试装置模拟炭池的实际运行工况,另取5 L活性炭做对比试验,结果如表1所示。A池炭对DCAN前体物的物理吸附效果整体上要比B池炭好,将去除的DCAN生成势进行换算,其中A池灭活炭能够比B池灭活炭多吸附1.96 μg/kg的DCAN生成势, A池生物活性炭比B的多吸附6.0 μg/kg。DOC也是同样,但DON去除效果相差不大。另外,值得注意的是,无论是A池灭活炭还是B池灭活炭对DCAN前体物的物理吸附量均高于其对应生物活性炭的去除量,可能是B池炭上的微生物产生了一定数量的DCAN前体物。
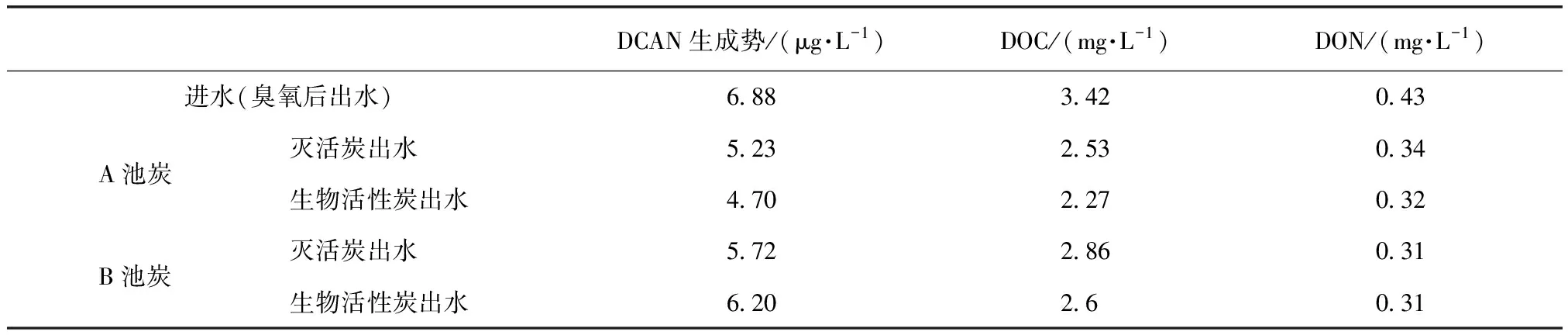
表1 灭活炭和生物活性炭对DCAN生成势、DOC和DON的去除Tab.1 Removal of DCAN Forming Potential, DOC and DON by Inactivated Carbon and Biological Activated Carbon.
为研究A与B池炭具体物理吸附性能的区别,取活性炭样品并送样检测,结果如表2所示。B池炭的比表面积、碘值和亚甲基蓝值分别为A池炭的72%、74%和75%,表明B池炭的吸附效能确实比A池炭要差。炭滤池在运行过程中,有效粒径经过多次反冲洗有一定的磨损,比表面积下降,孔隙变大,因此B池炭的孔容积增加了。活性炭孔隙中会吸附大量的有机物,同时微生物的数量也逐渐增多,反冲洗并不能完全将这些物质从活性炭孔隙中洗脱出来,因而随着炭滤池使用时间的延长,污染物逐渐在活性炭孔隙中累积,导致吸附性能的下降。
微生物在活性炭滤池中起到极为重要的作用。微生物在吸收同化有机物的同时,会释放出一部分溶解性微生物产物(SMPs),而SMPs中含有丰富的氮元素,是一类重要的N-DBPs前体物。本研究选取典型SMPs作为考察对象,测定了A与B炭池进出水中的变化情况,选取的SMPs包括20种α-氨基酸(游离态)、氨基糖、蛋白质和多糖,测定结果如表3所示,水样中共检测出7种氨基酸。

表2 A与B池炭性能对比Tab.2 Comparison between A and B Activated Carbon
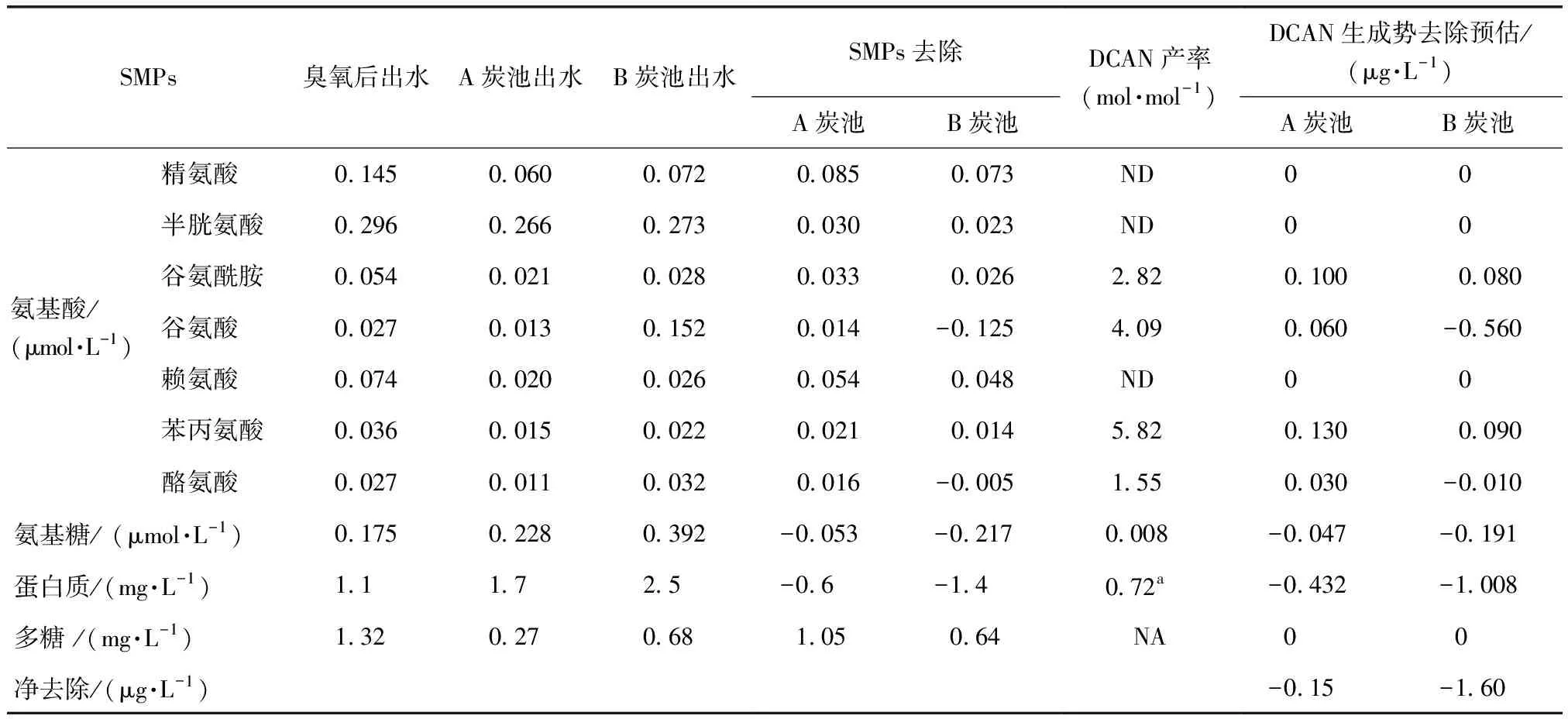
表3 A与B炭池出水中的典型SMPs含量Tab.3 Typical SMPs Content in A and B Carbon Pools
注:表中末二列单位均为μg/L;表中未提及的氨基酸为所有水样均未检出;ND-未检测到;a-为牛血清蛋白所生成,μg/mg;NA-未有数据;表中各类SMPs的DCAN产率由试验获得
生物活性炭工艺对7种氨基酸均有一定的去除效果,但B炭池出水中谷氨酸和酪氨酸的浓度出现了升高现象。A炭池和B炭池出水中的氨基糖浓度分别升高了0.053 μmol/L和0.217 μmol/L,蛋白质浓度分别升高了0.6 mg/L和1.4 mg/L。相反地,A炭池和B炭池出水中多糖含量分别下降了1.05 mg/L和0.64 mg/L。总体而言,B炭池对氨基酸和多糖的去除效果要低于A炭池,且B池炭上的微生物能够产生更多的氨基糖和蛋白质,都是典型的N-DBPs前体物[17],B炭池去除DCAN前体物效能的下降可能与这些物质的变化有关。A炭池对SMPs中的DCAN前体物的净去除量为-0.15 μg/L,B炭池对SMPs中DCAN前体物的净去除量为-1.60 μg/L。因此,A和B炭池对SMPs不同的代谢特性是B炭池去除DCAN前体物效能下降的重要原因。
为了进一步明确A、B池炭对SMPs代谢特性存在差异的原因,考察生物活性炭上微生物的生长与分布情况。本研究中采用ATP含量表征活性炭样品上的总生物量[18],耗氧速率(oxygen uptake rate,OUR)表征生物活性[19],两者的比值可以用来表征单位生物量的耗氧速率,反应微生物的生物代谢强度。如图3和表4所示,在反冲洗前,B池炭上的生物量为704 ng ATP/(g活性炭),远高于A池炭,反冲洗后B池炭仍高于A池炭,因此B炭池炭床中可能会产生更多的SMPs。不论是反冲洗前还是反冲洗后,B池炭上生物膜的OUR/ATP值均低于A池炭,即B炭池单位生物量的代谢能力低于A炭池。这说明,尽管运行时间的延长能够使B池炭上附着更多的微生物,但微生物的生物代谢强度会随之下降,反而会带来SMPs浓度升高、炭床污染等副作用,造成有机物去除能力的下降。

图3 A、B炭池中活性炭的ATP和OURFig.3 ATP and OUR of Activated Carbon in A and B Carbon Pools

A炭池B炭池反冲洗前4.56×10-33.14×10-3反冲洗后4.80×10-33.79×10-3
对A池炭和B池炭上的微生物进行高通量测序分析,以此得到活性炭上微生物的种群分布情况。图4显示了A池炭和B池炭上微生物在属级别的种群分布,与A池炭相比,B池炭生物膜中鞘氨醇单胞菌属(Sphingomonas)的丰度显著降低(从20.3%降低至1.2%)。鞘氨醇单胞菌属属于变形菌纲,革兰氏阴性,专性需氧[20],能够代谢戊糖、己糖和二糖等,并转变为酸。除此之外,鞘氨醇单胞菌属能广泛代谢芳香化合物[21]。在上面的研究中发现,B池炭对多糖和某些芳香族氨基酸(如酪氨酸和苯丙氨酸)的去除能力低于A池炭,这非常可能与B池炭上鞘氨醇单胞菌属的丰度降低有关。另外,B池炭上甲基微球菌属(Methylomicrobium)比A池炭上高5%,这种菌属属于甲烷氧化细菌,在氧化过程中会产生氨基酸或己糖、酮糖[22],是DCAN的前体物,因此也可能是两种活性炭代谢不同的原因。

图4 A、B活性炭中微生物种群分类Fig.4 Classification of Microbial Populations in A and B Activated Carbon
如表5所示,本研究中,对A池炭和B池炭上微生物的高通量测序分析共得到136 609个DNA基因序列,其中A池炭62 905个,B池炭73 704个。B池炭上微生物的物种多样性更加丰富,但A池炭上微生物种群分布更加均匀。Wittebolle等[23]和Han等[24]的研究表明,微生物种群的均匀度越高,则该微生物种群越稳定,对有机物的代谢能力也越强。B池炭对有机物的生物代谢强度比A池炭差,部分原因可能是A池炭上微生物种群的均匀度更高。

表5 A、B活性炭上微生物群落的多样性和均一性Tab.5 Diversity and Homogeneity of Microbial Communities in A and B Activated Carbon
3 结论
(1)水厂处理过程中,常规水处理工艺对DCAN生成势去除率为19.78%,A炭池对DCAN生成势去除效果较好,平均为35.85%,然而B炭池仅14.22%,差异较大。
(2)B炭池对DCAN前体物去除效果比A炭池差,部分原因是B池炭物理吸附性能的下降,但是B池炭上的微生物不但对DCAN生成势没有去除,反而产生了一定数量的DCAN前体物,因此更为重要的是微生物在活性炭池中的作用。
(3)B炭池炭床上生物膜的生物活性高,对有机物的代谢能力略高于A炭池,但同时生物量也高于A炭池,因此产生更多氨基酸、氨基糖、多糖和蛋白质,A炭池和B炭池对SMPs不同的代谢特性是B炭池去除DCAN生成势效能下降的重要原因。
(4)B炭池对有机物的生物代谢强度比A炭池差,原因可能是B池炭生物膜中鞘氨醇单胞菌属(Sphingomonas)的丰度显著低于A池炭或甲基微球菌属(Methylomicrobium)的丰度高于A池炭;也可能是B池炭上微生物种群均匀度低于A池炭。

