鲍曼不动杆菌外膜蛋白A通过Akt/mTOR/p70S6K信号通路引起RAW264.7细胞自噬*
安志远, 丁文一, 郑春明, 黄骁舾
(1首都医科大学附属北京朝阳医院医学研究中心, 北京 100020; 2中国医学科学院北京协和医院检验科, 北京 100730)
鲍曼不动杆菌(Acinetobacterbaumannii)是一种重要的临床机会致病菌,可以引起呼吸机相关肺炎、败血症和泌尿道感染等感染性疾病。近年来临床上出现了多耐药及泛耐药鲍曼不动杆菌,给治疗带来极大困难[1-3]。目前已知鲍曼不动杆菌的外膜蛋白在其引起细胞毒性方面发挥了关键作用[4-6],其中外膜蛋白A(outer membrane protein A,OmpA)是鲍曼不动杆菌主要毒力蛋白,它可以导致包括肿瘤细胞在内的多种哺乳动物细胞产生炎性因子及引发凋亡[7-8]。但其是否可以引起宿主细胞自噬还不清楚。
自噬是机体应对应激和感染等外界不利因素,吞噬降解胞质中受损的细胞器,维持细胞稳态的过程[9]。自噬的发生和发展需要多种自噬蛋白共同完成,其中LC3对于自噬的活化至关重要,自噬体膜形成的过程中,胞浆中的LC3-I会与磷脂酰乙醇胺结合形成的共轭LC3的磷脂酰乙醇胺,即LC3-II,它是自噬体活化的分子标志[10]。研究发现许多细菌及其毒力因子可以引起细胞自噬,自噬作用对于细胞清除细菌感染起到积极作用[11-12]。2016年,Wang等[13]研究发现鲍曼不动杆菌可以引起HeLa细胞自噬,但却不清楚是何种毒力因子引发的自噬。本实验室先前通过构建OmpA真核表达载体,转染HeLa细胞过表达OmpA,证实其可以引起HeLa细胞自噬[14],但到目前还不知道OmpA是否可以引起宿主免疫细胞自噬,为了进一步证实OmpA对免疫细胞的自噬作用及具体的分子机制,本研究将分析鲍曼不动杆菌OmpA对RAW264.7细胞的自噬作用。
材 料 和 方 法
1 主要试剂和仪器
鲍曼不动杆菌标准株(ATCC® 19606TM)的OmpA由本实验室表达纯化;抗LC3A/B、p-Akt、p-mTOR、p-P70S6K和β-actin抗体购自CST;雷帕霉素(rapamycin,Rapa)购自Sigma;抗兔荧光II 抗购自中杉金桥生物公司;RIPA细胞裂解液购自Beyotime。蛋白质电泳仪(Bio-Rad);TCS SP8激光共聚焦显微镜(Leica);HT7700透射电子显微镜(Hitachi);其余试剂为进口和国产分析纯。
2 方法
2.1RAW264.7细胞的培养 小鼠巨噬细胞系RAW264.7(ATCC®TIB-71TM)购自美国模式菌种保藏中心(the American Type Culture Collection,ATCC);DMEM培养基、胎牛血清和青链霉素购自Gibco。细胞用DMEM完全培养基(含有10%胎牛血清和1%青、链霉素),在37 ℃、5% CO2培养条件下培养。
2.2Western blot分析 分别收集10 mg/L OmpA刺激不同时间(0、6、12和24 h)或用5和10 mg/L OmpA刺激24 h的RAW264.7细胞,PBS缓冲液润洗3次,用RIPA裂解液在冰上裂解细胞20 min,12 000×g离心10 min收集蛋白上清备用。用BCA试剂盒检测蛋白浓度。用10%或15% SDS-PAGE,之后将蛋白转移到0.22 μm或0.45 μm的PVDF膜(Merck Millipore)上,5%的脱脂奶粉室温封闭1 h,剪下目的条带并和相应的 I 抗在4 ℃孵育过夜,隔天TBST洗膜3次,每次10 min,之后与荧光标记的山羊抗兔抗体或山羊抗小鼠抗体(1∶15 000稀释)室温孵育1 h,TBST洗膜3次,每次10 min,再用Odyssey® CLx成像系统(LI-COR Bioscences)检测蛋白表达,最后用ImageJ软件分析灰度值。
2.3透射电子显微镜观察自噬体 RAW264.7细胞以5×104的密度接种于6孔细胞培养板,培养24 h后用10 mg/L OmpA刺激RAW264.7细胞24 h,300×g离心5 min收集细胞沉淀,用2.5%的戊二醛在4 ℃下固定2 h,PBS洗3遍;用1%的锇酸室温固定2 h,PBS洗3遍;用梯度乙醇(50%、70%、80%、90%,每步10 min)对细胞组织进行脱水、渗透。将组织放入环氧树脂中包埋,之后用超薄切片机(Leica)将细胞组织切割成70 nm厚度,最后用醋酸铀和硝酸铅染色。将制备好的切片用透射电子显微镜获取高分辨率图像。
2.4细胞免疫荧光染色 将10 mg/L OmpA刺激24 h的RAW264.7细胞用4%多聚甲醛固定15 min,之后加入0.3% Triton X-100通透10 min,3% BSA室温封闭1 h,之后加入抗LC3A/B抗体,4 ℃孵育过夜,之后用PBS洗3次,每次5 min,加入抗兔荧光 II 抗室温孵育1 h,细胞核用1 mg/L DAPI染色,图像用激光共聚焦显微镜观察LC3表达情况。
3 统计学处理
用GraphPad Prism 5.0进行统计作图,用SPSS 17.0进行统计分析。所有的实验数据用均数±标准误(mean±SEM)表示,差异显著性用Student’st-test或用单因素方差分析(one-way ANOVA)程序随后进行Bonferroniposthoctest分析。以P<0.05为差异有统计学意义。
结 果
1 鲍曼不动杆菌OmpA引起RAW264.7细胞自噬
细胞免疫荧光显示,10 mg/L的OmpA刺激RAW264.7细胞24 h后细胞胞质内产生了大量的LC3荧光斑点状聚集,而未处理组未观察到LC3荧光斑点状聚集,见图1A。Western blot结果显示,OmpA刺激RAW264.7细胞6 h后可使LC3B-II表达升高,24 h时表达达到高峰,说明OmpA引起RAW264.7细胞自噬具有时间依赖性,量化统计结果发现,OmpA刺激组中的LC3B-II表达量随着时间延长而逐渐增高,与未刺激组相比具有统计学差异(P<0.05),见图1B。最后我们通过透射电子显微镜观察发现OmpA可以导致RAW264.7细胞产生典型的双层囊泡类似洋葱皮样结构的自噬小体(黑色箭头所示),而未处理组中细胞形态完整,各细胞器结构正常,没有发生自噬现象,见图1C。
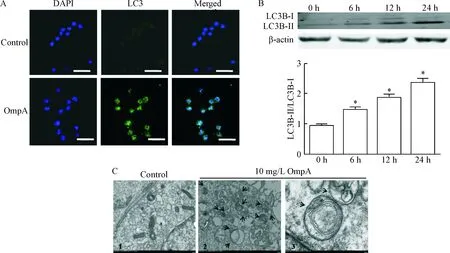
Figure 1.OmpA triggered autophagy in RAW264.7 cells. A: confocal microscopic detection of LC3 levels in 10 mg/L OmpA-stimulated or control RAW264.7 cells for 24 h (scale bar=10 μm); B: RAW264.7 cells were stimulated with 10 mg/L OmpA for 0 h, 6 h,12 h and 24 h,and the expression level of LC3B was detected by Western blot; C: transmission electron microscopy showed that 10 mg/L OmpA stimulate RAW264.7 cells for 24 h to induce autophagosome formation (the black arrows indicated typical autophagosomes; the scale bar of C1 and C2=1 μm; the scale bar of C3=200 nm). Mean±SEM. n=3. *P<0.05 vs 0 h.
2 鲍曼不动杆菌OmpA通过Akt/mTOR/p70S6K信号通路引起RAW264.7细胞自噬
为了知道OmpA激活RAW264.7细胞自噬的具体信号途径,我们检测了自噬通路中mTOR分子及其上游分子Akt和下游分子p70S6K的磷酸化改变。结果发现,10 mg/L的OmpA刺激RAW264.7细胞不同时间(0、6、12和24 h)后可以引起Akt、mTOR和p70S6K的磷酸化水平降低,具有时间依赖性,量化统计结果发现OmpA刺激组中Akt、mTOR和p70S6K的磷酸化随着时间延长而逐渐降低,与未刺激组相比差异具有统计学意义(P<0.05或P<0.01),见图2A。不同浓度(0、5和10 mg/L)的OmpA刺激RAW264.7细胞24 h后也可引起Akt、mTOR和p70S6K的磷酸化降低,具有剂量依赖性,量化统计结果发现Akt、mTOR和p70S6K的磷酸化随着OmpA刺激浓度的增高而逐渐降低,与未刺激组相比差异具有统计学意义(P<0.05或P<0.01),见图2B。另外,我们用mTOR的特异性抑制剂rapamycin(400 nmol/L)预先作用RAW264.7细胞6 h,之后用10 mg/L浓度的 OmpA刺激24 h后检测mTOR和p70S6K的磷酸化及LC3B表达的变化,结果发现OmpA和rapamycin共孵育的RAW264.7细胞中mTOR和p70S6K的磷酸化程度比单纯OmpA刺激组进一步降低,而LC3B-II的表达水平比单纯OmpA刺激组显著提高(P<0.01),证明OmpA通过Akt/mTOR/p70S6K信号通路诱导了RAW264.7细胞自噬,见图2C。
讨 论
鲍曼不动杆菌的OmpA在其对宿主细胞的毒性中发挥着重要作用,但到目前对OmpA的研究和认识仅仅局限在其对宿主细胞的凋亡作用,而OmpA侵袭宿主导致炎症反应的同时是否还涉及其他信号分子我们还不清楚,因此本研究以免疫学中经典的RAW264.7细胞为研究对象,分析了OmpA对其自噬及相关信号通路的影响。
鲍曼不动杆菌OmpA可以引起RAW264.7细胞LC3B-II表达水平增高,LC3B-II是自噬体形成的标志蛋白,其表达强度越高说明自噬水平越强[15],这与我们先前在HeLa细胞中过表达OmpA所得到的结果相似,但OmpA是激活了哪条信号通路引起自噬的还不清楚。现在已知Akt/mTOR/p70S6K信号通路是调节自噬激活的关键分子,自噬发生时mTOR的活性会受到上游分子Akt的抑制,其磷酸化水平会降低;而p70S6K是mTOR下游的效应蛋白,mTOR磷酸化降低时其磷酸化水平也会相应降低;相反这些分子的磷酸化升高会抑制自噬[16-17]。我们发现OmpA引起RAW264.7细胞LC3B-II表达升高的同时还明显抑制了Akt、mTOR和p70S6K磷酸化水平;而且自噬激活剂rapamycin可以进一步抑制mTOR和p70S6K磷酸化水平并提高OmpA引起的LC3B-II表达,这提示OmpA可能是通过下调Akt/mTOR/p70S6K磷酸化水平来激活自噬的。
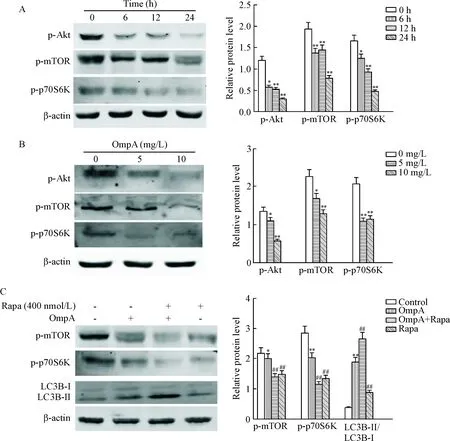
Figure 2.OmpA induced autophagy in RAW264.7 cells through Akt/mTOR/p70S6K signaling pathway. A: the phosphorylation levels of Akt, mTOR and p70S6K in the RAW264.7 cells treated with 10 mg/L OmpA for 0 h, 6 h, 12 h and 24 h were detected by Western blot; B: RAW264.7 cells were stimulated with 0, 5 and 10 mg/L OmpA for 24 h, and the protein levels of p-Akt, p-mTOR and p-p70S6K were detected by Western blot analysis; C: the RAW264.7 cells were treated with 400 nmol/L rapamycin (Rapa) for 6 h before co-stimulaton with 10 mg/L OmpA for 24 h, and Western blot was used to detect the protein levels of LC3B-II, p-mTOR and p-p70S6K. Mean±SEM. n=3. *P<0.05, ** P<0.01 vs control group (0 h or 0 mg/L); ##P<0.01 vs OmpA group.
本研究证实鲍曼不动杆菌OmpA通过Akt/mTOR/p70S6K信号通路导致RAW264.7细胞自噬,这为将来进一步研究鲍曼不动杆菌引起自噬的分子机制及找到对抗其感染的新方法提供理论依据。

