PDCD4在肺纤维化模型中的表达及意义*
向 莱, 江 涛
(重庆医科大学附属第一医院呼吸与危重症医学科, 重庆 400016)
肺纤维化是一种常见的,以成纤维细胞(fibroblast,FB)大量异常增殖、转化及分泌并沉积大量细胞外基质(extracellular matrix,ECM)为特征的肺间质疾病的病理过程。众所周知,肺间质疾病的病程呈进行性发展,最终绝大多数病人因呼吸功能衰竭而死亡。大部分肺纤维化患者确诊后,生存期仅2~5年[1-4]。程序性细胞死亡蛋白4(programmed cell death protein 4,PDCD4)是一种抑癌基因,有促进细胞凋亡的作用,研究发现PDCD4在肝纤维化和心肌纤维化中呈低表达[5-6],然而,PDCD4是否参了肺纤维化的发生发展目前还不清楚。FB可以异常增殖转化为肌成纤维细胞(myofibroblast,MB),MB可大量分泌ECM,其分泌功能是FB的数倍,MB不仅与ECM的分泌有关,与ECM的降解也有关[7-10]。在肺纤维化患者和通过博来霉素建立的肺纤维化模型中都发现了MB的异常增殖[9, 11-13]。MB是肺纤维化的主要效应细胞,其与FB的主要区别在于是否明显表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA),因此α-SMA蛋白可以作为MB的标志物。羟脯氨酸(hydroxyproline,HYP)是胶原组织代谢的重要指标,可以间接反映肺纤维化的程度。转化生长因子β1(transforming growth factor-β1, TGF-β1)被证明在体外及体内均可诱导FB转分化为MB[14-15],并刺激ECM的产生[16],故TGF-β1广泛用于体外肺纤维化模型的诱导建立。本实验计划在体外给予TGF-β1诱导人胚肺成纤维细胞系HFL-1增殖转化为MB,从而建立肺纤维化细胞模型;并在体内使用博来霉素建立小鼠肺纤维化模型,进而研究PDCD4 在肺纤维化中的表达情况及其对MB生长的影响及可能的调控机制。
材 料 和 方 法
1 材料及主要试剂
人胚肺成纤维细胞HFL-1购自中科院上海细胞库;DMEM高糖细胞培养液、胎牛血清和胰酶均购自HyClone;重组人TGF-β1购自PeproTech;注射用盐酸博来霉素购自海正辉瑞;逆转录试剂盒、TRIzol总RNA提取试剂及荧光定量PCR试剂盒购于TaKaRa;所有PCR引物均购自南京金斯瑞生物科技有限公司;磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抑制剂LY294002和LipofectamineTM6000购自碧云天公司;无内毒素质粒提取试剂盒购自Omega;质粒pEZ-M03-PDCD4和pEZ-M03由Gene CopoeiaTM合成;CCK-8 试剂盒购自同仁试剂公司;羟脯氨酸试剂盒购自南京建成生物工程研究所;兔抗人α-SMA、p-AKT、AKT、c-Myc和细胞周期素D1(cyclin D1)单克隆抗体及抗I型胶原(collagen type I,COL-I)多克隆抗体购自Abcam;兔抗人PDCD4 单克隆抗体购自CST;HRP标记的抗兔和抗鼠IgG和鼠抗人GAPDH抗体均购自碧云天生物公司。
2 方法
2.1细胞培养 HFL-1细胞接种于含1%青霉素-链霉素双抗和10%胎牛血清的DMEM培养基,并培养于5% CO2、饱和湿度和37 ℃恒定温度培养箱。
2.2RT-qPCR法测定PDCD4、α-SMA和COL-I的mRNA表达 正常HFL1细胞和10 μg/L TGF-β1处理HFL1细胞4 h后,用总RNA提取试剂盒提取细胞RNA,逆转录试剂盒合成cDNA,全自动荧光定量 PCR仪扩增并进行荧光定量检测。PDCD4的上游引物序列为5’-CCTGGATACCGCAGCTAGGA-3’,下游引物序列为5’-GCGGCGCAATACGAATGCCCC-3’,扩增片段长度为673 bp;α-SMA的上游引物序列为5’-GCGTGGCTATTCCTTCGTTAC-3’,下游引物序列为5’-CATAGTGGTGCCCCCTGATAG-3’, 扩增片段长度为373 bp;COL-I的上游引物序列为5’-TGGTGACAAGGGTGAGA -3’,下游引物序列为5’-GGATGTTCTCGATCTGCTGG-3’,扩增片段长度为458 bp;GAPDH的上游引物序列为5’-AGAAGGCTGGGGCTCATTTG-3’,下游引物序列为5’-AGGGGCCATCCACAGTCTTC -3’,扩增片段长度为258 bp。PCR反应条件为95 ℃预变性5 min; 95 ℃变性 15 s、60 ℃退火30 s、72 ℃延伸 30 s,循环40次。结果采用2-ΔΔCt法,计算 mRNA的相对表达量。
2.3Western blot法测定PDCD4、α-SMA和COL-I的蛋白表达 分别对正常HFL1细胞和用10 μg/L TGF-β1处理4 h后的HFL1细胞提取细胞总蛋白,通过BCA法测定蛋白浓度,将上样缓冲液与蛋白样品按照1∶4的体积比例混匀,在100 ℃变性。按每孔30 mg的体系电泳、转膜。所得条带经5% BSA封闭60 min,4 ℃环境下放置在对应的I抗处理8 h,TBST清洗3遍,每次5 min;分别加入对应的II抗室温孵育1 h,TBST清洗3遍,每次5 min,ECL化学发光显影。
2.4细胞转染 用E.Z.N.A.TMEndo-Free Plasmid Mini Kit II质粒提取试剂盒提取pEZ-M03-PDCD4及pEZ-M03空质粒 (按说明书操作)。转染前12 h按 2.0×108/L细胞数接种于6孔板中,于5% CO2、37 ℃细胞孵箱中培养8 h。待细胞汇合度达80%时,将3.5 μg质粒和5 μL LipofectamineTM6000混合后,转染进10 μg/L TGF-β1处理48 h后的HFL1细胞,使用无血清培养基(按说明书操作)。转染6 h后换完全培养基。培养转染细胞48 h后进行后续试验,实验分为空白对照(blank control)组、pEZ-M03-PDCD4组和pEZ-M03组。
2.5CCK-8法检测细胞活力 取空白对照组、pEZ-M03-PDCD4转染组和pEZ-M03对照组细胞,每组设 4 个复孔,分别将空白对照组和转染后处于对数生长期的TGF-β1处理的HFL-1细胞接种于96孔板,每孔约 4×103个细胞,于种板后 24、48和72 h分别在每孔中加入10 μL CCK-8,置于细胞孵箱中培养1 h;酶标仪读取450 nm波长处的A值。
2.6羟脯氨酸消化法检测细胞培养上清中HYP的含量 分别取HLF-1细胞、肌成纤维细胞及转染48 h后的肌成纤维细胞上清液,严格按照试剂盒说明书进行操作。上清液HYP (mg/L)=(测定管A值-空白管A值) /(标准管A值-空白管A值)×标准管浓度×样本测试前稀释倍数。
2.7动物模型的建立及样本采集 取8只C57雄性小鼠,随机分为2组(n=4):模型(model)组和对照(control)组,小鼠经水合氯醛(4%)麻醉后,手术暴露气管,向模型组气管内注入0.2 mL(3 mg/kg)博来霉素生理盐水溶液,向对照组气管内注入等量生理盐水,立即直立小鼠,并轻晃小鼠使药物均匀分布于肺,继续饲养21 d后处死小鼠,取出肺组织,右肺组织保存于-80 ℃冰箱保存,用于PDCD4蛋白的Western blot检测;左肺组织置于4%多聚甲醛溶液中,固定24 h后常规脱水,石蜡包埋,切片,切片采用HE染色。
3 统计学处理
以SPSS 19.0软件分析数据,数据以均数±标准差(mean±SD)表示。两组间比较采用t检验,多组间比较采用单因素方差分析,各组均数间的两两比较用Bonferroni检验,以P<0.05为差异有统计学意义。
结 果
1 PDCD4、α-SMA和COL-I在正常HFL-1细胞和TGF-β1处理的HFL-1细胞的表达情况
以正常HFL-1细胞为对照组,Western blot检测结果显示,相较于对照组,HFL-1+TGF-β1组的α-SMA和COL-I的蛋白表达明显上调,PDCD4的蛋白表达显著下调(P<0.01),见图1,提示 HFL-1细胞转化为MB成功,肺纤维化细胞模型建立成功,PDCD4蛋白在MB中呈低表达。RT-qPCR结果显示,对照组与HFL-1+TGF-β1组PDCD4 mRNA表达之间的差异无统计学显著性,HFL-1+TGF-β1组α-SMA和COL-I的mRNA表达与对照组相比明显上调(P<0.01),见图2。

Figure 1.The protein expression of PDCD4, α-SMA and COL-I in HFL-1 group and HFL-1+TGF-β1 group. Mean±SD. n=3. **P<0.01 vs HFL-1 group.
2 pEZ-M03-PDCD4转染肌成纤维细胞后其PDCD4蛋白的表达情况
将肌成纤维细胞转染并培养48 h后分别提取空白对照组、pEZ-M03-PDCD4组和pEZ-M03组总蛋白进行Western blot检测。结果显示,与空白对照组及pEZ-M03组比较, pEZ-M03-PDCD4组PDCD4的蛋白表达水平明显上调(P<0.05);pEZ-M03组和空白对照组间的差异无统计学显著性,说明pEZ-M03-PDCD4已成功转染HFL1 细胞并过表达PDCD4蛋白,见图3。
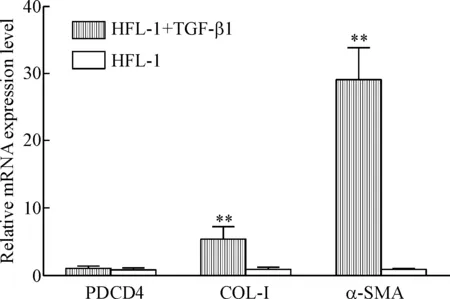
Figure 2.The mRNA expression of PDCD4, α-SMA and COL-I in HFL-1 group and HFL-1+TGF-β1 group. Mean±SD. n=3. **P<0.01 vs HFL-1 group.
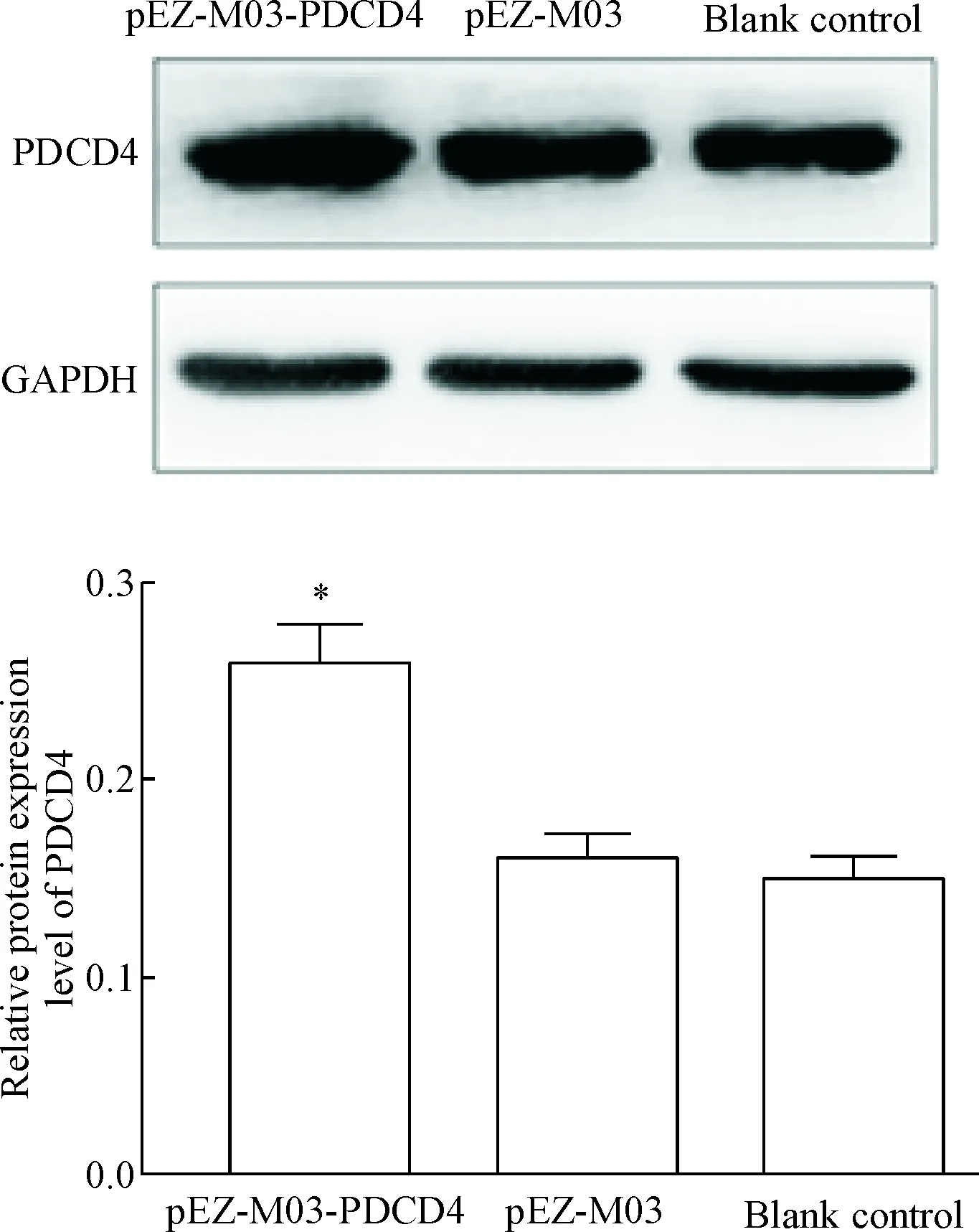
Figure 3.The protein expression of PDCD4 in the MB transfec-ted with pEZ-M03-PDCD4. Mean±SD. n=3. *P<0.05 vs blank control group and pEZ-M03 group.
3 PDCD4过表达对肌成纤维细胞活力的影响
转染pEZ-M03-PDCD4后,分别检测空白对照组、pEZ-M03-PDCD4组和pEZ-M03组24、48和72 h时点的A值,绘制细胞活力曲线,发现pEZ-M03-PDCD4组的细胞活力较pEZ-M03组及空白对照组显著降低(P<0.01),pEZ-M03组及空白对照组间的差异无统计学显著性,表明PDCD4 可显著抑制肌成纤维细胞的活力,见图4。
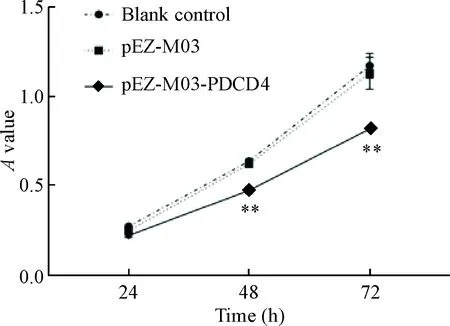
Figure 4.The viability of the MB transfected with pEZ-M03-PDCD4 detected by CCK-8 assay. Mean±SD. n=4. **P<0.01 vs blank control group and pEZ-M03 group.
4 PDCD4过表达对PI3K/AKT通路及细胞周期蛋白c-Myc和cyclin D1表达的影响
与空白对照组和pEZ-M03组相比,pEZ-M03-PDCD4组细胞的细胞周期蛋白c-Myc和cyclin D1的蛋白表达都显著减少(P<0.05), PI3K/AKT通路相关蛋白p-AKT的蛋白水平显著减少(P<0.05),LY294002组的p-AKT蛋白水平也显著降低(P<0.05),pEZ-M03组与空白对照组的差异无统计学显著性,见图5。
5 PDCD4过表达对上清液中羟脯氨酸含量的影响
与HFL-1组相比,空白对照组、pEZ-M03组和pEZ-M03-PDCD4组培养上清液中的羟脯氨酸含量均显著增加(P<0.01);与空白对照组和pEZ-M03组相比,pEZ-M03-PDCD4组培养上清液中的羟脯氨酸含量显著减少(P<0.05),见图6。
6 小鼠肺组织病理观察及PDCD4蛋白在模型组和对照组的表达情况
光镜观察可见,对照组小鼠肺组织结构未见异常,模型组肺组织结构紊乱,可见大量肺泡消失及纤维组织增生,见图7A。与对照组比较,模型组PDCD4的蛋白表达减少(P<0.01),见图7B。
讨 论
PDCD4是一个新发现的与凋亡及细胞周期相关的抑癌基因[17],在人类组织中,例如肝、肺、脑、皮肤、胰腺及卵巢等组织都有表达。但近年来有研究发现PDCD4在肝纤维化和心肌纤维化的肌成纤维细胞中呈低表达[5-6]。然而,PDCD4是否参了肺纤维化的发生发展目前尚不清楚。故本实验首先以TGF-β1 诱导建立肺纤维化细胞模型[17],诱导后的模型即使在没有TGF-β1的情况下也很稳定[18]。以HFL-1细胞为对照组,发现PDCD4在TGF-β1处理的HFL-1细胞中其蛋白水平显著下调,但其mRNA水平无明显变化,此现象可能是MB中PDCD4蛋白翻译水平较低或(和)PDCD4蛋白降解增多引起的。
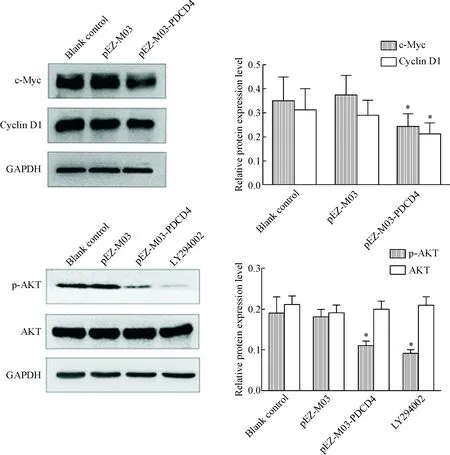
Figure 5.The protein levels of c-Myc, cyclin D1, AKT and p-AKT in the MB cells transfected with pEZ-M03-PDCD4. Mean±SD. n=3. *P<0.05 vs blank control group and pEZ-M03 group.
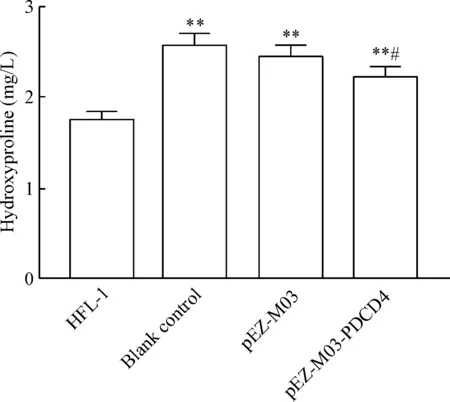
Figure 6.The effects of PDCD4 over-expression on the hydroxyproline content in the MB of each group. Mean±SD. n=4. **P<0.01 vs HFL-1 group; #P<0.05 vs blank control group.
PI3K/AKT信号通路是细胞内信号传导通路之一,其在维持细胞正常生理功能如生长、代谢和分化中起着非常关键的作用[19]。PI3K/AKT通路被证实存在于人体的许多生理功能中,大量证据说明抑制信号转导通路具有促进细胞凋亡作用,而且这一通路与纤维化疾病有紧密的关系。但是,在体外实验综上所述,过表达MB内抑癌基因PDCD4,通过抑制PI3K/AKT信号通路及细胞周期蛋白cyclin D1和c-Myc抑制细胞活力,减少胶原蛋白的分泌。这对于应用PDCD4靶向分子治疗肺纤维化疾病提供了理论依据。

Figure 7.HE staining of mouse lung tissue sections (A;×200) and the protein expression of PDCD4 in the lung tissues of model group and control group (B). Mean±SD. n=4. **P<0.01 vs control group.

