Nodosin通过Apaf-1和caspase-3诱导HepG2细胞凋亡*
海广范, 张 慧, 马 敬, 郭兰青, 王海燕
(新乡医学院 1药学院, 2第二附属医院, 3护理学院, 4第一附属医院, 河南 新乡 453003)
恶性肿瘤是由于各种原因导致细胞生长和增殖失控而诱发的一种疾病,其发病率和死亡率均呈上升态势[1],肝细胞癌是发病率与死亡率最高的恶性肿瘤之一[2],而对肝癌的治疗尚缺乏安全有效的药物。目前发现一些植物性抗肿瘤药对肝癌具有较好的防治作用,并且具有不良反应少、安全有效等特点,因此,植物性抗肿瘤药成为科研工作者的研究热点。溪黄草为唇形科(Labiatae)香茶菜属 (Isodon)植物,具有凉血散瘀、退黄去湿和清热解毒等功效,nodosin是从溪黄草中提取出来的贝壳杉烷型二萜化合物。 我们在前期研究中发现nodosin对HepG2、HL60、LoVo、SGC7901和U87等多种细胞都有一定程度的抑制作用[3],但具体作用机制尚不清楚。鉴于大多数植物性提取药物对肿瘤细胞的杀伤性作用与诱导细胞凋亡作用密切相关,我们以HepG2细胞为研究对象,探讨nodosin对HepG2细胞凋亡的影响及其机制,为研发新的治疗肝癌的药物提供依据。
材 料 和 方 法
1 主要试剂材料
新生小牛血清购自郑州博兴生物科技有限公司;DMSO和Hoechst 33258购自广州威佳生物科技有限公司;DMEM培养液购自GIBCO;抗caspase-3抗体购自Santa Cruz; nodosin由新乡医学院药学院提供,高效液相色谱法测定其纯度为95.5%。
2 实验方法
2.1细胞培养 人肝癌细胞株HepG2由新乡医学院药学院药理学教研室提供,在-196 ℃液氮中冻存,由本实验室体外传代培养。按照贴壁细胞的培养方法把HepG2细胞于37 ℃、5% CO2和饱和湿度的培养箱中常规培养,每2 d换液1次,3 d左右传代1次。
2.2荧光染色 取对数生长期的HepG2细胞,按照每孔3×105的细胞量把细胞接种于6孔板中,24 h后更换培养液,加入nodosin,使每孔的药物浓度分别为1.25、 2.5、 5、 10和20 μmol/L,同时设置阴性对照(control)组,24 h后加入4%多聚甲醛固定10 min,PBS冲洗后加入10 μg/L Hoechst 33258染色10 min,PBS冲洗后于荧光显微镜下观察、拍照。
2.3电镜观察 取对数生长期的HepG2细胞,按照每孔3×106的细胞量把细胞接种于6孔板中,24 h后更换培养液,加入nodosin,使每孔的药物浓度分别为2.5、5和10 μmol/L,同时设置阴性对照组,每个浓度设置3个复孔,24 h后收集细胞,在4 ℃ 4%戊二醛溶液中固定4 h,然后用磷酸缓冲液洗涤24 h,用锇酸固定液固定1 h,磷酸缓冲液洗涤2次,然后依次用50%、70%、80%、90%、95%和100%的丙酮梯度脱水,每次10 min,再用树脂812浸透24 h,定向包埋聚合96 h,Leica UC6超薄切片机切成50 nm超薄切片,再用醋酸铀-枸橼酸铅双染色,日立H-7500透射电镜观察、拍照。
2.4凋亡率的检测 取对数生长期的HepG2细胞,按照每孔2×106的细胞量把细胞接种于6孔板中,24 h后更换培养液,加入nodosin,使每孔的药物浓度分别为1.25、 2.5、5、10和20 μmol/L,同时设置阴性对照组,24 h后收集细胞,PI染色,流式细胞术检测细胞凋亡率。
2.5RT-qPCR检测凋亡蛋白酶激活因子1(apopto-tic protease-activating factor-1, Apaf-1) mRNA的表达 用1.25、2.5、 5、10和20 μmol/L的nodosin共培养HepG2细胞,同时设置阴性对照HepG2细胞组,24 h后收集细胞,提取RNA,用逆转录酶和引物合成cDNA, 反应条件: 94 ℃变性40 s、61 ℃复性40 s、70 ℃延伸60 s,共32个循环。Apaf-1的上游引物序列为 5’-TTGCTGCCCTTCTCCATGAT-3’,下游引物序列为 5’-TCCCAACTGAAACCCAATGC-3’,内参照GAPDH的上游引物序列为5’-AGATCCCTCCAAAATCAAGTGG-3’,下游引物序列为5’-GGCAGAGATGATGACCCTTTT-3’,扩增产物长度为490 bp。PCR条件: 93 ℃变性; 93 ℃ 60 s、60 ℃ 60 s、72 ℃ 2 min顺序循环30次; 72 ℃延伸10 min。
2.6Western blot 检测pro-caspase-3、caspase-3和cleaved caspase-3的蛋白水平 将经2.5、5和10 μmol/L nodosin处理24 h后的HepG2细胞提取蛋白,并用SDS-PAGE辨别pro-caspase-3和caspase-3蛋白,然后以3层滤纸、PVDF膜、凝胶、3层滤纸的顺序排好,4 ℃、 300 mA条件下转移100 min,然后取出PVDF膜用PBS洗膜3次,用含有5%脱脂奶粉的PBS封闭60 min,用PBS缓冲液将PVDF膜洗3次后,用anti-pro-caspase-3、anti-caspase-3和anti-cleaved caspase-3抗体(1∶200)4 ℃孵育过夜。次日用PBS洗膜2次并用羊抗鼠IgG-HRP(1∶100)室温缓慢振荡1.5 h后,PBS洗膜2次后显色,并拍照记录。
3 统计学处理
数据均用SPSS 16.0统计软件进行处理。实验数据以均数±标准差(mean±SD)表示,采用方差分析进行组间差异比较,并使用LSD-t检验对各组均数进行两两比较。以P<0.05为差异有统计学意义。
结 果
1 荧光染色结果
阴性对照组HepG2细胞胞核染色均匀,细胞核饱满; nodosin处理后细胞染色出现染色不均匀,细胞核出现切迹或者不规则的形状,该形态在1.25和2.5 μmol/L 剂量组较为明显,随着用药剂量的增加,在5、10和20 μmol/L剂量组可见细胞核浓缩成小块状,凋亡小体清晰可见,见图1。
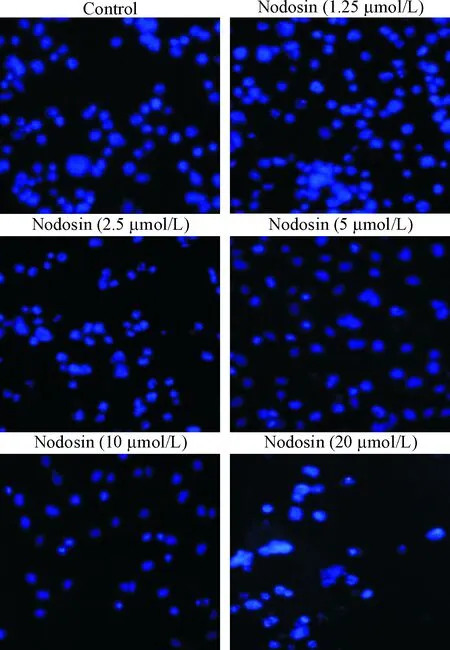
Figure 1.The effect of nodosin at different concentrations on the HepG2 cells observed by microscopy with Hoechst 33258 staining (×200).
2 电镜观察结果
电镜观察可见,未用nodosin处理过的细胞饱满,细胞核圆润,核仁居中; 2.5 μmol/L nodosin处理过的细胞形态不均,细胞核出现切迹;5 μmol/L 剂量组细胞核染色质固缩、边集,呈新月形,核膜皱褶,细胞器集中,细胞核呈现月牙形,核仁偏移;10 μmol/L 剂量组细胞胞质紧实,细胞器集中,胞膜起泡,凋亡小体清晰可见,见图2。
3 细胞凋亡率的检测结果
不同浓度nodosin对HepG2细胞凋亡率的影响示,阴性对照组、1.25 μmol/L 剂量组、2.5 μmol/L 剂量组、5 μmol/L剂量组、10 μmol/L 剂量组和 20 μmol/L 剂量组凋亡率随着nodosin浓度的增加凋亡率随之增加(P<0.05或P<0.01),见图3。
4 Nodosin对Apaf-1 mRNA相对表达量的影响
与阴性对照组相比,Apaf-1的mRNA相对表达量在5 μmol/L剂量组、10 μmol/L 剂量组和 20 μmol/L 剂量组显著增加(P<0.05),见图4。

Figure 2.The effect of nodosin at different concentrations on the HepG2 cells observed under electron microscope.
5 Nodosin对caspase-3蛋白水平的影响
不同浓度nodosin作用于HepG2细胞24 h后,用Western blot法检测caspase-3的蛋白水平。结果显示,pro-caspase-3和caspase-3的蛋白水平逐渐增加,呈现一定的量效关系(P<0.05或P<0.01)。Cleaved caspase-3的蛋白水平随着nodosin浓度的增加而增加(P<0.05或P<0.01),见图5。
讨 论
肝癌是死亡率最高的恶性肿瘤之一,严重威胁着人类的健康,肝癌的治疗主要依赖于手术和化疗药物的应用,但目前患者所使用的化疗药物,选择性较差,作用范围广泛,副作用较多,并且肿瘤细胞耐药性日益严重,因此,新型高效低毒抗肿瘤药物的开发和研究,日益受到重视。
中药作为中华民族的魂宝,具有毒性作用小、调理作用强和价格便宜等优点,因此,中药对肿瘤的治疗和预防作用日益受到国内外研究者的重视。香茶菜属植物具有广泛的抗肿瘤活性,如肝癌、胃癌和白血病等,溪黄草作为香茶菜属植物也具有类似的抗肿瘤特性。已有大量的资料证明,该类植物除了具有抗菌、消炎和抗风湿等作用外,还能明显地缩小多种实体瘤的体积,具有防病、治病肿瘤的功效。Nodosin属于二萜类化合物,是溪黄草的重要抗癌活性成分[4],在前期研究报道中nodosin具有良好的拮抗HepG2细胞生长增殖的活性[5]。Nodosin的基本化学结构为刚性骨架的四环二萜,具有不饱和环戊酮结构,对肿瘤细胞增殖的抑制效果明显。Nodosin对肿瘤细胞增殖的抑制主要是通过诱导肿瘤细胞凋亡实现的。

Figure 3.The effect of nodosin at different concentrations on the apoptotic rates of HepG2 cells. Mean±SD. n=6. *P<0.05, **P<0.01 vs 0 μmol/L.
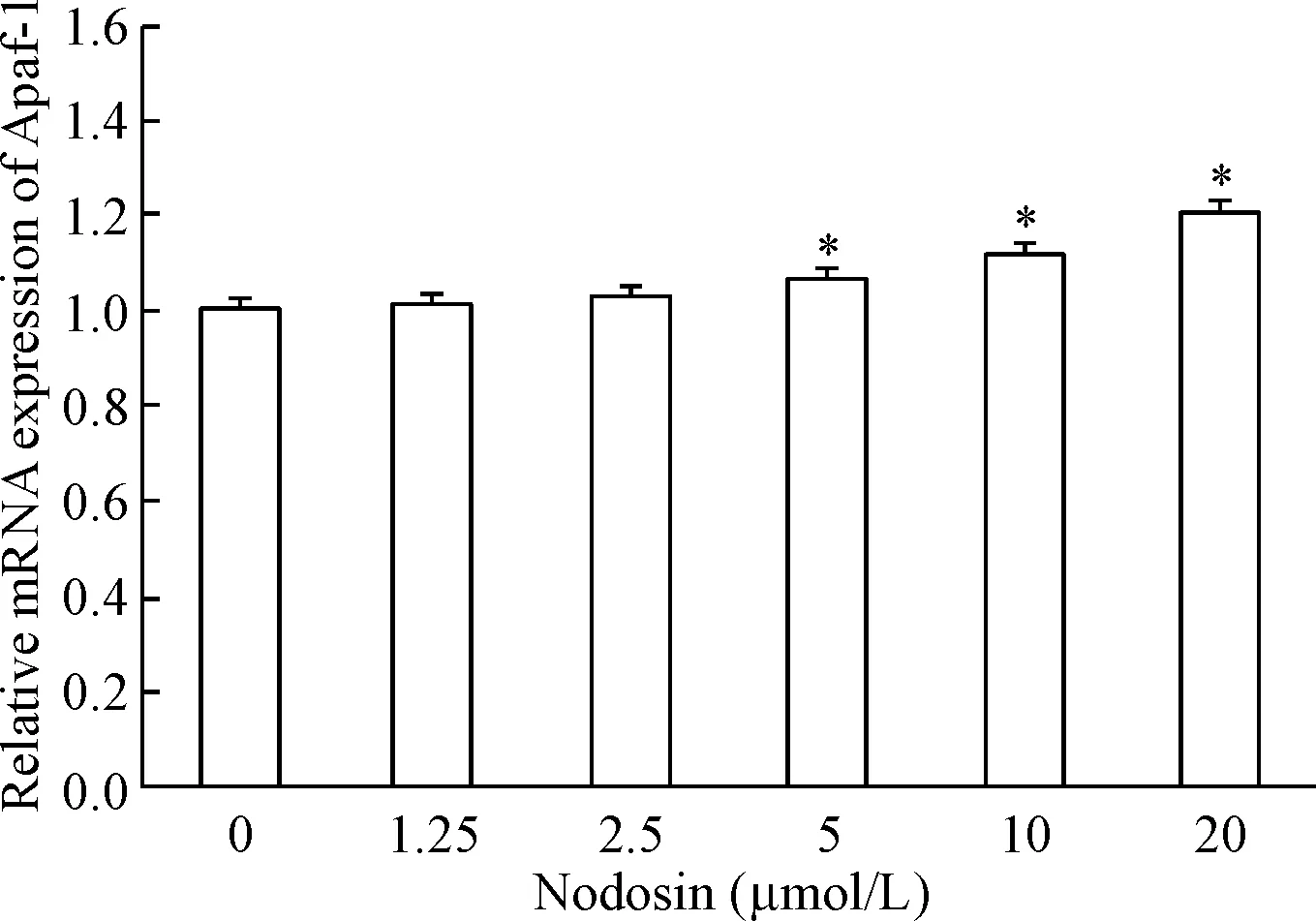
Figure 4.The effect of nodosin at different concentrations on the mRNA expression of Apaf-1 in the HepG2 cells. Mean±SD. n=3. *P<0.05 vs 0 μmol/L.
细胞凋亡是细胞死亡的一种自然生理学过程,这种死亡方式受到生理或者病理条件下细胞内特定基因操纵和调控,因此又称为程序性细胞死亡[6]。凋亡小体的形成是细胞凋亡的主要特征之一。本论文中荧光显微镜和电镜观察结果显示,不同浓度nodosin作用于HepG2细胞24 h后,细胞皱缩,细胞核偏移,细胞核呈现新月形,凋亡小体清晰可见,并且凋亡细胞数量随着nodosin浓度的增加而增加,提示nodosin对HepG2细胞的抑制作用是通过诱导细胞凋亡实现的。流式细胞术结果显示, HepG2细胞的凋亡率随着nodosin浓度的增加而增加,进一步提示nodosin对HepG2细胞的细胞毒作用是通过诱导细胞凋亡实现的。细胞凋亡的途径主要包括线粒体途径和死亡受体途径[7-8],上述2个途径的共同终末途径是caspase家族蛋白[9]。Apaf-1[10]在线粒体途径中发挥重要作用,它与细胞色素C和dATP形成凋亡小体,进而切割caspase-9前体,使其激活pro-caspase-3转变为caspase-3,进而诱导细胞的凋亡。本次实验结果表明Apaf-1 mRNA表达增加,提示其切割功能的增强,pro-caspase-3 和caspase-3表达量随着药物浓度的增加而增加,提示nodosin诱导HepG2细胞的凋亡最终激活了凋亡的终端途径,而该效应的发挥与Apaf-1的激活密切相关。在前期研究中我们还发现,nodosin可以通过增加Bax的表达,减少Bcl-2的表达诱导HepG2细胞的凋亡[11]。Bcl-2和Bax是线粒体途径中的2个调控因子,因而证实了nodosin对HepG2细胞诱导凋亡的作用是通过内源性途径即线粒体途径实现的。本次研究结果与前期研究结果一致。但nodosin是否在激活内源性途径同时激活外源性细胞凋亡途径,尚需进一步研究。
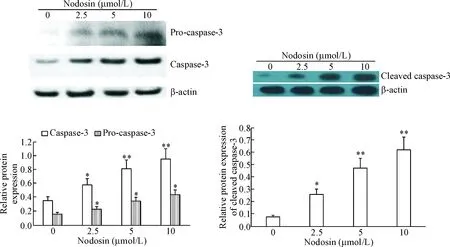
Figure 5.The effects of nodosin at different concentrations on the protein levels of pro-caspase-3, caspase-3 and cleaved caspase-3 in the HepG2 cells. Mean±SD. n=3. *P<0.05, **P<0.01 vs 0 μmol/L.

