Child-Pugh 与Rockall 评分评估肝硬化失代偿期上消化道出血短期预后价值比较
刘治智 李 巍
作者单位:浙江台州恩泽医疗中心(集团)路桥医院消化内科(台州318050)
肝硬化是一种或多种病因反复或长期作用在肝脏,而导致的慢性进行性弥漫性肝病,其中失代偿期主要是指肝功能降低以及门静高压引发的临床症状与体征[1]。而上消化道出血是其最常见的并发症之一,患者症状主要包括呕血、黑便,通常伴有血容量减少,易导致急性周围循环衰竭[2]。如出血量过大、出血不止或治疗不及时易导致失血性休克,直接危及患者生命安全,预后较差。因此,寻找有效的方式对肝硬化失代偿期上消化道出血患者进行预后评估显得尤为重要。其中Child-Pugh 分级是既往临床上应用较为广泛的评估肝硬化患者预后的手段之一,但随着近年来时代的不断发展,该评估手段逐渐显露出一定的局限性[3]。而Rockall 评分系统则是临床上用以评价急性上消化道出血的手段之一,在临床上应用较为广泛[4]。本文研究Child-Pugh 分级与Rockall评分评估肝硬化失代偿期上消化道出血短期预后价值并进行分析,旨在为有效评估肝硬化失代偿期上消化道出血短期预后提供参考依据。
1 资料与方法
1.1 病例选择 选取浙江台州恩泽医疗中心(集团)路桥区院2015 年2 月—2016 年8 月收治的肝硬化失代偿期上消化道出血患者100 例作为研究对象进行前瞻性分析。所有患者均知情并签署了同意书,本研究获得医院伦理委员会审核通过。
1.2 纳入、排除标准 纳入标准:(1)均经病史、临床症状及影像学检查结果确诊为肝硬化;(2)符合2000年全国传染病与寄生虫病学和肝病学术会议所制定的相关诊断标准;(3)临床及随访资料完整。排除标准:(1)伴有原发性肝癌者;(2)合并其他系统严重疾病者;(3)死亡原因与肝硬化并发症无关者;(4)治疗依从性较差者。
1.3 随访及分组 所有患者均给予常规水电解质维持平衡、防止并发症及纠正低蛋白血症等临床治疗。所有患者均随访4 个月,根据患者生存状态分为两组,分别为死亡组,33 例;存活组,67 例。记录并比较两组患者年龄、性别比、肝硬化病因等临床指标。
1.4 临床生化指标 所有患者入院后均进行血清胆红素(TBIL)、白蛋白(Alb)、肌酐(Cr)水平的检测,同时计算所有患者的Child-Pugh 分级与Rockall 评分情况。
1.5 Child-Pugh 分级判定标准 Child-Pugh 分级判定标准[5]主要根据患者肝性脑病、腹水、胆红素、白蛋白以及凝血酶原时间五项指标进行:无肝性脑病记为1 分,Ⅰ~Ⅱ肝性脑病记为2 分,Ⅲ~Ⅳ期肝性脑病记为3 分;无腹水记为1 分,腹水易消退记为2 分;腹水难消退记为3 分;胆红素低于34μmol/L 记为1分,胆红素在34~51μmol/L 范围内记为2 分,大红素>51μmol/L 记为3 分;白蛋白高于35g/L 记为1分,白蛋白在28~35g/L 记为2 分,白蛋白低于28g/L记为3 分;凝血酶时间在14 秒之内记为1 分,凝血酶时间在15~17 秒之间记为2 分,凝血酶时间高于18 秒记为3 分。五项总得分5~8 分记为A 级,9~11分记为B 级,11~15 分记为C 级。
1.6 Rockall 评分判定标准 Rockall 评分判定标准主要是根据患者的年龄、休克情况、收缩压、脉搏、伴发疾病、内镜诊断结果以及活动性出血等情况进行综合评价[6]:其中年龄<60 岁记为0 分,年龄在60~79岁记为1 分,年龄≥80 岁为2 分;无休克记为0 分;收缩压≥100mmHg(1mmHg=0.133kPa)记为1 分,<100mmHg 记为2 分;脉搏<100 次/min 记为0 分,≥100 次/min 记为1 分;无明显合并疾病记为0 分,合并心功能不全、缺血性心脏病或其他合严重合并症记为2 分,合并肾、肝功能不全或转移性肿瘤记为3分;内镜检查结果显示贲门黏膜撕裂综合征记为0分,所有其他诊断记为1 分,上消化道肿瘤记为2分;无活动性出血记为0 分,存在活动性出血记2分。总分12 分。
1.7 统计学方法 应用SPSS23.0 软件进行统计分析,计量资料数值以均数±标准差()表示,两组间比较采用成组t 检验;计数资料以百分比表示,两组间比较采用χ2检验。应用受试者工作特征(ROC)曲线下面积(AUC)分析Child-Pugh 分级与Rockall 评分系统对短期预后的预测价值。设定检验水准α=0.05。
2 结 果
2.1 随访情况及两组一般情况的比较 100 例患者其中男59 例,女41 例,年龄39~77 岁,平均(61.3±8.3)岁。均随访4 个月,随访结果患者死亡33 例,存活67 例,存活率33%。与死亡组相比,存活组年龄、性别比、肝硬化病因等临床指标无统计学差异(均P>0.05),见表1。

表1 两组肝硬化代偿期上消化道出血患者一般情况比较
2.2 两组临床生化指标比较 死亡组患者血清TBIL 及Cr 水平分别为(94.5±11.3)μmol/L、(132.8±28.2)μmol/L,均高于存活组(89.6±12.8)μmol/L、(120.6±31.5)μmol/L,而Alb 水平为(24.1±5.3)g/L,低于存活组的(26.3±6.4)g/L,但差异无统计学意义(P均>0.05)。
2.3 两组不同评分系统比较 与存活组相比,死亡组Child-Pugh 分级C 级的比例较高(P<0.001),而A级及B 级比例较低(P<0.001)。死亡组患者的Rockall评分显著高于存活组(P<0.001),见表2。
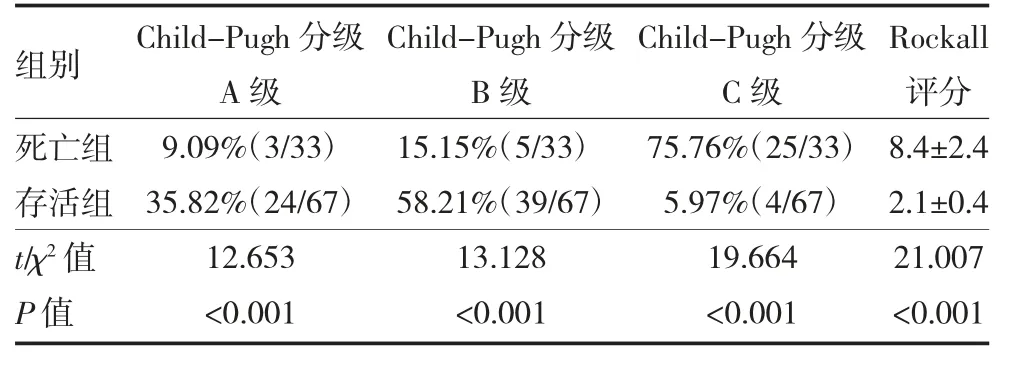
表2 两组肝硬化代偿期上消化道出血患者不同评分系统比较
2.4 两种评分系统预测短期死亡AUC 比较 Child-Pugh 分级及Rockall 评分系统预测短期死亡AUC 分别 为0.759(95%CI:0.702 ~0.818,P=0.018)、0.785(95%CI:0.735~0.836,P=0.011);两者联合预测短期死亡的AUC 分别为0.879(95%CI:0.811~0.942,P=0.003),见图1。

图1 Child-Pugh 分级及Rockall 评分系统预测短期死亡的ROC 曲线图
3 讨 论
肝硬化根据患者病情进展情况可分为代偿期与失代偿期,其中失代偿期主要是指肝功能减退以及门静脉高压引发的症状与体征[2]。而上消化道出血是该病患者易出现的严重并发症之一,患者均存在不同程度的出血征象,且通常出血量较大,速度迅猛,短时间内即可使患者出现休克,预后较差[7]。其中Child-Pugh 分级由于计算简便,目前被广泛应用于临床上对肝硬化患者的病情预后的评估[2]。但随着时代发展,Child-Pugh 分级用以评估肝硬化患者病情预后暴露出较多的局限。其中主要包括区分力较低、部分参数存在一定的实验误差、研究对象较为单一、对病情多变的患者评估效果较差等[8]。而Rockall 评分是应用于评估上消化道出血患者预后的方式之一,其主要内容包括年龄、休克情况、伴发疾病、内镜诊断结果以及活动性出血五个方面,应用较为广泛且具有一定的效果[4]。既往研究者认为,Rockall 评分并不适用于肝硬化食管胃底静脉曲张破裂出血的死亡风险预后评估,然而近年来有研究结果表明,Rockall 评分对肝硬化患者的再出血和死亡风险同样具有较好的判断价值。但是目前尚未见临床研究对Child-Pugh 分级和Rockall 评分在肝硬化失代偿期上消化道出血患者的短期预后预测价值进行比较,同时临床对此争议也较大,因此本研究对此进行探讨。
本研究结果显示,死亡组血清TBIL 及Cr 水平高于存活组,而Alb 水平则低于存活组,但是均无显著差异,这与国外研究报道一致,提示上述三项血清学指标不能有效评估肝硬化失代偿期上消化道出血的预后,因此需要寻找适宜的指标为临床早期治疗提供指导作用[9]。进一步分析显示,死亡组Child-Pugh 分级C 级的比例高于存活组,但是A 级及B 级比例较低,这显示不同预后结局患者Child-Pugh 分级存在差异,这与石玲燕等[10]的报道相似,说明随着Child-Pugh 分级的不断提高,肝硬化失代偿期上消化道出血患者的死亡率也逐渐升高,预后更差。因此,临床上可通过计算肝硬化失代偿期上消化道出血患者的Child-Pugh 分级,对其预后进行有效评价。同时死亡组患者的Rockall 评分显著高于存活组,表明Rockall 评分可用以评估肝硬化失代偿期上消化道出血患者的预后,且与王香莉等[11]的报道类似。应用ROC 分析显示,Child-Pugh 分级与Rockall 评分的AUC 均较高,并且两种评分系统联合评估的AUC更高,因此此两种评分系统联合评估可对上消化道出血患者的再出血以及死亡具有显著的判断性,有利于临床区分再出血率以及死亡率较高的患者,从而制定早期具有针对性的治疗方案,进一步改善患者预后[12]。
综上所述,Child-Pugh 分级与Rockall 评分评估肝硬化失代偿期上消化道出血短期预后均有较高价值,联合两种评价方式可显著提高对肝硬化失代偿期上消化道出血的短期预后评估的准确性,从而为临床相关治疗方案的制定提供指导作用。然而本研究的纳入病例数较少,因此本研究结论仍需要大样本多中心的临床研究予以进一步验证。

