一菌双酶法转化富马酸生成β-丙氨酸
陈明亮,祁 瑛,肖延铭,华 超,李敬亚,梁阿朋
(1.长兴制药股份有限公司 工业生物催化与转化浙江省工程研究中心,浙江 长兴313100;2.郑州大学 化学与分子工程学院,河南 郑州450001)
L-天冬氨酸(L-Aspartic acid)是一种常见的酸性氨基酸,在医药、食品、美容、化工和材料等方面具有非常广泛的用途[1-2]。以L-Asp为原料合成的阿斯巴甜和纽甜,适用于儿童、孕妇、哺乳期妇女以及肥胖、心血管病和糖尿病患者在内的所有人群[3-4]。L-Asp还参与鸟氨酸循环,可用作氨解毒剂、肝机能促进剂和疲劳恢复剂等药品以及食品添加剂[5]。工业生产L-Asp主要是由天冬氨酸转氨酶(L-Aspar-tase,EC4.3.1.1,AspAT)催化富马酸加氨合成,具有酶活力高、工艺简洁和设备投资少等优势,是当今生产 L-Asp的主流工艺[6-7]。β-Ala是自然界中唯一存在的β-型氨基酸,也是一种非蛋白氨基酸,存在于某些细菌、真菌和植物中[8]。β-Ala及其衍生物在医药、食品和化工等领域都有着广泛的应用。在医药方面,β-Ala用于合成泛酸、泛酸钙、肌肽、帕米膦酸钠和巴柳氮等[9];在化工方面应用于电镀、铅中毒解毒剂及合成甜味剂[10]。国内外β-Ala的生产主要以化学合成法为主[11],即以丙烯酸或丙烯腈为底物进行合成,此法生产过程中消耗大量能量,同时对环境和生物体都有一定的毒害作用。另一种生产方法是生物合成法,利用L-天冬氨酸α-脱羧酶(L-aspartateα-decarboxylase,EC4.1.1.11,PanD)、以 LAsp为底物催化生成β-Ala[12],此法专一性高且环保,缺点是L-Asp价格偏高。L-天冬氨酸α-脱羧酶催化L-天冬氨酸脱去α位的羧基生成β-Ala,是生物体内泛酸合成中重要的酶。酶法制备β-Ala的研究中,江南大学高宇通过偶联天冬氨酸转氨酶和L-天冬氨酸α脱羧酶直接以富马酸和氨为底物合成β-Ala,且产量达到9.8g/L[13]。
本研究将天冬氨酸转氨酶和L-天冬氨酸α脱羧酶构建于同一个载体质粒上,并导入大肠杆菌宿主进行表达,使得一次发酵即可得到两种酶。而后通过细胞通透处理和固定化细胞技术[14],使得发酵获得的酶可重复使用多次。该方法获得的酶可直接以廉价的富马酸和氨水为底物合成β-Ala,整个反应体系中无中间产物L-Asp积累,既简化了生产方法,又降低了生产成本。
1 材料与方法
1.1 材 料
1.1.1 菌株与培养基
大肠杆菌K12MG1655亚菌株(Escherichiacoli K12substrain MG1655),谷氨酸棒杆菌 ATCC 13032(Corynebacterium glutamicum ATCC 13032),E.coli DH5α,E.coli BL21(DE3)和pRSFDuet-1均由本公司保藏。
LB/Kana培养基:蛋白胨10g/L,酵母提取物5g/L,NaCl 5g/L。调节pH 至7.2,121 ℃灭菌20min。待培养基冷却至40~50℃,添加事先配制并过滤除菌后的卡那霉素(Kana),使其终质量浓度为50μg/mL。
TB/Kana培养基:蛋白胨12g,酵母提取物24g,甘油4mL,各组分溶解于0.9L水中,121℃灭菌20min。待其冷却到40~50℃,加入100mL灭菌后含有0.17mol/L KH2PO4和0.72mol/L K2HPO4的溶液,并添加事先配制好的过滤除菌后的卡那霉素溶液,使培养基最终质量浓度为50μg/mL。
1.1.2 生化试剂
富马酸、氨水、NaH2PO4和Na2HPO4购自国药化学试剂有限公司,L-天冬氨酸和β-丙氨酸购自阿拉丁,蛋白胨和酵母粉购自Oxoid,其余均为市售分析纯。
1.2 方 法
1.2.1 菌种构建
根据NCBI数据库中大肠杆菌K12MG1655亚菌株的天冬氨酸转氨酶基因序列和谷氨酸棒杆菌ATCC 13032的L-天冬氨酸α-脱羧酶PanD 基因序列分别设计引物,正向引物 AspAT-F-BamHI:5’-CGCGGATCCATGTTTGAGAACATTACCGC-3’,PanD-F-NdeI: 5’-GGAATTCCATATGCTGCGCACCATCCTCGGAAG-3’;反 向引物 AspAT-RNotI: 5’-ATAAGAATGCGGCCGCCAGCACTGCCACAATCGCTTC-3’, PanD-R-XhoI: 5’-CCGCTCGAGCTAAATGCTTCTCGACGTCA-3’(下划线部分为限制性酶切位点)。分别挑取Escherichiacoli K12MG1655 和 Corynebacterium glutamicumATCC 13032单菌落于LB液体培养基中培养14h后,收集菌体提取基因组,以此基因组为模板分别进行PCR,得到AspAT和PanD基因序列,扩增程序如下:94℃预变性5min,94℃变性30s,60℃退火30s,72 ℃延伸(AspAT1.5min,PanD1min),30个循环后72℃延伸10min。AspATPCR产物纯化后与质粒pRSFDuet-1分别用BamHI和NotI进行双酶切,所得酶切产物纯化后按一定比例在16℃进行过夜连接,随后转化到E.coli DH5α中,利用卡那霉素抗性筛选得到克隆菌株,提取质粒进行酶切验证和测序,获得正确的重组子pRSFDuet-1-AspAT。PanDPCR 产物纯化后与重组质粒pRSFDuet-1-AspAT 分别用NdeI和XhoI进行双酶切,所得酶切产物纯化后按上述方法进行过夜连接,随后转化到E.coli BL21(DE3)中,利用卡那霉素抗性筛选得到重组表达菌株,提取质粒后经双酶切和测序检测,获得重组表达菌株E.coli BL21(DE3)/pRSFDuet-1-AspAT-PanD。
1.2.2 重组菌发酵
将重组大肠杆菌E.coli BL21(DE3)/pRSFDuet-1-AspAT-PanD 接种于4mL卡那霉素质量浓度为50μg/mL的LB液体培养基,37℃,200r/min振荡过夜培养。将上述过夜培养物按1%的接种量接种于卡那霉素质量浓度为50μg/mL的TB液体培养基,37℃,200r/min振荡培养菌液至OD600为0.6~0.8,加入IPTG 至终浓度为0.3mmol/L,25℃诱导培养16~20h,培养液于5 000r/min离心15min,收 集 菌 体 细 胞,用 0.1mol/L 的NaH2PO4/Na2HPO4(pH 7.5)缓冲液清洗菌体一次,通过SDS-PAGE分析鉴定重组蛋白表达水平。
1.2.3 检测方法
β-Ala测定:反应液用苯基异硫酸酯(PITC)衍生。具体步骤为:取500μL反应液于1.5mL离心管中,加入250μL 0.1mol/L PITC乙腈溶液和250μL 1mol/L三乙胺乙腈溶液,充分混匀,避光室温放置0.5h,加入700μL正己烷溶液,涡旋振荡器振荡1min,静置30~60min,吸取下层溶液,经0.22μm有机滤膜过滤,进样量为10μL。
β-丙氨酸衍生产物用HPLC测定。色谱柱为LaChrom C18(5μm,4.6mm×250mm);流动相 A溶液为体积分数为80%的已腈水溶液,B溶液为V(乙酸钠)∶V (乙腈)=97∶3,pH 6.5的0.1mol/L乙酸钠-乙腈溶液;采用梯度洗脱,0~20min,B溶液的流速由95%下降到65%;20~30min,B溶液流速由65%上升到95%;30~35min,B溶液梯度不变。检测波长为254nm,柱温为40℃。
1.2.4 通透处理
由于表达的AspAT和PanD都是胞内酶,细胞被膜(细胞壁和细胞膜)的屏障作用限制了底物及产物在细胞内外的交换,因此菌体的表观催化活力较差。细胞透性化技术可以在不破坏细胞整体有机体系的情况下改变细胞被膜的通透性,使得小分子和一些较大分子物质能够自由进出细胞,使胞内酶在相对稳定的细胞内环境中发挥作用,从而提高菌体催化效率[15]。
将1.2.2中获得的菌体按50g/L的质量浓度重悬于0.1mol/L的 NaH2PO4/Na2HPO4(pH 7.5)缓冲液中,按5mL/L菌悬液体积分数加入甲苯,于37℃,100r/min转速下振荡处理1h,离心收集菌体,用0.1mol/L的 NaH2PO4/Na2HPO4(pH 7.5)缓冲液清洗两次后置于4℃环境中备用。
1.2.5 酶活检测
称取10g富马酸,加入 适量0.1mol/L 的NaH2PO4/Na2HPO4(pH 7.5)缓冲液搅拌均匀,缓慢加入浓氨水,调节pH到7.5后用缓冲液定容至100mL,然后在该体系中加入1.2.4中通透处理过的菌体1g,37℃,200r/min下进行酶促反应15min,终止反应时取适量反应液于100℃煮沸10min,12 000r/min离心10min,取上清,用0.22μm微孔有机滤膜过滤,利用HPLC检测β-Ala浓度。
酶活定义:在pH 7.5,温度37℃的条件下,每小时转化生成1μmo/Lβ-Ala的酶量,定义为一个酶活力单位μmol/(g·h),简称 U/g。
1.2.6 固定化细胞制备
向90mL纯化水中加入10g经通透处理过的菌体和0.6g硅藻土,振荡均匀,加入质量分数为5%的聚乙烯亚胺溶液3mL,于28℃,100r/min振荡交联1h,再加入质量分数为25%的戊二醛溶液1mL继续振荡交联1h,结束后抽滤收集固定化细胞,清水淋洗3次,置于4℃环境温度下备用。
1.2.7 固定化细胞最适反应温度及热稳定性
按照1.2.5中酶活测定方法,分别在30,35,40,45,50,55,60,65,70 ℃测定酶活以确定最适反应温度。
将固定化细胞分别在以上温度下放置12h,然后在37℃条件下测酶活,比较不同温度下固定化细胞的稳定性。
1.2.8 固定化细胞最适pH以及pH稳定性
配制0.1mol/L,pH 为 5.5,6.0,6.5,7.0,7.5,8.0,8.5,9.0,9.5和10的柠檬酸缓冲液、磷酸盐缓冲液和Tris-HCl缓冲液,分别用以上不同pH的缓冲液作为反应介质测定酶活以确定最适pH。
将固定化细胞分别用以上缓冲液在10℃下保存12h,然后在pH 7.5条件下测酶活,以确定不同pH条件下固定化细胞的稳定性。
1.2.9 固定化细胞加酶量及底物质量浓度对转化反应的影响
设定富马酸质量浓度100g/L不变,改变固定化细胞的量,使得富马酸完全转化为β-Ala,以确定最适的固定化细胞投加量。
用固定化细胞分别催化质量浓度为100,150,200,250,300,350,400,450g/L的富马酸转化为β-Ala,HPLC检测β-Ala含量,以确定最高底物质量浓度。
1.2.10 固定化细胞重复使用次数
按照1.2.7~1.2.9中优化好的条件,重复使用固定化细胞催化富马酸转化成β-Ala,跟踪检测其每次转化最终β-Ala的浓度。
2 结果与讨论
2.1 酶活检测
在100mL质量浓度为100g/L的富马酸溶液中加入1g通透细胞,37℃,200r/min下酶促反应15min,生成质量浓度为19g/L的L-Ala,酶活为85.4U/g。
2.2 固定化细胞
10g通透细胞重悬于90mL纯水后菌悬液酶活为8.5U/mL,固定化完成后,得固定化细胞13.4g,酶活为40.9U/g,酶活回收率约64.2%。
2.3 固定化细胞最适反应温度及热稳定性
固定化细胞的最适反应温度实验结果如图1(a)所示。随着反应温度的升高,固定化细胞的酶活呈现先上升后下降趋势,在50℃条件下酶活最高,45℃条件下与50℃时相差不大。固定化细胞的热稳定性实验结果如图1(b)所示,酶的热稳定性在较低的温度范围内较好,在45℃以下酶活基本无损失,在较高的温度下酶活损失非常快,55℃下酶活便迅速下降,为30℃酶活的66%。由以上实验结果得出:固定化细胞反应最适温度为50℃,但酶的稳定性在45℃以下时保持稳定。因此,固定化细胞在催化富马酸转化为β-Ala时选择45℃比较合适,能够在保证较高酶活的同时保持较高稳定性。

图1 固定化细胞最适反应温度及热稳定性Fig.1 Optimum reaction temperature and thermal stability of immobilized cells
2.4 固定化细胞最适pH及pH稳定性
固定化细胞的最适反应pH实验结果如图2(a)所示,随着pH的上升,固定化细胞的酶活呈现先升后降的趋势,最适pH为7.5。固定化细胞在不同pH条件下的稳定性如图2(b)所示,在pH 6.5~8.5的范围内有较好的稳定性。因此,固定化细胞在催化富马酸转化为β-Ala时选择pH 7.5比较合适,能够在保证较高酶活的同时保持较高稳定性。

图2 固定化细胞最适pH以及pH稳定性Fig.2 Optimum pH and pH stability of immobilized cells
2.5 固定化细胞投加量及底物质量浓度对转化反应的影响
在100mL质量浓度为100g/L的富马酸溶液中加入不同量的固定化细胞,45℃,200r/min下进行酶促反应,固定化细胞的投加量与β-Ala的产率如图3(a)所示。随着投酶量的加大,β-Ala的产率也随之上升,当固定化酶加到3g时,β-Ala的产率达到最大,继续增加投酶量,β-Ala的产率不变。因此固定化细胞的贡献率为3.3,即1g固定化细胞可催化3.3g底物。
固定化细胞催化过程中底物质量浓度与β-Ala的产率如图3(b)所示。底物在质量浓度达到300g/L(包括300g/L)前均可被完全转化成β-Ala,超过300g/L后β-Ala的产率开始下降。随着底物富马酸质量浓度的增加,产物β-Ala的质量浓度也在不断地增加,当β-Ala达到一定质量浓度后会抑制反应的进行,使得β-Ala的产率下降,故该固定化细胞可催化的最高底物质量浓度为300g/L。

图3 固定化细胞投加量及底物质量浓度对转化反应的影响Fig.3 Effect of immobilized cell dosage and substrate concentration on transformation reaction
2.6 固定化细胞重复使用次数
根据2.3~2.5得出的试验结果,在pH 7.5,温度45℃,200r/min条件下用固定化酶催化质量浓度为300g/L的富马酸转化成β-Ala,每次转化结束后将固定化细胞回收洗净再继续转化下一批,测得β-Ala的产率与固定化细胞使用次数的关系如图4,固定化细胞可连续使用12次。
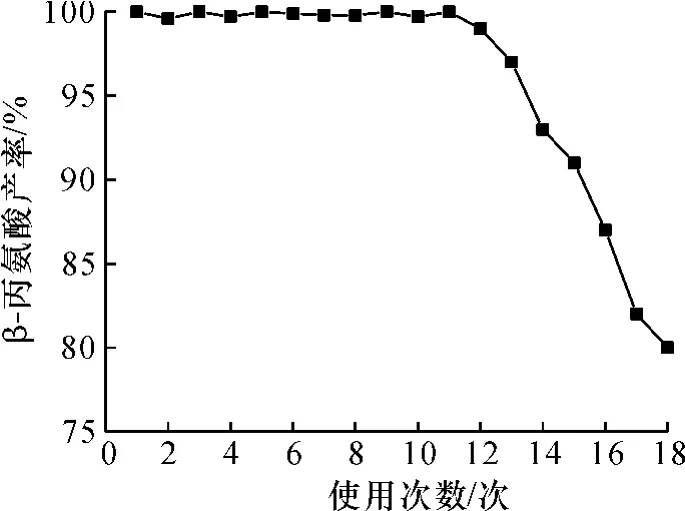
图4 β-Ala的产率与固定化细胞得使用次数的关系Fig.4 The relationship between the yield ofβ-Ala and the number of times of immobilized cells
3 结 论
将AspAT和PanD酶构建入同一大肠杆菌表达载体并成功表达了两个酶,将菌体做通透处理并固定化,固定化酶活回收率为64.2%,固定化细胞贡献率为3.3,在pH 7.5,温度45℃时最高可将质量浓度为300g/L的富马酸完全转化成β-Ala,固定化细胞可连续使用12次。该方法获得的酶以廉价的富马酸和氨水为底物,整个反应体系中无中间产物L-Asp的积累,简化了生产方法,有效降低了生产成本。

