基于电子鼻技术的马铃薯真菌性腐烂病早期检测
,,,,,
(江苏大学食品与生物工程学院,江苏镇江 212013)
马铃薯所含营养成分丰富,是世界上的第四大粮食作物。中国是全球第一大马铃薯生产国,马铃薯产量及消费面不断扩大,其种植面积也在相应扩增[1]。马铃薯在生长和贮藏期都易受各种病菌的侵染而发生不同程度的腐烂,且腐烂极易扩散,造成巨大的经济损失[2]。随着我国马铃薯主食化战略的提出,由马铃薯腐烂造成的经济损失进一步引起人们的关注,对腐烂样本进行检测并及时剔除,减少因感染而引起的大面积腐烂变得尤为重要。
现阶段常用的马铃薯腐烂的无损检测方法主要有机器视觉、近红外、高光谱等检测方法,与人工相比,无损检测方法提高了检测速度,但存在检测指标片面、数据处理复杂等不可忽略的缺点[3-4]。面对现有检测方法的局限性,能否建立一种快速的无损检测方法,对由致病菌引起的马铃薯腐烂样本进行检测,及时剔除腐烂潜伏期、早期和中期的样本,减少因感染而引起的大面积腐烂已成为影响农民增收的一个关键问题。
真菌侵染后的样本随时间的延长其菌种含量逐渐增多,菌种活性不断增强,所产生的代谢产物的量也不断增加,进而导致样本所释放的气体种类及强度不断变化。因此本文提出采用电子鼻技术对真菌性腐烂病进行快速检测。电子鼻是一种由气敏传感器阵列和适当的模式识别方法组成的智能气味检测设备,主要用来检测、分析以及辨别样本的整体气味信息。近年来,国内外学者Massimo F Rutolo、E Biond、朱娜、蒋雪松等[5-8]也探索了电子鼻在检测马铃薯、草莓腐烂和食品微生物污染中的可行性,均取得了较理想的效果。由真菌导致的马铃薯腐烂病早期样本外部无明显变化,因此不能直接得到检测样本,有关马铃薯腐烂病检测方法研究的现有报道中,均需通过侵染实验制备得到各阶段样本,且所用菌种多通过直接购买得到,但不同地区马铃薯主要致腐菌各不相同,因此对实际应用指导性不强。本文首先从自然存放过程中腐烂的马铃薯中分离鉴定出主要致腐菌,以此菌种为病原菌进行侵染实验,制备得到马铃薯腐烂样本,用于电子鼻检测。使用电子鼻技术与模式识别算法相结合,对侵染不同阶段的样本进行判别,以期为马铃薯早期腐烂检测提供理论参考。
1 材料与方法
1.1 材料与方法
马铃薯 镇江农户,将样本室温下存放待用;菌株M-5 分离于存放过程中自然腐败的马铃薯,经纯化后低温保存于本实验室;马铃薯葡萄糖培养基(PDA,g/L) 马铃薯200,葡萄糖20,琼脂粉20,蒸馏水1000 mL,pH自然;DNA抽取试剂盒、PCR反应试剂、核酸提取所需试剂、DNA Marker 上海生工。
电子鼻 图1,由江苏大学食品、农产品品质无损检测技术研究中心自主研制;恒温恒湿箱SPX系列 上海琅玕实验设备有限公司;生物显微镜(MR-2000) 江南光学仪器厂;电泳仪(DYY-12型) 北京六一公司;ABI基因扩增仪 美国ABI公司;GR85DR型全自动高压灭菌锅 致微(厦门)仪器有限公司。

图1 电子鼻系统结构示意图 Fig.1 The schematic diagram of electronic nose system注:1:集气室,2:待测样本,3:泵,4:反应气室,5:传感器,6:电磁阀a,7:气路管路,8:电磁阀b,9:氧气罐,10:计算机。
1.2 实验方法
1.2.1 菌株的分离纯化与筛选 采用组织分离法分离菌种:在无菌操作台上,将存放过程中自然腐烂的马铃薯用75%酒精进行表面消毒,用灭菌后的药匙挖取适量腐烂组织,放入装有10 mL无菌生理盐水的试管中,制备成10-1的果肉稀释液。振荡混匀后将液体逐级梯度稀释至10-8。分别选取10-5、10-6、10-7、10-8四个稀释梯度,取适量悬浊液涂布,置于25 ℃恒温恒湿箱内培养。经多次纯化后获得单菌落平板,4 ℃存放备用。
将分离纯化得到单菌落接种至正常马铃薯中,每株菌种感染20个正常样本,持续2个月观察感染样本的腐烂状况,依据腐烂结果筛选出致腐烂菌,用于后期腐烂样本的制备。
1.2.2 致腐菌分子鉴定 筛选得到的致腐菌进行分子鉴定,确定其菌体菌种。具体操作如下:
DNA提取:采用Ezup柱式真菌基因组DNA抽取试剂盒进行DNA提取,略作修改。
PCR扩增体系25 μL:加入12.5 μL supermix酶、ITS1和ITS4引物各加入1 μL,2 μL样品和8.5 μL的超纯水。PCR反应条件为:95 ℃预变性5 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸1 min;循环30次;72 ℃延伸10 min。PCR反应结束后,进行琼脂糖凝胶电泳实验,验证是否获得目的片段。确定获得目的片段后将其送往上海生物工程技术服务有限公司进行基因测序。
1.2.3 腐烂样本制备 以鉴定得到的马铃薯主要致腐菌为病原菌,采用整薯刺伤接种法[9]制备得到腐烂样本。具体操作如下:选取完好整薯120个,大小适中,经消毒预处理后进行打孔接菌。用灭菌后的打孔器在每个整薯上打4个孔,4个孔沿纵轴方向均布,每个孔垂直于纵轴。将培养好的致腐菌A.pullulans的单菌落刮至装有5 mL生理盐水的试管中,制备成菌悬液。用移液器吸适量菌悬液注射至孔内,每个整薯沿纵轴方向连续接种3个点,最后一个点接相同体积的无菌水做为对照。经血球计数板计测,接种菌浓度为2×108CFU/mL,样本接菌后在28 ℃,95% RH的恒温恒湿箱中培养。制备得到的马铃薯被分为三个阶段,且每阶段样本数为30个。第一阶段潜伏期,接种5 d后外部并无异样;第二阶段感染早期,接种18 d后样本外部可观察到霉菌丝;第三阶段感染中期,接种35 d后样本外部开始腐烂。
所有阶段样本先采用电子鼻进行测定,然后将薯块沿纵轴切开,测量腐烂斑的最大直径,求出平均值。
1.2.4 电子鼻测定 采用图1所示电子鼻进行检测,传感器阵列主要由TGS832、WSP2110、TGS822、TGS813、TGS880、TGS2610、TGS2611、TGS2620组成。将侵染制备得到的马铃薯腐烂样本分别放入800 mL圆柱形无味玻璃容器中进行集气,集气时间为40 min,从而获得顶空气体;电子鼻预热3 h,每次电子鼻检测开始前,使用氧气对电子鼻系统进行还原,还原完成后,电子鼻抽取密闭容器中的顶空气体,对马铃薯样品进行检测;检测过程中按照1次/s的速率记录传感器响应信号,共采集420个信号值;120个样本依次进行测定,从而得到传感器阵列对不同检测样品的响应曲线。
1.3 数据处理
获得菌株序列后,通过NCBI网站进行序列比对分析。然后运用DNAStar软件,生成系统发育树进行同源性及聚类分析。
电子鼻测定得到的信号曲线趋于稳定时,表明样本气体已与传感器充分反应,因此选用稳定值的平均值作为特征变量进行建模。从120个测定样本中随机选取80个样本作为训练集,40个样本作为预测集,分别建立K最近邻和BP-神经网络判别模型,对接菌后不同阶段的马铃薯进行判别,所有数据分析均在MATLAB 2010.b软件上实现。
2 结果与分析
2.1 致腐烂菌种的鉴定
分离纯化后共得到5株菌株,2个月后各菌株感染实验结果如下:接种菌种1与菌种3的样本无明显变化,样本切开后孔径内壁已干结并无腐烂现象;接种菌种4的样本外部有黄绿色霉斑,切开后孔径内为黄绿色斑点但并未腐烂;接种菌种5的样本初期外部有黑色菌丝生长,后期外部开始腐烂,切开样本后内部均发生不同程度的腐烂。依据致腐烂性验证实验结果,确定出菌种5(M-5)为马铃薯主要致腐菌,其菌落形态如图2所示。

图2 菌种M-5菌落图Fig.2 Bacterial M-5 colony map
菌株M-5的ITS区扩增产物与蛋白Marker扩增产物电泳图如图3所示,对比后确定此菌株ITS区长度约600 bp。回收DNA片段并测序,得到菌株的ITS序列。对上述PCR扩增产物进行序列测定(图4),将序列在NCBI网站(http://www.ncbi.nlm.nih.gov)上进行同源性比较(BLAST),并构建系统发育树,结果如图5所示。经系统发育树匹配后M-5菌种与Aureobasidiumpullulans同源性为100%,结合形态观察,最终鉴定菌株5为出芽短梗霉菌A.pullulans。经查,果蔬微生物生态学研究中有关于A.pullulans分离株的报道[10],但关于出芽短梗霉在马铃薯腐烂样本中的报道还未发现。

图4 M-5菌株ITS区序列Fig.4 ITS sequence of A.pullulans
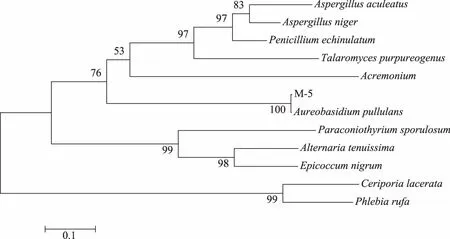
图5 根据ITS序列构建的系统发育树Fig.5 The phylogenetic tree based on ITS sequence

图3 ITS区PCR产物电泳结果Fig.3 Electrophoresis results of ITS PCR products注:Marker为蛋白标准物,M-5为待测菌株5。
2.2 不同腐烂阶段的马铃薯样本识别
经电子鼻测定后,采集得到侵染后各腐烂阶段马铃薯样本的气味信息值,如图6中(a)和(b)分别为腐烂潜伏期与腐烂中期样本响应曲线。由图6可知,当采集值370 s时样本值已达到稳定,因此提取380~400 s的平均值作为马铃薯品质判别的特征值,建立马铃薯腐烂阶段判别模型。

图6 样本传感器响应曲线Fig.6 Response curve of electronic nose
2.2.1 马铃薯腐烂阶段的K最近邻法判别分析 对腐烂潜伏期、早期和中期三个阶段样本的内部腐烂直径进行统计,分别为(3.55±0.6)、(5.48±1.05)、(7.22±2.1) mm。建模时,考虑了不同主成分数和最近邻样本个数对模型的影响,采用留一法交互验证的方式对这两个参数进行优化,得到性能最佳模型,结果如图7所示,当主成分数为6,K值为4时模型判别效果最优,其中训练集的识别率为90%,预测集识别率为85%。模型中正常样本与侵染样本被完全区分开,误判主要发生在潜伏期与早期之间,共有5个潜伏期样本被误判为早期。主要原因是侵染后这些样本中菌种横向生长,故虽外部未有异样,但内部腐烂直径接近5.5 mm,样本气体强度与感染早期样本相近,因此误判。共有1个腐烂早期样本被误判为潜伏期,主要是接种后菌种纵向生长,样本孔径外部虽有菌丝长出,但内部腐烂程度不足4 mm,气体强度较弱。

图7 KNN模型训练集和预测集的识别能力Fig.7 Discrimination rates of training set and prediction set by KNN model
2.2.2 马铃薯腐烂阶段的人工神经网络判别分析 误差反向传播神经网络(Back propagation artificial neuron network,BP-ANN)是一种反向传递并修正误差的多层映射神经网络,一般用来处理非线性的分类问题、两个相关数据矩阵间复杂的非线性模型关系[11-12]。模型参数设置如下:隐含层数为12,最大迭代次数1000,学习速率0.1,动量因子0.7,训练目标为误差≤10-8。模型结果如表1所示,样本训练集的正确率为93.75%,测试集的正确率为90.00%,预测集准确率相比KNN模型提高了5%。表1显示,误判主要发生在腐烂中期,主要原因是此三个样本虽外部腐烂直径较大,但其腐烂深度较浅,因此气味信息较淡,被误判为腐烂潜伏期与早期。所建的BP-ANN模型将正常样本与腐烂各阶段样本进行较好区分,潜伏期样本与早期样本之间不再重叠。此结果表明,利用电子鼻技术与BPANN判别模型相结合,不仅可以实现对腐烂早期样本的识别,还可以对侵染后各阶段样本进行较精确的区分,及时将侵染样本与正常样本进行区分,避免因感染而导致的不必要损失,为后期电子鼻技术应用至马铃薯腐烂早期检测提供理论依据。

表1 BP神经网络判别结果Table 1 Discrimination results of BP-ANN
3 结论
本研究从存放过程中自然腐烂的马铃薯中分离、纯化并鉴定出马铃薯致腐烂菌种,将鉴定出来的主要致病菌对样本进行侵染;采用电子鼻技术对浸染后不同阶段的腐烂样本进行检测,探讨了电子鼻对马铃薯腐烂早期识别的可行性。依据常帆等人的研究可知,出芽短梗霉代谢产物中有较多的淀粉酶和果胶酶[13]。此菌在马铃薯样本中寄存生长后将导致样本内部组织分解,进而腐烂。本实验表明,出芽短梗霉在一定环境条件下,作为马铃薯致腐烂的主要菌种,导致大量的经济损失。马铃薯在致病菌的作用下不断腐烂,腐烂不同阶段产生的气体成分种类和含量会有所不同,采用电子鼻技术对样本进行检测。建立KNN线性判别模型后训练集识别率为90%,预测集识别率为85%,可见电子鼻对侵染后样本检测是有效的。采用BP-ANN模型对不同腐烂阶段的马铃薯样本进行判别,其模型识别率训练集为93.75%,预测集为90.00%,所建BPANN模型不仅可以将正常样本与腐烂样本进行区分,还对腐烂各阶段进行了较好的识别。此结果表明了将电子鼻应用于马铃薯早期腐烂检测的可行性,为后期电子鼻在马铃薯检测中的应用提供理论依据。

