抗坏血酸和硫脲还原液相Se(Ⅳ)及Se(Ⅵ)产物的光谱研究
张巩俐, 姚淑华
(沈阳化工大学 应用化学学院, 辽宁 沈阳 110142)
硒是生命体必须的微量元素.不论是对植物还是对动物,适量的硒会参加生命体的抗氧化功能,调节甲状腺激素和免疫系统的新陈代谢,促进植物生长[1].然而,过量的硒能造成生命体中毒,严重的会导致死亡[2-4].在自然环境中,硒存在于天然地质岩中,例如磷酸盐岩、煤和黑色页岩.硒的人为来源包括煤矿、磷酸盐矿、硫化矿、沥青开采、燃煤发电厂、农业、玻璃制造和轻电池的冶炼[5-9].硒作为环境污染物,世界各国都给出其排放浓度.在采矿废水中,硒排放浓度在0.003~12 mg/L[10].在饮用水中,世界环保组织和美国环保局规定硒的质量浓度在40 μg/L[11]和50 μg/L[12],但是我国和欧盟的标准为10 μg/L[13].硒是一种非金属元素,有不同的氧化态:单质硒(Se0)、硒化物(Se2-)、亚硒酸盐[Se(Ⅳ)]、硒酸盐[Se(Ⅵ)]以及有机硒[9].在工业废水处理中,亚硒酸盐和硒酸盐作为常见的废水污染物,目前研究者给出很多处理含硒废水的方法,例如将亚硒酸盐和硒酸盐还原到单质硒.单质硒在自然环境中是比较稳定的形态,如果将高价态的含硒污染物还原到单质硒,这不仅有利于单质硒的收集,还能增加还原产物的稳定性.因此,研究亚硒酸盐和硒酸盐还原产物是否为单质硒至关重要.亚硒酸盐比硒酸盐更容易还原,这与二者的氧化还原电位有重要关系[14].亚硒酸盐和硒酸盐还原到单质硒,目前常用的还原剂为二价铁[15]、硫脲[16]、零价铁[17]、绿锈[18]、以及腐殖酸[19]等.这些作者更注重实验的研究,对还原固体产物的光谱研究较少.本实验采用抗坏血酸、硫脲及抗坏血酸-硫脲(质量比为1∶1)混合液作为还原剂,分别对Se(Ⅳ) 和 Se(Ⅵ)在酸性溶液中进行还原,采用拉曼、红外和XRD等技术手段对固相产物进行分析表征,以期对Se(Ⅳ) 和 Se(Ⅵ)还原产物的组成提供理论支持.
1 实验部分
1.1 实验药品
所有试剂均为分析纯.亚硒酸钠、硒酸钠,质量分数为98 %,山东西亚化学工业有限公司;硫脲、抗坏血酸,天津大茂化学试剂厂;盐酸,天津风船化学试剂科技有限公司.所有的玻璃器皿在使用前都是浸泡在体积分数为5 %的硝酸溶液中至少12 h,并且用蒸馏水至少冲洗3次.
1.2 实验方法
将50 g/L抗坏血酸、50 g/L硫脲及抗坏血酸-硫脲(质量比为1∶1,以下同)混合液分别加入到含Se 200 mg/L的亚硒酸钠和硒酸钠酸性溶液(1.2 mol/L盐酸)中,混合均匀反应24 h,固体产物自然干燥,并研磨均匀.
1.3 表征方法
拉曼光谱采用Thermo Fisher公司DXR型拉曼光谱仪分析测定,激发波长789 nm.红外光谱采用Thermo Fisher公司Nicolet 6700傅里叶变换红外光谱分析仪测定,模式为衰减全反射傅里叶变换红外光谱技术(ATR-IR),4 cm-1分辨率,扫描64次,扫描范围4 000~400 cm-1.XRD采用德国Bruker公司D8型X射线衍射仪分析测定,铜靶(Kα射线,λ=0.154 06 nm),扫描角度为2θ(5°~90°),步长为0.02°,采集时间为0.2 s/step.
2 结果与讨论
(1)
H2SeO3+4H++4e-=Se+3H2O
(2)
式(1)和(2)的氧化还原电位分别为1.09 V和0.741 V,这显示水溶液中Se(Ⅵ)可以还原到Se(Ⅳ),Se(Ⅳ)可以还原到单质硒[16].
本研究采用抗坏血酸、硫脲及抗坏血酸-硫脲混合液作为还原剂在酸性溶液中分别还原液相Se(Ⅳ) 和 Se(Ⅵ),还原产物采用拉曼、红外和XRD等进行分析表征.
2.1 抗坏血酸还原Se(Ⅳ) 和 Se(Ⅵ)产物分析
抗坏血酸作为还原剂还原Se(Ⅳ),发生如下反应:

Se0+2C6H6O6+3H2O
(3)
在上述反应中,j=0-2和i=0-2[20].理论上抗坏血酸可以将Se(Ⅳ)还原到单质硒.
抗坏血酸、单质硒及抗坏血酸还原Se(Ⅳ)的固体产物的拉曼光谱和XRD如图1所示.


图1 抗坏血酸、单质硒及抗坏血酸还原 Se(Ⅳ) 固体产物的拉曼光谱和XRDFig.1 Raman and XRD patterns of standard solids (ascorbic acid,elemental selenium) as well as reacted solid from ascorbic acid with Se(Ⅳ)
从拉曼光谱中可以看出:抗坏血酸还原Se(Ⅳ)固体产物吸收峰在~247 cm-1处,和标准单质硒(~233 cm-1)的拉曼光谱图相比有一个大的半峰宽,还原固体的宽的吸收峰可能是由于生成纳米硒[21]或者硒的半晶状形态,或者由于伸缩震动形成Se—Se键纳米晶体而导致的结果.Hemalatha等[21]实验结果给出拉曼光谱,也观察到相似的峰在~250 cm-1;苑芳惠[22]也给出相似的结果,原因是形成纳米晶体三角晶硒相.从XRD谱图分析结果中可以看出:没有明显的单质硒晶体衍射峰,而是观察到两个较宽的峰值.Ezhuthupurakkal等[23]给出相似的研究结果.XRD数据结果和拉曼光谱结果相同,表明产生的沉淀是纳米硒,而非晶体硒.
抗坏血酸及抗坏血酸还原Se(Ⅳ)的固体产物的红外光谱如图2所示.红外光谱分析结果显示抗坏血酸的基团和化合键的吸收峰,没有硒和抗坏血酸结合的吸收峰.这表明还原产物与抗坏血酸之间没有发生反应,生成的产物作为独立相存在.红外光谱分析结果与拉曼光谱和XRD光谱分析结果相符.
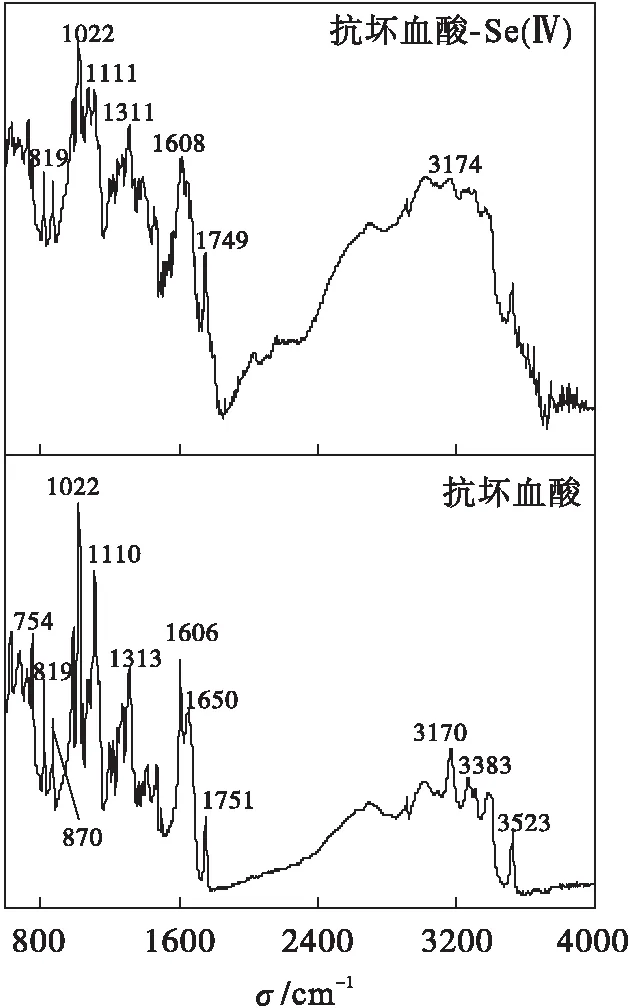
图2 抗坏血酸及抗坏血酸还原Se(Ⅳ) 固体产物的红外光谱Fig.2 IR patterns of standard solid of ascorbic acid as well as reacted solids from ascorbic acid with Se(Ⅳ)
对于抗坏血酸还原Se(Ⅵ)的情况,反应溶液中没有沉淀形成.实验采用原子荧光光谱仪检测液相,并没有发现Se(Ⅳ)的存在,表明在此反应过程中没有低价态硒形成.没有固体产物产生可能是由于形成可溶的Se(Ⅵ)-抗坏血酸化合物或者是在酸性条件下反应比较慢所导致.
2.2 硫脲还原Se(Ⅳ) 和 Se(Ⅵ)产物分析
硫脲作为还原剂,其本身在还原条件下很容易被氧化,氧化还原电位为0.42 V[21].通常在酸性溶液中,硫脲有两种可能的异构体存在:
S==C(NH2)2↔SH—C(NH)—NH2
(4)
NH2—C(NH)—S—S—C(NH)—NH2+
2e-+2H+=2NH2—CNH—SH
(5)
Qiu等[16]给出硫脲和Se(Ⅳ)的反应,反应方程式如下:
Se(Ⅳ)+6NH2—C(NH)—SH=
[NH2—C(NH)—S—Se(Ⅱ)—S—
(NH)C—NH2]+2[NH2—C(NH)—
S—S—(NH)C—NH2]
(6)
在上述反应中,有硫硒相化合物产生,因此,理论上硫脲可以还原亚硒酸盐到低价态硒.
硫脲、单质硫和单质硒及硫脲分别还原Se(Ⅳ) 和 Se(Ⅵ)的固体产物的拉曼光谱和XRD如图3所示.拉曼光谱分析结果表明:硫脲还原Se(Ⅳ) 产生的固体产物的吸收峰在~233 cm-1处,这表明有Se—Se结构的存在[24],图中没有显示SnSe8-n化合物和单质硫的吸收峰[25-27];然而硫脲还原Se(Ⅵ) 产生的固体产物的吸收峰在233~245 cm-1范围内没有明确的Se—Se结构,但是在147、212和466 cm-1处显示S—S结构,这表明有单质硫形成;吸收峰在260~433 cm-1处显示S—Se结构,表明还原固体产物中有SnSe8-n化合物产生[25-27].
XRD结果显示硫脲还原Se(Ⅳ) 产生的固体产物的所有的衍射峰值都和单质硒的衍射峰值相符,这表明还原产物中含有单质硒.拉曼光谱和XRD共同显示硫脲还原Se(Ⅳ) 的还原产物为单质硒,并且没有其他杂质产生.然而硫脲还原Se(Ⅵ) 的固体产物的衍射峰和单质硫的衍射峰相符,这表明还原产物中有单质硫生成,没有单质硒的衍射峰,表明没有单质硒生成.这和拉曼光谱给出的结果相符.


图3 硫脲、单质硒和硫及硫脲分别还原Se(Ⅳ)和 Se(Ⅵ)固体产物的拉曼光谱和XRDFig.3 Raman and XRD patterns of standard solids (thiourea,elemental selenium andsulfur) as well as reacted solids from thiourea with Se(Ⅳ) and Se(Ⅵ),respectively
硫脲及硫脲分别还原Se(Ⅳ)和 Se(Ⅵ)的固体产物的红外光谱如图4所示.红外光谱分析结果显示:硫脲还原Se(Ⅳ)的固体产物的吸收峰主要是硫脲的官能团的吸收峰值,没有硒和硫脲结合的化合键的吸收峰.这表明单质硒是作为独立相存在的.然而硫脲还原 Se(Ⅵ)的红外光谱分析结果显示的吸收峰值和标准的硫脲固体吸收峰值相比,并没有发现硫脲的官能团的吸收峰.光谱分析结果表明:硫脲还原Se(Ⅵ)的产物为单质硫以及一些硫硒相的化合物.这和拉曼光谱给出的结果相符.
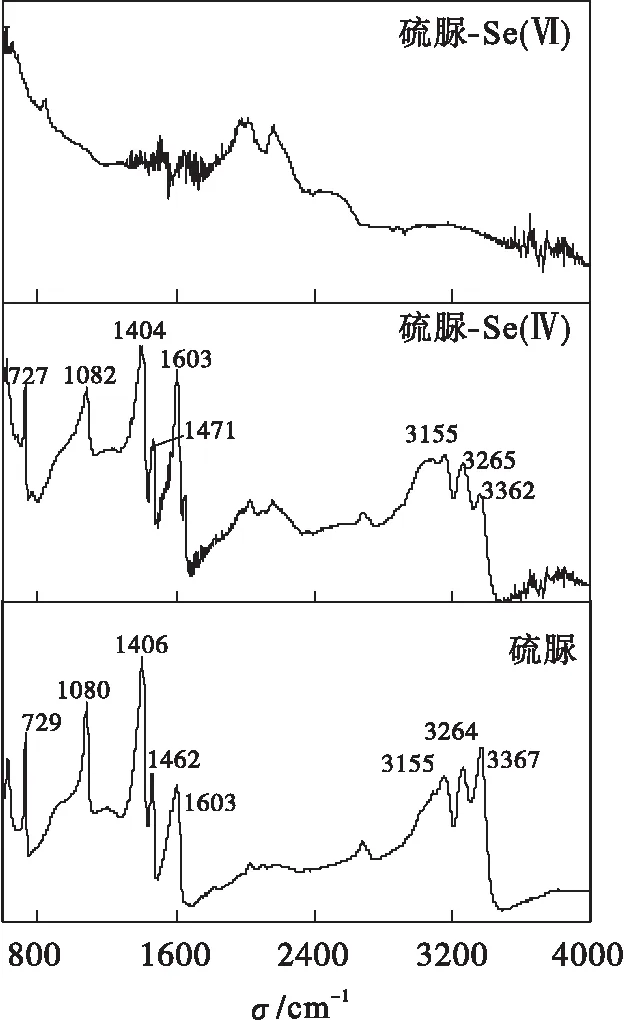
图4 硫脲及硫脲分别还原Se(Ⅳ) 和 Se(Ⅵ) 固体产物的红外光谱Fig.4 IR patterns of standard solid of thiourea as well as reacted solids from thiourea with Se(Ⅳ) and Se(Ⅵ),respectively
2.3 抗坏血酸-硫脲混合液还原Se(Ⅳ) 和Se(Ⅵ)产物分析
抗坏血酸或者硫脲分别还原Se(Ⅳ)和Se(Ⅵ)得到不同的还原产物,因此,实验使用抗坏血酸-硫脲(质量比为1∶1,以下同)混合液还原Se(Ⅳ) 和 Se(Ⅵ),研究还原产物组成的不同.
单质硫、单质硒及抗坏血酸-硫脲混合液分别还原Se(Ⅳ) 和 Se(Ⅵ)固体产物的拉曼光谱和XRD如图5所示.


图5 单质硒和硫及抗坏血酸-硫脲混合液分 别还原Se(Ⅳ) 和Se(Ⅵ)固体产物的 拉曼光谱和XRDFig.5 Raman and XRD patterns of elemental selenium and sulfuras well as reacted solids from ascorbic acid+ thiourea with Se(Ⅳ) and Se(Ⅵ),respectively
拉曼光谱分析结果显示:还原Se(Ⅳ)固体产物的吸收峰在~233 cm-1处,和单质硒的吸收峰相同,表明晶体单质硒的产生,并且没有单质硫和S—Se结构的吸收峰.然而对于还原Se(Ⅵ) 的情况,拉曼光谱分析结果显示还原固体的吸收峰在~232 cm-1处,与标准单质硒的吸收峰相符,表明有Se—Se结构存在,即有单质硒生成.此外,吸收峰在~462 cm-1处表明有S—S结构,即有单质硫生成.并且吸收峰在249~350 cm-1处,表明S—Se结构存在,即有SnSe8-n结构化合物生成.
XRD分析结果表明:混合液还原Se(Ⅳ) 还原产物的衍射峰和标准单质硒的衍射峰相符,并且没有其他结构的衍射峰存在.拉曼光谱和XRD数据结果相符.这表明抗坏血酸-硫脲混合液还原Se(Ⅳ) 的产物主要为单质硒,并且无其他杂质产生.然而,抗坏血酸-硫脲混合液还原Se(Ⅵ) 的产物的衍射峰和晶体硒的衍射峰重合,此结果和拉曼光谱给出的结果相符,表明单质硒的生成.但是,XRD数据没有显示其他晶面的衍射峰,这表明生成的硫硒相化合物和单质硫并不是主要的还原产物,单质硒才是主要的还原产物.
硫脲、抗坏血酸及抗坏血酸-硫脲混合液分别还原Se(Ⅳ) 和 Se(Ⅵ)的固体产物的红外光谱如图6所示.

图6 硫脲、抗坏血酸及抗坏血酸-硫脲混合液分别 还原Se(Ⅳ) 和Se(Ⅵ)固体产物的红外光谱Fig.6 IR patterns of standard solids(ascorbic acid and thiourea) as well as reacted solids from ascorbic acid+thiourea with Se(Ⅳ) and Se(Ⅵ), respectively
从图6可以看出:混合液还原Se(Ⅳ) 的固体产物的吸收峰与抗坏血酸和硫脲的官能团的吸收峰相符;然而混合液还原Se(Ⅵ) 的固体产物的吸收峰有抗坏血酸官能团的吸收峰,没有硫脲基团的吸收峰,这和拉曼光谱分析结果、XRD数据分析结果相符.
3 结 论
(1) 抗坏血酸在酸性溶液中还原Se(Ⅳ) 生成纳米硒;与Se(Ⅵ) 反应却无沉淀产生,并且在反应的溶液中没有发现低价态的硒生成.
(2) 硫脲在酸性溶液中还原Se(Ⅳ) 生成单质硒,并且产物只有单质硒无其他杂质;还原Se(Ⅵ)生成单质硫和一些硫硒相化合物,没有发现单质硒的存在.
(3) 抗坏血酸-硫脲混合液在酸性溶液中还原Se(Ⅳ) 生成单质硒;还原 Se(Ⅵ)生成单质硒、单质硫及硫硒相化合物.

