非洲猪瘟防控及疫苗研发:挑战与对策
王涛,孙元,罗玉子,仇华吉
仇华吉 中国农业科学院哈尔滨兽医研究所研究员、博士生导师、猪传染病研究室主任、猪烈性传染病创新团队首席科学家。主要从事猪瘟、非洲猪瘟和伪狂犬病等猪烈性传染病的基础和应用研究。先后主持国家863项目、国家十三五重点研发计划项目、国家自然科学基金重点项目、欧盟国际合作项目等20余项,以通讯作者发表SCI收录论文60余篇,获国家科技进步二等奖2项、黑龙江省科技进步一等奖3项、中国农业科学院杰出科技创新奖1项、国家发明专利9项、农业转基因产品安全证书2个,主编或参编学术专著8部。兼任国家科技奖评审专家、国家自然科学基金会评专家、农业部兽药评审委员会委员、中国畜牧兽医学会动物传染病学分会常务理事和兽医生物技术分会理事、中国免疫学会兽医免疫分会委员、黑龙江省畜牧兽医学会动物传染病分会副理事长,《生物工程学报》、《微生物学报》、《中国农业科学》等期刊编委。

非洲猪瘟防控及疫苗研发:挑战与对策
王涛,孙元,罗玉子,仇华吉
中国农业科学院 哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069

王涛, 孙元, 罗玉子, 等. 非洲猪瘟防控及疫苗研发:挑战与对策. 生物工程学报, 2018, 34(12): 1931–1942.Wang T,Sun Y,Luo YZ, et al. Prevention, control and vaccine development of African swine fever: challenges and countermeasures. Chin J Biotech, 2018, 34(12): 1931–1942.
非洲猪瘟是由非洲猪瘟病毒引起的一种接触传染性、广泛出血性猪烈性传染病,最急性和急性感染死亡率高达100%。自2018年8月我国发生首起非洲猪瘟疫情后,3个多月内,已有18个省份累计暴发69起,给我国养猪业造成了沉重打击。从目前非洲猪瘟全球流行态势及世界各国防控经验来看,我国非洲猪瘟防控和根除面临的形势不容乐观,亟需安全有效的疫苗用于该病的防控。文中结合当前非洲猪瘟病原学最新研究成果,系统总结了非洲猪瘟防控策略、疫苗研究进展及其面临的挑战,重点分析了疫苗研发历程、存在的问题、未来发展方向以及商业化应用所面临的关键科学问题,以期为我国非洲猪瘟防控及病原和疫苗研究提供借鉴。
非洲猪瘟,非洲猪瘟病毒,防控技术,疫苗
非洲猪瘟 (African swine fever, ASF) 是由非洲猪瘟病毒 (African swine fever virus, ASFV) 引起猪的一种广泛出血性高度接触性疫病,最急性和急性型感染死亡率高达100%。该病自1921年首次报道后,主要流行于撒哈拉以南非洲地区。2007年格鲁吉亚暴发ASF,随后疫情迅速蔓延至整个高加索和俄罗斯。2014年ASF传入东欧大部分国家并初步呈现出扩大流行趋势[1]。世界动物卫生组织 (World Organization for Animal Health, OIE) 将ASF列为必须通报动物疫病,我国将其列为重点防范的一类动物传染病。目前无商业化疫苗可用于防控ASF。2018年8月1日,辽宁省某养猪场发生ASF疫情,这是我国首次暴发ASF[2]。随后在3个多月时间内,我国已有18个省份累计暴发69起ASF,扑杀猪只超过50万头[3],直接经济损失达数十余亿元。
从目前ASF全球流行态势及世界各国防控经验来看,我国面临的形势异常严峻,急需安全有效的疫苗用于防控该病。本文从ASFV病原学最新研究成果出发,系统总结了ASF防控策略及疫苗研究进展,分析了ASF防控面临的挑战及对策,重点阐明ASF疫苗研发面临的问题和相应策略、未来发展方向以及商业化应用所面临的关键科学问题,以期为我国防控ASF及病原和疫苗研究提供借鉴。
1 非洲猪瘟概述
1.1 非洲猪瘟病毒
ASFV是非洲猪瘟相关病毒科 (Asfarviridae) 非洲猪瘟病毒属 (Asfivirus) 的唯一成员,也是唯一虫媒DNA病毒[4]。ASFV电子显微镜检测结果如图1A所示,外形似正六边形,直径约200 nm。病毒粒子 (图1B) 主要由病毒基因组 (Genome)、内核心壳 (Core shell)、内膜 (Inner envelope)、衣壳 (Capsid) 和囊膜 (External envelope) 五部分组成[5]。ASFV耐低温,但对高温敏感,不同温度条件下存活时间不同:56 ℃可存活70 min,60 ℃可存活20 min,25–37 ℃可存活数周,在4 ℃条件下可以存活1年以上,在冷冻猪肉中可存活数年。ASFV对乙醚和氯仿敏感,2%氢氧化钠、2%–3%次氯酸钠、0.3%福尔马林等多种消毒剂均可有效灭活ASFV。
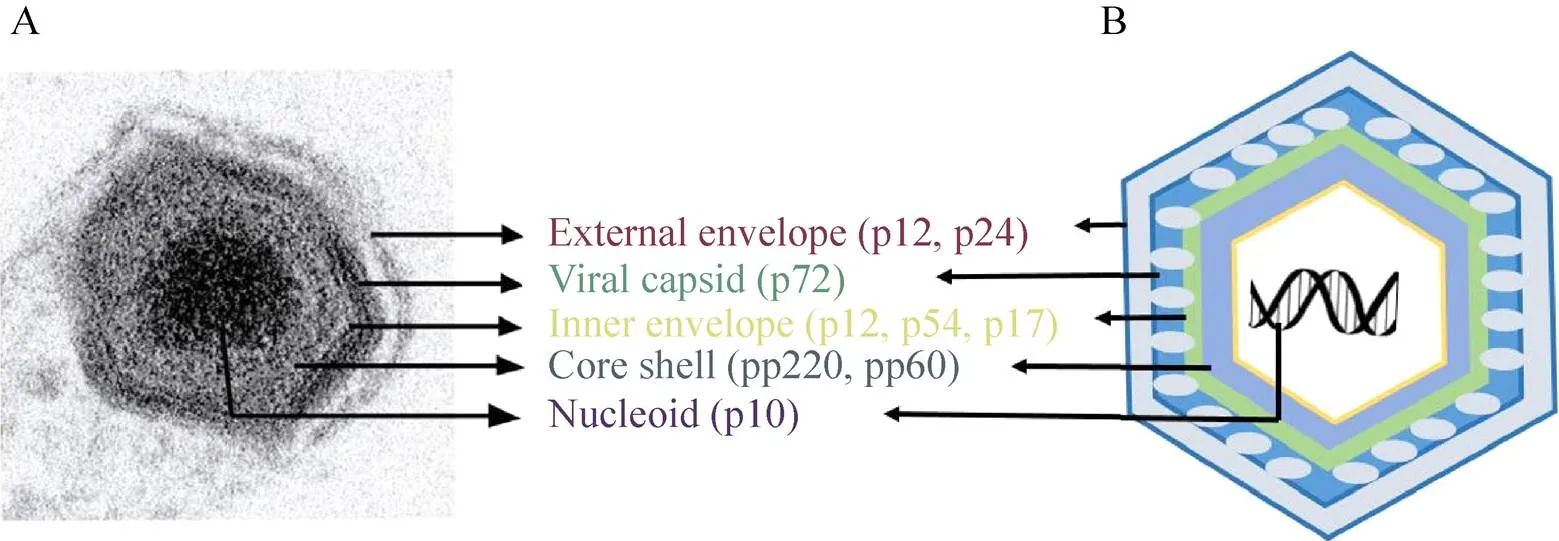
图1 ASFV电镜检测结果(A)[5]和结构示意图 (B)
早期利用二维电泳技术从纯化的胞外ASFV中检测到50多种蛋白[6]。随后利用免疫电镜技术鉴定出25种病毒蛋白,并对其中一些结构蛋白的定位进行了初步研究[7]。最近基于蛋白质质谱分析技术检测到68种病毒蛋白,包括所有已报道的病毒蛋白和新鉴定的44种病毒包装多肽。其中,大部分蛋白参与病毒的结构形成。新鉴定的病毒结构蛋白p5和p8,分别来自核心多聚蛋白pp220和pp62的裂解产物。另外,在病毒粒子中还检测到21种宿主蛋白[8]。随着定量蛋白质组学技术的运用,有望发现新的ASFV蛋白。
1.1.1 ASFV基因组
ASFV基因组为双链闭合线性DNA分子 (图2),1995年Yáñez等首次完成ASFV全基因组测序[9]。ASFV基因组大小为170–194 kb,含有150–167个开放阅读框 (Open reading frames,ORF)[10],编码54种结构蛋白和100多种非结构蛋白。ASFV基因组主要由3部分组成:末端由37 nt部分碱基互补配对的发卡环结构 (Hairpin loop),紧邻末端的由串联重复序列和多基因家族 (Multigene families,MGF) 构成的可变区 (Variable region),中间部分是比较稳定的基因区 (Stable region)[10]。可变区基因拷贝数的变化是造成ASFV基因组大小不等的主要因素。
ASFV基因的命名具有一定规律性。用限制性内切酶RⅠ对ASFV基因组进行消化,将切割所形成的片段以英文字母 (A、B、E、K、E¢) 进行编号,例如基因,“EP”对应的是“E¢”,“402”表示该基因编码402个氨基酸,“R”表示基因读码方向朝向基因组3¢端,如果读码方向相反则用L表示。CD2v (Hemagglutinin) 是ASFV编码的与细胞CD2分子同源的蛋白,具有红细胞吸附功能。这种命名的优点是,可根据基因名称快速判断其所在的位置及编码蛋白的分子量。
ASFV基因组不具有感染性,复制机制与痘病毒相似。首先,在靠近发夹环部位引入一个缺口 (Nick) 形成单链,以打开的单链为模板合成互补链,分别形成2个发卡环结构;然后,以新形成的发卡环为引物进行子代链的合成,从而完成ASFV基因组的复制[10]。ASFV基因组复制主要发生在胞浆,但有一个短暂的入核过程,该过程可能对病毒的复制起始有着重要作用[10]。

图2 ASFV基因组结构示意图
1.1.2 ASFV基因型与血清群
根据() 基因末端约500 bp核苷酸的差异,现已鉴定出24种ASFV基因型[11]。目前东欧及高加索地区流行的是基因Ⅱ型,西非地区主要是基因Ⅰ型,东非和南非则有20多种基因型。这种基因分型的优点是可以利用PCR技术快速地对ASFV进行遗传演化分析;其缺点是不能反映出病毒血清学特性,例如同是基因Ⅰ型的毒株,有的具有红细胞吸附特性,有的则没有。这种基因分型也不能很好地反映毒株的免疫学特性。为了解决以上问题,研究人员对1961年到2009年分离的32株ASFV进行了血细胞吸附抑制试验 (Hemadsorption inhibition assay,HAI),将其中具有血凝特性的ASFV分成了8个血清群 (Serogroup),也有少量未分群的ASFV[12]。随后血清群特异性嵌合病毒的免疫保护试验发现,CD2v和C型凝集素蛋白是重要的保护性抗原[13]。基于HAI的血清学分析需要活病毒和恢复期的血清,制约了ASFV血清学研究的发展。
1.1.3 ASFV复制周期
ASFV主要感染单核-巨噬细胞系统,可利用巨胞饮或网格蛋白介导的内吞完成其入侵。当ASFV被包裹在巨胞饮泡或者内吞体内后,将经历从早期内体到晚期内体的成熟,同时解聚失去病毒囊膜。然后,病毒内膜与内体膜融合,释放出病毒核心。经脱衣壳 (Uncoating) 释放出的病毒基因组[14-15]在胞质中进行复制、转录和翻译。新合成的病毒蛋白与基因组在“病毒加工厂” (Viral factory,VF) 进行组装[16]。组装的病毒粒子借助动力蛋白运输至细胞膜附近,通过出芽的方式获得囊膜后被释放到细胞外[17]。这个过程中有大量病毒蛋白参与,如p54、p30、p12参与吸附和内化;pE248R参与膜融合;多聚蛋白pp220和pp62以及pS273R、p17、p72、pB438L、pE120R等参与病毒粒子的组装[7,18];另外,还有约20种蛋白参与病毒基因组的复制及基因表达过程。
1.2 非洲猪瘟的流行与防控对策
家猪、各种野猪 (非洲野猪、欧亚野猪) 和钝缘蜱属软蜱为ASFV的宿主,其中疣猪等非洲本土野猪和部分钝缘蜱多为储存宿主。感染ASFV的家猪、野猪、软蜱、受污染的饲料、猪肉制品以及器具 (车辆、衣服、靴子、注射器) 等[5]是该病的主要传染源。猪只主要通过直接或者间接接触传染源而被感染,也可经软蜱叮咬而被感染。病毒经血液传播至全身各组织脏器,引起猪只的全身性感染。已证实的ASFV传播循环主要有 3种:1) 家猪-软蜱-家猪循环;2) 家猪-家猪循环;3) 野猪-野猪循环。ASFV在不同的循环内可以持续存在[5]。
非洲猪瘟最早发现于肯尼亚[19],但非洲赞比亚东部省份奇帕塔 (Chipata) 地区在1912年也曾记载暴发ASF[20]。根据ASF全球流行情况,可划分为3个阶段:第一阶段是局限非洲地区流行,持续至今,主要分布在撒哈拉沙漠以南的非洲国家。第二阶段是第一次传出非洲跨洲际流行,发生在1957年到20世纪90年代之间。该阶段从1957年ASF传入欧洲的葡萄牙开始,后相继传入西班牙、意大利、法国、比利时等国家;1971年ASF传入加勒比地区的古巴、多米尼加、海地等国家;1978年传入南美洲的巴西;特点是长距离、跨区域传播,目前除意大利的撒丁岛外都被成功地扑灭和根除。第三阶段是第二次传出非洲跨洲际流行,从2007年传入格鲁吉亚、俄罗斯、白俄罗斯开始,2014年传入立陶宛、波兰、拉脱维亚、爱沙尼亚等;2017年传入捷克、罗马尼亚等绝大部分东欧国家;2018年传入中国;目前,主要流行于高加索、东欧地区及中国,至今没有得到有效控制[21]。2018年9月13日比利时境内野猪发现感染ASFV,表明ASF疫情有可能已经蔓延到了西欧[3]。
防控ASF的难点在于:1) ASFV生物学特性复杂。该病毒属于结构复杂对外界环境抵抗力较强的DNA病毒,耐过动物有持续感染现象。在非洲野猪中多呈隐性感染且可经软蜱传播,同时具有多种传播循环,不同传播循环中野猪和软蜱的传播作用可能不同[18]。2) 饲养管理水平参差不齐。随着养殖技术的不断进步,养猪业也在不断升级,生物安全水平不断提高,但是不同国家、地域之间仍有较大差异。目前还存在一些传统的养猪模式如散养、放养、泔水饲喂等。还有大量猪场生物安全水平较低,甚至缺乏基本的消毒、隔离等措施,相关从业人员缺乏防控意识和技能。3) 国际旅游和贸易。随着经济全球化发展,全球国际间的贸易、旅游越来越频繁,但是缺乏严格的出入境检验检疫,致使ASF的跨地区传播成为可能。巴西非洲猪瘟疫情的传入推测是来自西班牙或者葡萄牙乘坐国际航班的游客携带了受ASFV污染的食品所导致[22]。4) 早期ASF的监测和防控技术。ASF疫区国家缺乏有效的综合防控技术和国家层面的根除计划,致使疫情不断蔓延和扩散,给无疫区国家造成了极高的传入风险。ASF无疫区国家缺乏相应的技术储备、防控经验及受培训人员,疫情一旦传入单纯依靠隔离、扑杀、消毒等措施很难有效防控。5) ASF无可用疫苗。至今仍无商品化疫苗用以防控和根除该病。正是基于以上种种原因导致了ASF在第二阶段根除之后又卷土重来。
总结巴西、西班牙、俄罗斯防控ASF的经验教训,可以从正反两方面给我国防控ASF诸多启示。巴西、西班牙成功根除ASF的经验主要有[23]:1) 制定国家层面的根除计划,由兽医部门主导多部门联合防控,分阶段逐步消灭ASFV阳性场。2) 主动进行全国范围内血清学检测、相应的临床兽医队伍建设、ASFV检测技术研发;加强进出口及国内生猪及其制品流动检验检疫、加强相关从业人员的教育培训,建立起完善高效的ASF监测防控上报体系。3) 利用ASF监测防控上报体系,在全国范围内逐步剔除阳性猪只,直至无疫情发生。俄罗斯未有效防控ASF的教训在于[24-25]:1) 初期阶段诊断失误导致疫情扩散。2) 补偿不及时、不到位、导致部分农场主不配合,未真实上报疫情及处置情况。3) 未形成全国范围的ASF根除计划,防控措施低效。4) 存在大规模生物安全水平较低的猪场。5) 存在部分将疫区ASFV污染的猪肉向无疫区贩卖的违法行为。
截至2018年11月16日,我国东北、华北、华中、西南等地区已有18个省份暴发了69起ASF疫情,且有继续蔓延之势,给养猪业及猪肉产品供应造成了沉重打击。目前我国ASFV流行株为基因Ⅱ型、血清群8[26]。从内部环境来看:我国仍有大量的生物安全水平较低的散养户存在;部分省份存在野猪和软蜱,已发现辽宁省、吉林省有野猪感染ASFV死亡;仍有泔水饲喂和生猪跨地区调运,也存在违法开具检验检疫合格证、非法调运生猪的现象。从外部环境来看:邻国俄罗斯及欧洲ASF疫情有扩大趋势;国际贸易旅游频繁但缺乏严格的进出口检验检疫[27]。基于以上分析可以得出ASF疫情扩散、甚至再次传入我国的风险极高[28]。
ASF防控的核心在于防止传染源的引入,一旦传入则需立即启动应急预案,采取隔离、扑杀、消毒等严格的处置措施。对受威胁区进行主动监测,发现疫情立即清除,对受威胁区以外区域采取相应的管控措施防止疫情进一步扩大,同时采取其他交通管制措施严防疫区污染源流向无疫区。疫情传入后的早期是根除的黄金时期,通常ASFV感染的猪只在发病前48 h就开始排毒,所以发生疫情时疫区可能已存在大量传染源,对受威胁区全面严格的主动监测及相应猪只流通控制就显得尤为重要。Cristina等利用PubMed和常规搜索引擎检索ASF相关防控技术,对检索到的168篇研究文献和5 100条检索结果进行了系统的梳理,同时邀请ASF防控专家进行评估,总结出了37条具体的防控措施,并在不同类型的猪场评估了其有效性,非常值得借鉴[21]。
2 非洲猪瘟疫苗研究进展
ASFV虽然早在20世纪初就已被发现,但疫苗研究工作却滞后40多年。20世纪60年代,进行了传统的灭活疫苗研究,之后探索了亚单位疫苗、核酸疫苗、病毒活载体疫苗、减毒活疫苗、基因缺失疫苗。近期研究发现,某些基因缺失疫苗候选株可提供完全的交叉保护,随着安全性的进一步提高有望在不久的将来投入市场。
2.1 对非洲猪瘟感染保护性免疫的认识
对ASFV感染引起的保护性免疫认识不清楚,是制约ASF疫苗研究的主要原因。ASFV基因组集成了抑制干扰素产生、抑制细胞凋亡和自噬等多种免疫逃避机制;编码了多种病毒蛋白参与调控宿主的免疫应答。早期曾认为,ASFV无法诱导产生中和抗体,随后发现p72、p54和p30蛋白具有中和作用,p72和p54可以抑制病毒的吸附,p30可以抑制病毒的内化[29]。ASFV抗体介导的中和作用可能与其他病毒不同,这种独特性可能是病毒在细胞传代过程中外膜成分发生改变,从而失去了中和特性;也可能是血清的存在封闭了抗体的中和活性[30]。ASFV的其他囊膜或者内膜蛋白,如CD2v、p12、D117L,也可能诱导中和抗体参与抑制病毒的入侵和释放[29-30]。其中CD2v可以和细胞AP-1蛋白互作并参与病毒的细胞内转运,推测与病毒毒力和免疫逃避有关[31]。
特异性的CD8+T细胞在抗ASFV感染中有着重要作用[32]。核酸疫苗在没有ASFV特异性抗体的情况下可以诱导产生部分保护,这与CD8+T细胞应答有关[33]。利用DNA质粒文库鉴定出了多种具有潜在保护力的细胞毒性T淋巴细胞 (CTL) 抗原表位[34]。ASFV结构蛋白p30、p72可以激活CTL应答,但是是否具有保护作用还不清楚[35]。因为体内T细胞的异质性,使得具有保护作用的CTL表位的鉴定非常困难。除了CD8+T细胞外,T细胞以及自然杀伤细胞 (NK细胞) 等在抗ASFV感染中都发挥了重要作用[34]。目前认为细胞免疫和体液免疫在抗ASFV感染中都具有重要作用[36]。
2.2 灭活疫苗
ASF灭活疫苗是最先开始尝试研究的,但是绝大部分无保护作用[37]。Blome等于2014年利用最新的佐剂PolygenTM/Emulsigen®-D和制备技术对ASF灭活疫苗进行了重新评估,免疫的猪只用强毒攻击后可产生ASFV特异性抗体,但很快出现了急性临床症状。因此,试验还未结束所有猪都被实施了安乐死[38]。值得注意的是,本研究为了模拟自然感染采用了较高的攻毒剂量 (109TCID50/mL)。
灭活疫苗不能提供保护作用,可能与ASFV复杂的免疫机制有关,也可能与细胞内和细胞外两种不同方式成熟的感染性病毒颗粒有关。细胞内病毒颗粒是指在VF组装的ASFV,由基因组、内核心壳、内膜和衣壳组成,具有感染性;细胞外病毒颗粒是指在VF组装后通过出芽方式获得囊膜并释放到细胞外的病毒颗粒,也同样具有感染性。ASFV的囊膜含有CD2v、p12等病毒蛋白和一些细胞蛋白,而病毒的衣壳和内膜则含有 50多种蛋白。细胞内病毒颗粒和细胞外病毒颗粒表面的蛋白差异巨大,这种差异可能导致这两种类型病毒颗粒的免疫原性不同,这可能是灭活疫苗不能提供免疫保护的原因之一[39]。
2.3 亚单位疫苗、核酸疫苗和病毒活载体疫苗
ASFV亚单位疫苗、核酸疫苗 (表1) 研究思路是选择具有保护作用的抗原基因 (、、、),利用杆状病毒系统进行表达。使用p54和p30共同免疫猪只,可以提供部分的保护作用[40]。然而当使用p72、p54、p30共同免疫时却不能提供保护作用[41]。利用杆状病毒表达的CD2v可以诱导针对ASFV强毒株的部分保护[42]。这些抗原基因以及其他ASFV可能的抗原基因的DNA表达文库核酸疫苗也在研究之中,这些核酸疫苗免疫效果同亚单位疫苗相似,只能提供部分保护,有的甚至无保护[43-45]。
ASFV活病毒载体疫苗的研究,目前集中在诱导免疫应答方面。通过选用痘病毒、腺病毒、伪狂犬病病毒等载体表达ASFV保护性抗原基因 (),使用“鸡尾酒”式混合免疫或者加强免疫策略,结果发现,免疫猪只可以产生特异性抗体和CTL反应[46-48]。但这些研究还未涉及免疫保护试验,其保护效果有待进一步验证。亚单位、DNA疫苗虽然可以诱导ASFV特异性抗体及相应的细胞免疫反应,但是不能提供完全保护。

表1 亚单位疫苗及DNA疫苗研究进展
2.4 减毒活疫苗
西班牙和葡萄牙在ASF流行期间曾使用减毒活疫苗 (Live attenuated vaccines,LAV),但免疫猪只出现了慢性感染被迫弃用[39]。随后从软蜱及慢性感染猪只体内分离到了一些天然弱毒株,如OURT88/3和NH/P68[39],免疫后对同源毒株攻击完全保护,但由于免疫途径、免疫剂量、攻毒株的不同,保护率不等 (66%–100%)[49-51]。在Vero细胞上连续传110代而致弱的ASFV-G/V株不能提供有效保护[52]。全基因组测序结果发现,ASFV-G/V株基因组的末端出现大片段的基因缺失和部分基因的移码突变,这种突变可能是其适应Vero细胞的原因,却使ASFV-G/V的抗原性发生了改变,不足以诱导机体产生保护性免疫应答[52]。ASF减毒活疫苗具有毒株特异性,自然致弱和非靶细胞传代致弱的LAV免疫效果迥然不同。目前LAV存在的残余毒力、病毒血症、亚临床症状等安全性问题亟需解决。
2.5 基因缺失疫苗
ASF基因缺失疫苗是删除ASFV强毒株或者弱毒株的毒力基因 (、、和) 或者免疫逃避相关基因 (和)等,构建成疫苗候选株 (表2)。利用疫苗候选株进行免疫攻毒试验,评估疫苗的安全性和保护效果。大部分基因缺失疫苗的保护率可高达100%,免疫后可以抵抗亲本毒株的攻击,即具有同源保护作用 (Homologous protection)[54-59];有的可以抵抗异源毒株的攻击,即具有异源保护作用 (Heterologous protection)[51],但也有一些候选株保护效力下降 (Reduced protection)[60],甚至无保护作用 (No protection)[53,55],BA71毒株缺失CD2v基因后对基因Ⅰ型和Ⅱ型ASFV均能提供完全保护,具有交叉保护作用 (Cross-protection),未来开发前景较大[54]。
基因缺失疫苗可以提供完全保护,但却存在残余毒力,免疫后可引起亚临床症状和病毒血症等问题,阻碍了其商业化进程,是需要着力解决的问题。
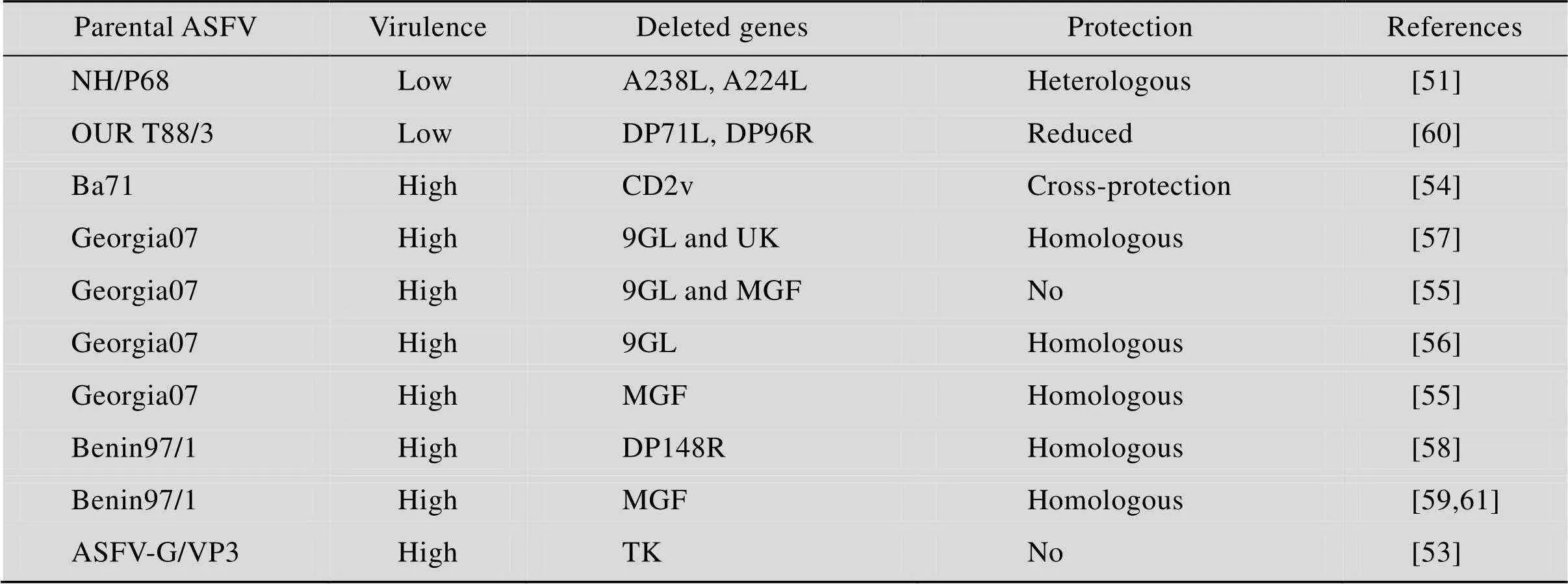
表2 用于研制基因缺失ASF活疫苗的部分毒株及其保护性的相关信息
3 研发非洲猪瘟疫苗的挑战与对策
非洲猪瘟疫苗研发已有五六十年。未来能否成功研制出非洲猪瘟疫苗?非洲猪瘟疫苗研究的方向及面临的关键科学问题是什么?非洲猪瘟疫苗商业化应用还需要解决哪些问题?对以上问题进行系统的总结和分析是非常必要的。
3.1 非洲猪瘟疫苗研发可行性分析及面临的挑战
非洲猪瘟基因缺失疫苗可以提供完全保护,是短期内最有希望的疫苗,其安全性可以通过进一步缺失毒力或免疫抑制相关基因来解决,而亚单位疫苗、核酸疫苗、病毒活载体疫苗的保护效力偏低 (表2),需要对ASFV的免疫应答机制进行深入研究[39,62]。
ASF疫苗研发面临的科学问题有[5,39]:1) 对病毒-宿主相互作用的机制不够清楚;2) 对病毒复制和转录调控不清楚,需要深入研究病毒蛋白结构和功能,特别是囊膜蛋白的功能;3) 对病毒侵入机制了解十分有限,需要鉴定病毒侵入的细胞受体,为研发抗ASF制剂提供靶标;4) 对ASFV免疫逃避相关蛋白研究甚少,深入研究相关机制将有助于ASF疫苗研发。
3.2 非洲猪瘟疫苗当前研究方向及研发对策
目前的ASF疫苗都不尽人意。亚单位疫苗、DNA疫苗、病毒活载体疫苗的瓶颈是不清楚可诱导完全保护的病毒抗原 (蛋白)[62-63]。为解决此问题,需要从ASFV基础研究入手,解析ASFV免疫保护的分子机制,鉴定保护性抗原基因;也可采用最新的免疫学技术提高疫苗的免疫原性;同时需要研发高效的抗原递送系统,以诱导产生高水平的ASFV特异性抗体,提高疫苗的保护率。
当前,ASF疫苗研究主要集中在减毒活疫苗和基因缺失疫苗[39,62-63],面临的挑战有:1) 在细胞或猪体内的遗传稳定性问题,是否会出现毒力返强或遗传特性改变?2) 毒力基因的鉴定及选择问题。ASFV致病性评价必须在生物安全三级 (ABSL3) 以上实验室进行,缺乏简单有效的毒力基因鉴定模型;3) 区别野毒感染与疫苗免疫的鉴别诊断 (Differentiating infected from vaccinated animals,DIVA)方法。为解决以上问题,可采用最新的蛋白质组和转录组技术鉴定ASFV的蛋白组成及功能;利用多组学相结合技术 (如高通量测序技术、生物信息学、合成生物学等) 对ASFV的基本生物学特性进行深入、全面的基础研究,为疫苗研究提供理论支持。
3.3 商业化应用还需要解决的关键问题
ASFV疫苗的实际应用还需要解决以下关键问题[39]:1) 缺乏相对规范的临床评价系统对收集的临床试验数据进行分析。2) 缺乏ASF疫苗生产细胞系,由于ASFV主要感染单核-巨噬细胞系统,对其他非靶细胞适应性差,易发生生物学特性的改变。3) 动物试验条件和成本高。疫苗评价相关试验只能在本体动物上进行,且必须在ABSL3以上实验室进行。
4 结语与展望
ASF已初步呈现出全球流行趋势,成为了我国养猪业的重大威胁[64]。经济全球化的快速发展、跨地域的人员和贸易交流越来越频繁,给ASF的防控和根除带来了巨大挑战[65]。ASFV基因组可以编码大量病毒蛋白。这些蛋白在感染细胞后形成一个类似真核细胞器的“病毒加工厂”结构,相对独立地完成子代病毒的组装,还可以调控宿主免疫系统,拥有多种免疫逃避机制,这些复杂特性以及生物安全条件的限制使得对病原的研究及疫苗研发都相对缓慢。
未来ASF疫苗的研发,可以借鉴蓝舌病和非洲马瘟复制缺陷型疫苗的研究思路[66-67],构建ASFV必需基因 (ASFV拓扑异构酶基因、组蛋白样基因、E2泛素连接酶基因) 缺失的突变病毒[68-69],然后通过稳定表达细胞系反式互补缺失的蛋白进行病毒拯救,从而获得只能进行一轮感染的复制缺陷型ASF疫苗,可以最大限度地提高疫苗的安全性。猪瘟兔化弱毒疫苗株是将猪瘟病毒强毒株在非易感动物家兔体内连续传代获得的一株优异疫苗,能够保护猪只抵抗猪瘟强毒的感染[70],非洲猪瘟疫苗的研发能否借鉴该策略值得探讨。
目前合成生物学在酿酒酵母染色体的设计与合成中已取得巨大进步,技术相对成熟,利用合成基因组学技术已获得了Ⅰ型单纯疱疹病毒感染性克隆,可以从全基因组范围对病毒进行快速操作获得相应的重组病毒[71]。未来也可以利用合成生物学技术结合CRISPR/Cas9基因编辑技术ASFV的反向遗传操作系统,加快病毒基因组操作,从全基因组角度出发设计新型疫苗候选株,从而找到ASFV的“阿喀琉斯之踵” (意指弱点),加快疫苗研发进程。
[1] Sánchez-Cordón PJ, Montoya M, Reis AL, et al. African swine fever: a re-emerging viral disease threatening the global pig industry. Vet J, 2018, 233: 41–48.
[2] Zhou XT, Li N, Luo YZ, et al. Emergence of African swine fever in China, 2018. Transbound Emerg Dis, 2018, 65(6): 1482-1484.
[3] 世界动物卫生信息数据库. http://www.oie.int/wahis_2/public/wahid.php/Diseaseinformation/reportarchive[EB/OL].[2018-11-16].
[4] Alonso C, Borca M, Dixon L, et al. ICTV virus taxonomy profile:. J Gen Virol, 2018, 99(5): 613–614.
[5] Revilla Y, Pérez-Núñez D, Richt JA. African swine fever virus biology and vaccine approaches. Adv Virus Res, 2018, 100: 41–74.
[6] Carrascosa AL, Del Val M, Santarén JF, et al. Purification and properties of African swine fever virus. J Virol, 1985, 54(2): 337–344.
[7] Salas ML, Andrés G. African swine fever virus morphogenesis. Virus Res, 2013, 173(1): 29–41.
[8] Alejo A, Matamoros T, Guerra M, et al. A proteomic atlas of the African swine fever virus particle. J Virol, 2018, doi: 10.1128/JVI.01293-18.
[9] Yáñez RJ, Rodrı́guez JM, Nogal ML, et al. Analysis of the complete nucleotide sequence of African swine fever virus. Virology, 1995, 208(1): 249–278.
[10] Dixon LK, Chapman DAG, Netherton CL, et al. African swine fever virus replication and genomics. Virus Res, 2013, 173(1): 3–14.
[11] Quembo CJ, Jori F, Vosloo W, et al. Genetic characterization of African swine fever virus isolates from soft ticks at the wildlife/domestic interface in Mozambique and identification of a novel genotype. Transbound Emerg Dis, 2018, 65(2): 420–431.
[12] Malogolovkin A, Burmakina G, Titov I, et al. Comparative analysis of African swine fever virus genotypes and serogroups. Emerg Infect Dis, 2015, 21(2): 312–315.
[13] Burmakina G, Malogolovkin A, Tulman ER, et al. African swine fever virus serotype-specific proteins are significant protective antigens for African swine fever. J Gen Virol, 2016, 97(7): 1670–1675.
[14] Hernáez B, Guerra M, Salas ML, et al. African swine fever virus undergoes outer envelope disruption, capsid disassembly and inner envelope fusion before core release from multivesicular endosomes. PLoS Pathog, 2016, 12(4): e1005595.
[15] Alonso C, Miskin J, Hernáez B, et al. African swine fever virus protein p54 interacts with the microtubular motor complex through direct binding to light-chain dynein. J Virol, 2001, 75(20): 9819–9827.
[16] Stefanovic S, Windsor M, Nagata KI, et al. Vimentin rearrangement during African swine fever virus infection involves retrograde transport along microtubules and phosphorylation of vimentin by calcium calmodulin kinase II. J Virol, 2005, 79(18): 11766–11775.
[17] Breese Jr SJ, DeBoer CJ. Electron microscope observations of African swine fever virus in tissue culture cells. Virology, 1966, 28(3): 420–428.
[18] Galindo I, Alonso C. African swine fever virus: a review. Viruses, 2017, 9(5): 103.
[19] Montgomery RE. On a form of swine fever occurring in British East Africa (Kenya Colony). J Comp Pathol Ther, 1921, 34: 159–191.
[20] Wilkinson PJ, Pegram RG, Perry BD, et al. The distribution of African swine fever virus isolated fromin Zambia. Epidemiol Infect, 1988, 101(3): 547–564.
[21] Jurado C, Martínez-Avilés M, De La Torre A, et al. Relevant measures to prevent the spread of African swine fever in the European Union domestic pig sector. Front Vet Sci, 2018, 5: 77.
[22] Lyra TM. The eradication of African swine fever in Brazil, 1978–1984. Rev Sci Tech, 2006, 25(1): 93–103.
[23] Arias M, Sánchez-Vizcaíno JM. African swine fever eradication: the Spanish model//Morilla A, Yoon KJ, Zimmerman JJ, Eds. Trends in Emerging Viral Infections of Swine. Iowa, USA: Iowa State University Press, 2002: 133–139.
[24] Oganesyan AS, Petrova ON, Korennoy FI, et al. African swine fever in the Russian Federation: spatio-temporal analysis and epidemiological overview. Virus Res, 2013, 173(1): 204–211.
[25] Gogin A, Gerasimov V, Malogolovkin A, et al. African swine fever in the North Caucasus region and the Russian Federation in years 2007–2012. Virus Res, 2013, 173: 198–203.
[26] Ge SQ, Li JM, Fan XX, et al. Molecular characterization of African swine fever virus, China, 2018. Emerg Infect Dis, 2018, 24(11), doi: 10.3201/eid2411.181274.
[27] Vergne T, Cao CF, Li S, et al. Pig empire under infectious threat: risk of African swine fever introduction into the People's Republic of China. Vet Rec, 2017, 181(5): 117.
[28] Wang T, Sun Y, Qiu HJ. African swine fever: an unprecedented disaster and challenge to China. Infect Dis Poverty, 2018, 7(1):111.doi: 10.1186/s40249-018-0495-3.
[29] Gómez-Puertas P, Rodríguez F, Oviedo JM, et al. Neutralizing antibodies to different proteins of African swine fever virus inhibit both virus attachment and internalization. J Virol, 1996, 70(8): 5689–5694.
[30] Escribano JM, Galindo I, Alonso C. Antibody-mediated neutralization of African swine fever virus: myths and facts. Virus Res, 2013, 173(1): 101–109.
[31] Pérez-Núñez D, García-Urdiales E, Martínez-Bonet M, et al. CD2v interacts with adaptor protein AP-1 during African swine fever infection. PLoS ONE, 2015, 10(4): e0123714.
[32] Oura CAL, Denyer MS, Takamatsu H, et al.depletion of CD8+T lymphocytes abrogates protective immunity to African swine fever virus. J Gen Virol, 2005, 86(9): 2445–2450.
[33] Lacasta A, Ballester M, Monteagudo PL, et al. Expression library immunization can confer protection against lethal challenge with African swine fever virus. J Virol, 2014, 88(22): 13322–13332.
[34] Takamatsu HH, Denyer MS, Lacasta A, et al. Cellular immunity in ASFV responses. Virus Res, 2013, 173(1): 110–121.
[35] Alonso F, Domı́nguez J, Viñuela E, et al. African swine fever virus-specific cytotoxic T lymphocytes recognize the 32 kDa immediate early protein (vp32). Virus Res, 1997, 49(2): 123–130.
[36] Correia S, Ventura S, Parkhouse RM. Identification and utility of innate immune system evasion mechanisms of ASFV. Virus Res, 2013, 173(1): 87–100.
[37] Stone SS, Hess WR. Antibody response to inactivated preparations of African swine fever virus in pigs. Am J Vet Res, 1967, 28(123): 475–481.
[38] Blome S, Gabriel C, Beer M. Modern adjuvants do not enhance the efficacy of an inactivated African swine fever virus vaccine preparation. Vaccine, 2014, 32(31): 3879–3882.
[39] Arias M, De La Torre A, Dixon L, et al. Approaches and perspectives for development of African swine fever virus vaccines. Vaccines, 2017, 5(4): 35.
[40] Gómez-Puertas P, Rodríguez F, Oviedo JM, et al. The African swine fever virus proteins p54 and p30 are involved in two distinct steps of virus attachment and both contribute to the antibody-mediated protective immune response. Virology, 1998, 243(2): 461–471.
[41] Neilan JG, Zsak L, Lu Z, et al. Neutralizing antibodies to African swine fever virus proteins p30, p54, and p72 are not sufficient for antibody-mediated protection. Virology, 2004, 319(2): 337–342.
[42] Ruiz-Gonzalvo F, Rodríguez F, Escribano JM. Functional and immunological properties of the baculovirus-expressed hemagglutinin of African swine fever virus. Virology, 1996, 218(1): 285–289.
[43] Argilaguet JM, Pérez-Martín E, Gallardo C, et al. Enhancing DNA immunization by targeting ASFV antigens to SLA-II bearing cells. Vaccine, 2011, 29(33): 5379–5385.
[44] Argilaguet JM, Pérez-Martín E, Nofrarías M, et al. DNA vaccination partially protects against African swine fever virus lethal challenge in the absence of antibodies. PLoS ONE, 2012, 7(9): e40942.
[45] Jancovich JK, Chapman D, Hansen DT, et al. Immunization of pigs by DNA prime and recombinant vaccinia virus boost to identify and rank African swine fever virus immunogenic and protective proteins. J Virol, 2018, 92(8): e02219–2217.
[46] Lokhandwala S, Waghela SD, Bray J, et al. Induction of robust immune responses in swine by using a cocktail of adenovirus-vectored African swine fever virus antigens. Clin Vaccine Immunol, 2016, 23(11): 888–900.
[47] Lopera-Madrid J, Osorio JE, He YQ, et al. Safety and immunogenicity of mammalian cell derived and Modified Vaccinia Ankara vectored African swine fever subunit antigens in swine. Vet Immunol Immunopathol, 2017, 185: 20–33.
[48] Lokhandwala S, Waghela SD, Bray J, et al. Adenovirus-vectored novel African Swine Fever Virus antigens elicit robust immune responses in swine. PLoS ONE, 2017, 12(5): e0177007.
[49] Sánchez-Cordón PJ, Chapman D, Jabbar T, et al. Different routes and doses influence protection in pigs immunised with the naturally attenuated African swine fever virus isolate OURT88/3. Antiviral Res, 2017, 138: 1–8.
[50] Mulumba-Mfumu LK, Goatley LC, Saegerman C, et al. Immunization of African indigenous pigs with attenuated genotype I African swine fever virus OURT88/3 induces protection against challenge with virulent strains of genotype I. Transbound Emerg Dis, 2016, 63(5): e323–e327.
[51] Gallardo C, Sánchez EG, Pérez-Núñez D, et al. African swine fever virus (ASFV) protection mediated by NH/P68 and NH/P68 recombinant live-attenuated viruses. Vaccine, 2018, 36(19): 2694–2704.
[52] Krug PW, Holinka LG, O’Donnell V, et al. The progressive adaptation of a Georgian isolate of African swine fever virus to Vero cells leads to a gradual attenuation of virulence in swine corresponding to major modifications of the viral genome. J Virol, 2015, 89(4): 2324–2332.
[53] Sanford B, Holinka LG, O’Donnell V, et al. Deletion of the thymidine kinase gene induces complete attenuation of the Georgia isolate of African swine fever virus. Virus Res, 2016, 213: 165–171.
[54] Monteagudo PL, Lacasta A, López E, et al. BA71ΔCD2: a new recombinant live attenuated African swine fever virus with cross-protective capabilities. J Virol, 2017, 91(21): e01058–17.
[55] O’Donnell V, Holinka LG, Sanford B, et al. African swine fever virus Georgia isolate harboring deletions of 9GL and MGF360/505 genes is highly attenuated in swine but does not confer protection against parental virus challenge. Virus Res, 2016, 221: 8–14.
[56] O’Donnell V, Holinka LG, Krug PW, et al. African swine fever virus Georgia 2007 with a deletion of virulence- associated gene(B119L), when administered at low doses, leads to virus attenuation in swine and induces an effective protection against homologous challenge. J Virol, 2015, 89(16): 8556–8566.
[57] O’Donnell V, Risatti GR, Holinka LG, et al. Simultaneous deletion of the 9GL and UK genes from the African swine fever virus Georgia 2007 isolate offers increased safety and protection against homologous challenge. J Virol, 2016, 91(1): e01760–16.
[58] Reis AL, Goatley LC, Jabbar T, et al. Deletion of the African swine fever virus gene DP148R does not reduce virus replication in culture but reduces virus virulence in pigs and induces high levels of protection against challenge. J Virol, 2017, 91(24): e01428–17.
[59] Sánchez-Cordón PJ, Jabbar T, Berrezaie M, et al. Evaluation of protection induced by immunisation of domestic pigs with deletion mutant African swine fever virus BeninΔMGF by different doses and routes. Vaccine, 2018, 36(5): 707–715.
[60] Abrams CC, Goatley L, Fishbourne E, et al. Deletion of virulence associated genes from attenuated African swine fever virus isolate OUR T88/3 decreases its ability to protect against challenge with virulent virus. Virology, 2013, 443(1): 99–105.
[61] Reis AL, Abrams CC, Goatley LC, et al. Deletion of African swine fever virus interferon inhibitors from the genome of a virulent isolate reduces virulence in domestic pigs and induces a protective response. Vaccine, 2016, 34(39): 4698–4705.
[62] Arias M, Jurado C, Gallardo C, et al. Gaps in African swine fever: analysis and priorities. Transbound Emerg Dis, 2018, 65(S1): 235–247.
[63] Rock DL. Challenges for African swine fever vaccine development—“… perhaps the end of the beginning.”. Vet Microbiol, 2017, 206: 52–58.
[64] Luo YZ, Sun Y, Wang T, et al. African swine fever: A major threat to the Chinese swine industry. Sci Agric Sin, 2018, 51(21): 4177–4187 (in Chinese).罗玉子, 孙元, 王涛, 等. 非洲猪瘟—我国养猪业的重大威胁. 中国农业科学, 2018, 51(21): 4177–4187.
[65] Qiu HJ. Impacts of African swine fever on the Chinese pig industry and suggestions for the prevention and control of the disease. Chin J Vet Drug 2018, 52(11): 1–4 (in Chinese).仇华吉. 非洲猪瘟对我国养猪业的影响与防控建议. 中国兽药杂志, 2018, 52(11): 1–4.
[66] Celma CC, Stewart M, Wernike K, et al. Replication-deficient particles: new insights into the next generation of Bluetongue virus vaccines. J Virol, 2016, 91(1): e01892–16.
[67] van de Water SG, van Gennip RG, Potgieter CA, et al. VP2 exchange and NS3/NS3a deletion in African horse sickness virus (AHSV) in development of disabled infectious single animal vaccine candidates for AHSV. J Virol, 2015, 89(17): 8764–8772.
[68] Frouco G, Freitas FB, Coelho J, et al. DNA-binding properties of African swine fever virus pA104R, a Histone-like protein involved in viral replication and transcription. J Virol, 2017, 91(12): e02498–16.
[69] Coelho J, Martins C, Ferreira F, et al. African swine fever virus ORF P1192R codes for a functional type II DNA topoisomerase. Virology, 2015, 474: 82–93.
[70] Zhang LK, Li YF, Xie LB, et al. Generation and characterization of recombinant classical swine fever virus C-strain expressing the cap protein of porcine circovirus type 2. Chin J Biotech, 2018, 34(2): 216–223 (in Chinese). 张玲楷, 李永锋, 谢利豹, 等. 表达猪圆环病毒2型Cap蛋白的重组猪瘟兔化弱毒疫苗株的构建与鉴定. 生物工程学报, 2018, 34(2): 216–223.
[71] Oldfield LM, Grzesik P, Voorhies AA, et al. Genome-wide engineering of an infectious clone of herpes simplex virus type 1 using synthetic genomics assembly methods. Proc Natl Acad Sci USA, 2017, 114(42): E8885–E8894.
(本文责编 陈宏宇)
Prevention, control and vaccine development of African swine fever: challenges and countermeasures
Tao Wang, Yuan Sun, Yuzi Luo, and Hua-Ji Qiu
Key Laboratory of Veterinary Biotechnology, Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150069, Heilongjiang, China
African swine fever (ASF) is a hemorrhagic and devastating infectious disease of pigs caused by African swine fever virus (ASFV), with mortality up to 100%. The first ASF outbreak occurred in China in August 2018, followed by 69 cases of ASF in 18 provinces in more than three months, causing a heavy burden to the pig industry. Based on the global epidemic situation of ASF and the experience of prevention and control in other countries, the ASF control and eradication situation in China is extremely complex and serious. The availability of effective and safe ASF vaccines is an urgent requirement to reinforce control and eradication strategies. Therefore, this article starts with the latest findings of ASFV, summarizes the progress in prevention and control strategies and vaccine approaches for ASFV. We also discuss the challenges of preventing and controlling ASF, focusing on current vaccine strategies, the gaps, future research directions, and key scientific issues in commercial applications. We hope to provide basic information for the development of vaccines and prevention control strategies against this disease in China.
African swine fever, African swine fever virus, preventive measures, vaccines
October 10, 2018;
November 20, 2018
National Key Research and Development Program of China (No. 2017YFD0500601).
Hua-Ji Qiu. Tel/Fax: +86-451-51051708; E-mail: qiuhuaji@caas.cn
国家重点研发计划项目(No. 2017YFD0500601)资助。
2018-11-26
10.13345/j.cjb.180415
http://kns.cnki.net/kcms/detail/11.1998.Q.20181123.1722.001.html

