基于g-C3N4-CeO2复合材料的电化学生物传感器
李晓琴, 刘雅杰, 曹秀芝, 王 娟, 姚 慧
(沈阳化工大学 应用化学学院, 辽宁 沈阳 110142)
过氧化氢(H2O2)不仅是酶反应的产物,还是许多工业生产的原材料,在工业、环保、食品、制药、临床和许多其他领域中有广泛的应用[1-2].但是过量的H2O2可能会损坏DNA或蛋白质导致一些疾病的产生,如癌症、心血管疾病和帕金森氏病等[3-4].因此对H2O2进行快速、准确的检测具有十分重要的意义.目前可用于对H2O2的检测方法有化学发光法、荧光法和电化学方法等[5-8].其中因方法简单、灵敏度高、成本低和选择性好等优势使电化学方法受到广泛关注[9-10].
石墨氮化碳(g-C3N4)是由碳、氮元素以sp2杂化形成的三嗪环(C3N3环)或3-s-三嗪环(C6N7环)构成,具有类石墨结构的层状化合物.因其具有高的光催化活性已成为在光催化分解水制氢[11-13],光催化降解有机污染物[14-16]和传感器[17-19]等领域研究的热点.除了具有光催化活性,g-C3N4还具有良好的生物相容性,低毒,高温稳定性,化学稳定性强,制备简单以及价格低廉等优点,这使其在电化学传感器方面的应用成为可能.但g-C3N4的缺点是导电性差,这也是g-C3N4材料在电化学传感器方面报道较少的原因.近年来,唐跃[20]等制备出了石墨相氮化碳,将其修饰到玻碳电极表面用于检测重金属Cd2+.黄素珍[21]等制备了基于g-C3N4材料用于硝基苯检测的电化学传感器.为了改善g-C3N4的导电性,以g-C3N4作为基体材料掺杂传导电子的元素或化合物从而提高基体材料电子的传递性被广泛研究.研究发现在g-C3N4中掺杂CeO2可形成异质结结构,这种结构有利于电子的传递从而为本课题的研究提供了依据[22].
CeO2是一种应用很广泛的稀土半导体材料,具有独特的萤石晶体结构和丰富的氧空位缺陷.因其能在Ce4+/Ce3+两种价态之间相互转化,从而具有良好的氧化还原能力[23].CeO2已被广泛应用于电化学、光学、催化剂、气体传感器等领域[24].近年的研究表明,纳米CeO2性质稳定,比表面积高,具有良好的生物相容性,这使其在电化学传感器方面的应用成为可能[25].本文成功合成了g-C3N4-CeO2复合材料,为了近一步提高材料的导电性在材料表面电化学聚合金,将其应用于H2O2生物传感器的构建.用循环伏安法和计时电流法研究该传感器对H2O2的电化学行,并对实验条件进行优化.结果表明该生物传感器有较低的检出限、较宽的线性范围和较强的抗干扰能力,可以应用于对H2O2的检测,在实际水样的测定中得到较满意的结果.
1 实验部分
1.1 仪器与试剂
电化学工作站,CHI 660C 型,上海辰华仪器有限公司;标准三电极体系:工作电极为修饰后的玻碳电极(GCE),对电极为铂丝电极,参比电极为饱和甘汞电极(SCE);高低真空扫描电镜,JMS-6360LV型,日本电子株式会社;X射线衍射仪,D-8型,德国Bruker公司;FTIR红外光谱仪,Nicolet 5-DX型,美国赛默飞世尔科技公司.
Ce(NO3)3·6H2O,国药集团化学试剂有限公司;辣根过氧化物酶,HRP,Aladdin公司,RZ>2.5;尿素,沈阳市新化试剂厂;过氧化氢,体积分数30 %;磷酸氢二钠、磷酸二氢钠,分析纯,国药集团化学试剂有限公司;实验用水为二次蒸馏水.实验采用传统的高锰酸钾滴定法测定H2O2的准确浓度.
1.2 g-C3N4-CeO2材料的制备
1.2.1 g-C3N4的制备
称取10.0 g尿素于研钵中[26],研磨后倒入坩埚中,将坩埚放于烘箱中在80 ℃的温度下干燥24 h,之后放于马弗炉中在550 ℃条件下加热4 h后可得到黄色粉末.用硝酸和水清洗后在80 ℃的温度下过夜干燥即得g-C3N4.
1.2.2 g-C3N4-CeO2的制备
参照文献[22]的合成方法,称取0.1 g g-C3N4和0.012 6 g Ce(NO3)3·6H2O溶于19 mL水中,在室温条件下搅拌30 min后再超声30 min.然后在搅拌的条件下加入0.5 mL NH3·H2O,之后将混合液放在25 mL聚四氟乙烯的反应釜中在160 ℃的条件下加热12 h,产物用水和乙醇各洗涤离心3次,最后在60 ℃的条件下过夜干燥即得到g-C3N4-CeO2材料.
1.3 g-C3N4-CeO2材料修饰电极的制备
1.3.1 CHIT溶液的配制
准确称取0.02 g 壳聚糖(CHIT,脱乙酰度为92 %) 于小烧杯中进行溶解,加入10 mL 0.1 mol/L的乙酸,加热搅拌使其溶解后超声10 min制成质量分数为0.2 %的CHIT溶液.
1.3.2 g-C3N4-CeO2-HRP修饰液的制备
准确称取0.002 g所制备的 g-C3N4-CeO2材料于小塑料管中,加入300 μL质量分数为0.2 %的CHIT溶液,超声50 min使其混合均匀,之后加入2 mg 的HRP超声3 min,即制得 g-C3N4-CeO2-HRP修饰液.
1.3.3 修饰电极的制备
首先将玻碳电极用0.05 μm的α-Al2O3抛光粉在抛光布上抛光至镜面,然后依次在体积比1∶1硝酸溶液、丙酮和水中各超声3 min 后用氮气吹干备用.
取6 μL g-C3N4-CeO2-HRP修饰液滴涂在玻碳电极表面,晾干后把修饰电极放到已配制好的10 mmol/L氯金酸的0.5 mol/L硫酸溶液中,采用计时电流法(恒电位-0.5 V,时间分别是2、4、6、8、10、12 min)进行扫描,得到Au/g-C3N4-CeO2-HRP/GCE修饰电极.电极在4 ℃冰箱中保存.
2 结果与讨论
2.1 材料的表征及分析
2.1.1 SEM表征
图1为g-C3N4和 g-C3N4-CeO2材料的扫描电镜图.从图1(a)中可以看到g-C3N4的微观形貌呈颗粒状,导致这种现象的原因是合成的g-C3N4材料团聚现象严重.从图1(b)中可以看出CeO2的引入改变了g-C3N4的表面形貌,与g-C3N4相比,g-C3N4-CeO2材料呈现层状,在其表面有粉末状颗粒附着,说明CeO2已成功的掺杂于g-C3N4中.

图1 g-C3N4 和g-C3N4-CeO2 材料的扫描电镜照片Fig.1 SEM images of g-C3N4 and g-C3N4-CeO2
2.1.2 XRD表征
图2是g-C3N4和g-C3N4-CeO2的XRD图,在图2中a的13.2°和27.8°处出现了两个g-C3N4的特征峰,对应的晶面分别是(100)和(002),13.2°处的峰与g-C3N4三均三嗪环的平面堆垛结构相对应,27.8°处的峰与芳环片段的层间堆栈有关[27].图2中b在2θ=32.5°、47.9°、56° 处出现了3个衍射峰,分别对应CeO2的(200)、(220)、(311)晶面,但是CeO2的(111)晶面却未被观察到,这可能是因为CeO2在复合材料中的量少,也可能是被g-C3N4在(002)处的强峰给覆盖了[22].
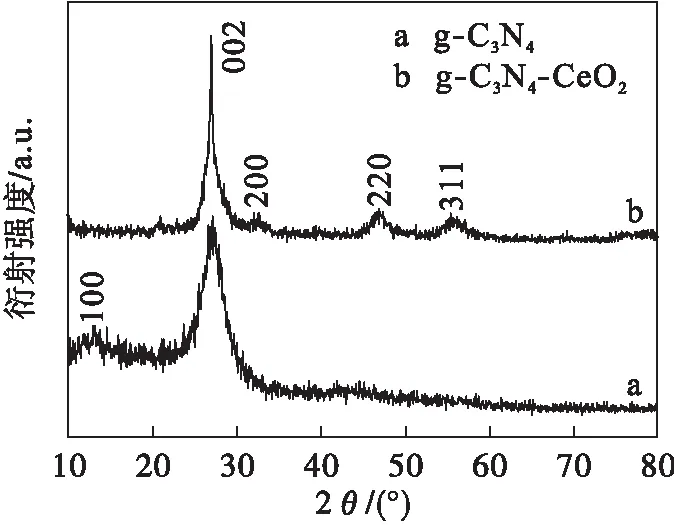
图2 g-C3N4和g-C3N4-CeO2 的X-射线衍射曲线Fig.2 XRD patterns of g-C3N4 and g-C3N4-CeO2
2.1.3 FTIR表征
图3为g-C3N4和g-C3N4-CeO2的红外光谱图.图3中a在3 000~3 500 cm-1处出现的峰为N—H的伸缩振动,1 254、1 325、1 420 cm-1是碳氮杂环的C—N伸缩振动.1 571、1 637 cm-1是C==N的伸缩振动,809 cm-1是三嗪结构的吸收峰[28].图3中b曲线g-C3N4的所有特征吸收峰都可在g-C3N4-CeO2中找到,说明通过水热合成后g-C3N4仍能保持其原有的结构.在1 087 cm-1处出现了一个弱的吸收峰,这可能是 Ce—O—N的伸缩振动[29],进一步证明了CeO2较好地掺杂到g-C3N4中.
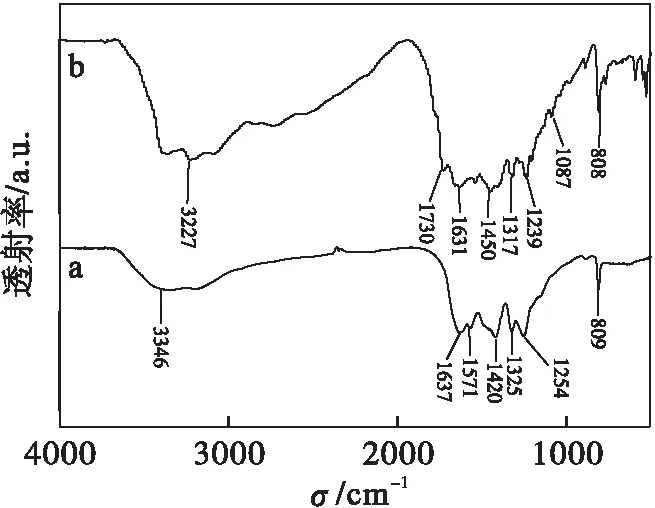
a g-C3N4 b g-C3N4-CeO2图3 g-C3N4和g-C3N4-CeO2的红外光谱Fig.3 FTIR spectra of g-C3N4 and g-C3N4-CeO2
2.2 Au/g-C3N4-CeO2-HRP/GCE的电化学行为
图4为不同修饰电极在0.1 mol/L的PBS(pH=7.0,v=100 mV/s)溶液中的循环伏安图.
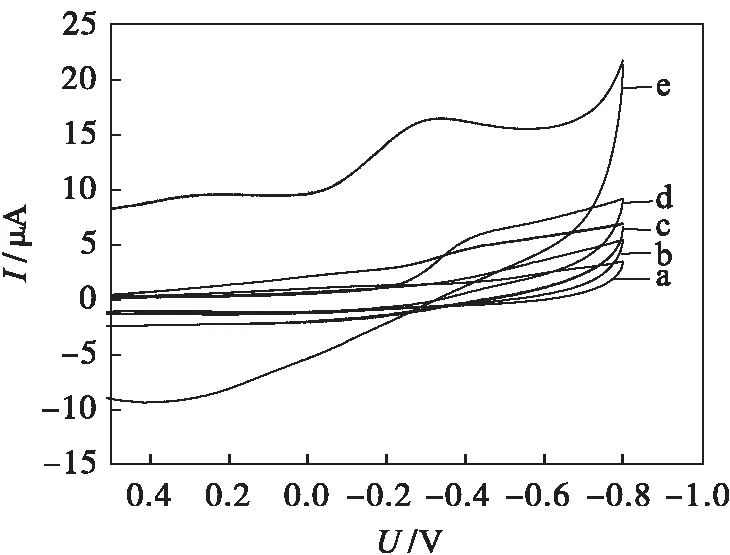
a GCE b g-C3N4-CeO2/GCE c g-C3N4-HRP/GCEd g-C3N4-CeO2-HRP/GCE e Au/g-C3N4-CeO2-HRP/GCE图4 不同修饰电极在PBS(0.1 mol/L,pH=7.0) 溶液中的循环伏安曲线Fig.4 CVs of different modified electrods in PBS(0.1 mmol/L,pH=7.0) solution
图4中,a为未修饰玻碳电极的循环伏安曲线,b为只修饰g-C3N4-CeO2的玻碳电极的循环伏安曲线,可以看出a、b曲线无明显的氧化还原峰,说明g-C3N4-CeO2在电极表面不发生电子转移.c、d分别为g-C3N4,g-C3N4-CeO2与HRP共同修饰玻碳电极的循环伏安曲线,可以看出CeO2的加入有利于电子的传递,d曲线在-0.4 V附近出现了HRP的还原峰,表明HRP在电极表面发生了电子转移,但可逆性较差.e为电聚合金后修饰电极的循环伏安曲线,相比于a、b、c、d 曲线,e曲线的响应电流增大较多,且还原峰电位正移至-0.3 V,电化学反应的可逆性有所提高,说明纳米金的引入加快了电子的转移,有利于HRP的直接电子转移.
2.3 扫速的影响
图5为不同扫速(20、40、60、80、100、120、140、160、180、200、220 mV/s)下Au/g-C3N4-CeO2-HRP/GCE在pH=7.0的PBS缓冲溶液中的循环伏安图.由图5可以看出:随着扫速的增加,电流强度也随之增大,但是氧化峰和还原峰的峰电位几乎不变,由此可见修饰电极具有较好的电化学可逆性.还原峰电流(Ipc,μA) 和氧化峰电流(Ipa,μA) 均与扫描速度(v,mV/s)的一次方呈线性关系(图5插图),线性回归方程分别为Ipc=0.908+0.107v,相关系数r=0.997 1;Ipa=-1.125-0.097v,相关系数r=-0.999 5,表明该电极反应受表面吸附过程控制[30].

1 v=20 mV/s 2 v=40 mV/s 3 v=60 mV/s 4 v=80 mV/s 5 v=100 mV/s 6 v=120 mV/s 7 v=140 mV/s 8 v=160 mV/s 9 v=180 mV/s 10 v=200 mV/s 11 v=220 mV/s图5 不同扫速下g-C3N4-CeO2-HRP/GCE/Au的 循环伏安曲线Fig.5 CVs of g-C3N4-CeO2-HRP/GCE/Au with different scan rates
2.4 阻抗的测定
电化学阻抗(EIS)是一种表征电化学界面导电性的表征手段,用该方法可以表征电极表面的化学反应过程.如图6中的a曲线所示,当电极没有被修饰时图上出现一个半圆形曲线,表明电子的传递受到阻碍;当电极表面被g-C3N4-CeO2-HRP修饰后,EIS曲线上的半圆弧半径明显增大(曲线b),说明g-C3N4-CeO2-HRP成功修饰于电极表面并影响了电子表面的传递;当在g-C3N4-CeO2-HRP表面再修饰纳米Au后(曲线c),导电性明显增加,表明修饰纳米金后电极具有较好的导电性,促进了溶液与电极之间的电子传递.

a GCE b g-C3N4-CeO2-HRP/GCE c Au/g-C3N4-CeO2-HRP/GCE图6 不同修饰电极的阻抗谱图Fig.6 EIS curves of different modified electrods
2.5 实验条件的优化
2.5.1 电化学聚合氯金酸时间对修饰电极响应电流的影响
电化学聚合氯金酸的时间长短会影响修饰电极响应电流的大小,实验以2、4、6、8、10、12 min作为备选条件.实验结果表明:在6 min时电极产生的响应电流最大,反应最灵敏,因此选用6 min作为实验的最佳电聚合时间.
2.5.2 工作电位对修饰电极响应电流的影响
在-0.25~-0.45 V范围内对响应电流值进行测定,考察工作电位对修饰电极响应电流的影响.结果表明:电位在-0.25~-0.35 V时响应电流随着电位的减小逐渐增大,电位为-0.35 V时,产生的响应电流最大,反应最灵敏,电位低于-0.35 V时,响应电流逐渐减小.因此实验选用-0.35 V为该传感器的最佳工作电位.
2.5.3 pH对修饰电极响应电流的影响
pH对电极表面酶的催化活性有很大的影响.在pH为5.0~9.0范围内考察修饰电极在0.1 mol/L PBS缓冲溶液中的响应电流的变化.实验结果表明:在-0.35 V工作电位下,pH在5.0~7.0范围内,修饰电极的响应电流随着pH的增大而增大;至pH=7.0时,响应电流最大,灵敏度最高,当pH超过7.0时,响应电流呈下降趋势.因此实验选择pH=7.0的PBS溶液做为测试底液.
2.6 Au/g-C3N4-CeO2-HRP/GCE对H2O2的催化活性研究
图7为v=100 mV/s时Au/g-C3N4-CeO2-HRP/GCE修饰电极对H2O2的电催化响应循环伏安曲线.由图7可以看出:在没加入H2O2的空白PBS(0.1 mol/L,pH=7.0)溶液中,电极在0.5~-0.5 V范围内产生了一对准可逆的氧化还原峰;当加入0.1 mmol/L的H2O2后还原峰电流显著增大,表明Au/g-C3N4-CeO2-HRP/GCE修饰电极对H2O2的还原具有明显的催化作用.

图7 加入0.1 mmol/L H2O2前后Au/g-C3N4-CeO2- HRP/GCE的循环伏安曲线Fig.7 CVs response of Au/g-C3N4-CeO2-HRP/GCE before and after the absence of 0.1 mmol/L H2O2
2.7 Au/g-C3N4-CeO2-HRP/GCE对H2O2的检测范围及检出限
在最佳实验条件c(PBS)=0.1 mol/L,pH=7.0,U=-0.35 V下,Au/g-C3N4-CeO2-HRP/GCE对H2O2响应的计时电流曲线如图8所示.由图8可以看出:随着溶液中H2O2浓度的增加,响应电流逐渐增大,且电催化响应很快,表明此传感器对H2O2具有很好的催化效果.结果表明:Au/g-C3N4-CeO2-HRP/GCE对H2O2的还原峰电流(I,μA)与其浓度(c,mmol/L)在1.0×10-5~4.6×10-3mol/L范围内呈线性关系,线性方程为I=4.254+10.164c,相关系数为r=0.998 8,检出限为2.6 μmol/L(S/N=3).
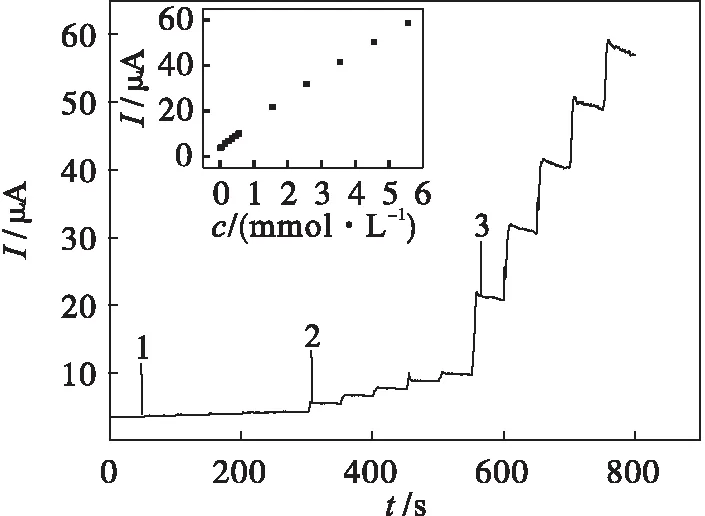
1 c(H2O2)=0.01 mmol/L 2 c(H2O2)=0.1 mmol/L 3 c(H2O2)=1 mmol/L图8 Au/g-C3N4-CeO2-HRP/GCE对不同 浓度H2O2响应的计时电流曲线Fig.8 The chronoamperometric curves of Au/g- C3N4-CeO2-HRP/GCE response to different concentrations
2.8 Au/g-C3N4-CeO2-HRP/GCE的稳定性、重现性和干扰实验
为考察修饰电极的稳定性,将一支Au/g-C3N4-CeO2-HRP/GCE置于pH=7.0 的PBS缓冲溶液中,在100 mV/s的扫速下,连续进行40圈循环伏安扫描.结果表明:循环扫描40圈后,其电流响应信号仍能保持初始信号的82.1 %,说明电极具有较好的稳定性.在相同条件下,用一根Au/g-C3N4-CeO2-HRP/GCE对1 mmol/L的H2O2重复测定5次,测定结果的相对标准偏差(RSD)为6.1 %,说明该电极具有较好的重现性.
利用计时电流法对有可能的干扰物进行测定.在优化实验条件下,与1 mmol/L H2O2同浓度的谷氨酸,组氨酸,抗坏血酸以及10倍浓度的葡萄糖,柠檬酸,甘氨酸,乳酸,酪氨酸对H2O2的测定均不产生干扰,说明该电极具有较好的选择性.
2.9 实际样品测定
为验证Au/g-C3N4-CeO2-HRP/GCE传感器在实际样品中测定的可行性,用上述传感器对自来水样品进行加标回收实验.取5.0 mL自来水样品,用5.0 mL PBS(0.1 mol/L,pH=7.0)稀释后,加入H2O2(忽略体积影响)的浓度分别为0.25,0.5和1 mol/L.分别测定样品溶液的H2O2浓度,每个浓度样品测定3次,结果如表1所示.由表1结果可知:Au/g-C3N4-CeO2-HRP/GCE测定自来水样品的加标回收率可达98.4 %~101.2 %,因此,该传感器可以用于实际水样的检测.

表1 实际水样中H2O2的测定Table 1 The determination of H2O2 in real water samples
3 结 论
采用高温煅烧法合成g-C3N4材料,以此为基底材料掺杂CeO2制备出g-C3N4-CeO2复合材料,用壳聚糖将g-C3N4-CeO2复合材料和HRP修饰到玻碳电极表面,进一步电化学聚合纳米金构建新型的Au/g-C3N4-CeO2-HRP/GCE酶传感器.该传感器界面具有良好的生物相容性、导电性和催化活性.该传感器还具有较好的重现性和稳定性,对H2O2具有较好的还原效果.该研究对构建新型的电化学酶传感器在的检测H2O2方面有潜在的应用前景.

