薄型子宫内膜小鼠模型的免疫组化鉴定与生育力评估
张汝月,李瑞娇,张引红,李红霞,郭兴萍*
(1.山西医科大学基础医学院,太原 030001;2. 山西省生殖科学研究所,出生缺陷与细胞再生山西省重点实验室,太原 030007;3. 山西医科大学实验动物中心,实验动物与人类疾病动物模型山西省重点实验室,太原 030001)
薄型子宫内膜大大影响子宫内膜容受性,导致胚胎着床失败,或不能维持继续妊娠,是生殖医学领域中的难题之一[1],且薄型子宫内膜作为一个重要的易检测临床指标,受到了广大妇科医生的关注。临床一般认为,薄型子宫内膜患者黄体期子宫内膜厚度<7 mm,适宜的子宫内膜厚度(8~14 mm),会大大增加受精卵着床的可能性[2]。目前,对薄型子宫内膜病因猜测甚多,但临床尚无明确诊断,也很少能直接获得可供研究的人体组织标本[3]。因此,建立接近的薄型子宫内膜动物模型并进行相关研究,是科研工作者能想到最为合适的方法。
目前国内外关于子宫损伤的动物模型案例非常多样化,动物选择包括牛、猪、猕猴、比格犬、兔、大小鼠等,损伤方法也有机械损伤、电热损伤、化学试剂损伤以及多种方法联合损伤等[4-10]。但目前关于薄型子宫内膜的造模方法仅有一种,即利用高浓度乙醇的脱水及蛋白质变性作用,宫腔注射95%乙醇构建薄型子宫内膜大鼠模型[8-10],参考该方法及本课题组的初步研究[11],通过小鼠宫腔内注射95%乙醇建立了薄型子宫内膜小鼠模型,并已通过子宫内膜厚度,HE染色等方面的鉴定证明造模初步成功。但造模成功率较低,且鉴定较为片面,仍需进一步完善。
在前期实验的基础上,本实验对造模方法进行适当的优化,建立薄型子宫内膜小鼠模型,并予以更加全面的结构和功能方面的鉴定,为深入了解薄型子宫内膜的病理特征及寻求有效的治疗方法提供理想的动物模型。
1 材料和方法
1.1 实验动物
6~8周龄SPF级性成熟且未交配C57BL/6J雌性小鼠78只,体重19~22 g;10周龄SPF级,预实验已确定有生育能力的C57BL/6J雄性小鼠30只,体重22~25 g。由山西医科大学实验动物中心提供[SCXK(晋)2015-0001]。饲养条件:山西医科大学实验动物中心屏障环境动物实验室[SYXK(晋)2015-0001],每5只一笼,温度(25±2)℃,湿度(55±2)%,光照明暗时间比为12 h/12 h,自由获取食物和水。本实验操作遵循实验动物伦理学要求(伦理审批号:IACUC2017-004)。
1.2 主要试剂与仪器
戊巴比妥钠(Ceres Chemical)、无水乙醇(国药集团化学试剂有限公司)、生理盐水(山东华鲁制药有限公司)、伊红(Bioswamp)、苏木素(Bioswamp)、甲醛(国药集团化学试剂有限公司)、中性树脂(Bioswamp)、二甲苯(国药集团化学试剂有限公司),3% H2O2(国药集团化学试剂有限公司)、DAB浓缩试剂盒(Bioswamp)、pan-cytpkeratin(H-240):sc-15367(Santa)、ERα(hc-20):sc-543(Santa)、monoclonalanti-vimentin:V-6630 (Sigma)、VEGF antibody(VG-1):ab1316(Abcam)。
研究级正置显微镜(Olympus IX51)、组织脱水机(湖北康强医疗器械有限公司)、石蜡包埋机(湖北泰维科技视野有限公司)、石蜡切片机(徕卡显微系统有限公司)、摊片烤片机(湖北康强医疗器械有限公司)、IMS图像分析系统(武汉华联科生物技术有限公司),恒温烘箱(上海恒益科学仪器有限公司)。
1.3 实验方法
1.3.1 实验分组
所有实验动物分为两组。第一组小鼠30只,随机分为空白组,对照组和实验组,每组10只。于第三个动情周期的动情期当日进行造模实验,造模后的第三个动情期针对角蛋白,波形蛋白,血管内皮生长因子(vascular endothelial growth factor,VEGF)和雌激素受体α(estrogen receptor α,ERα)进行免疫组化鉴定。第二组48只,随机分为空白组,对照组,单侧损伤组和双侧损伤组,每组12只。造模后第三个动情期进行合笼交配,根据妊娠情况对薄型子宫内膜小鼠模型的生育力进行评估。
1.3.2 薄型子宫内膜小鼠模型的建立
95%乙醇具有迅速使细胞脱水及蛋白质变性的作用,可深入损伤子宫内膜基底层。基于本课题组的初步研究[11],建立薄型子宫内膜小鼠模型。
本次实验过程优化步骤:(1)整个手术过程以及术后小鼠的苏醒在动物保温台上进行;(2)手术过程选用弯钩无损伤眼科镊;(3)于靠近宫颈处插入1 mL注射器,尽量使子宫内膜损伤完全且均匀,并防止注射针穿透子宫导致药物外漏;(4)宫腔注入95%乙醇时,用无菌纱布保护周围组织,特别是膀胱及肛门附近区域。
1.3.3 标本收集
第一组造模后全部存活小鼠进行免疫组化检测实验。其中空白组与对照组在造模过程中无小鼠意外死亡,实验组2只小鼠死亡。于第三个动情期,将造模后所有存活小鼠颈椎脱臼法处死,取出子宫并置于4%多聚甲醛(PFA)中,待下一步研究。
1.3.4 免疫组织化学鉴定
将术后所获子宫组织垂直包埋,切为大小1.5 cm×1.5 cm×0.3 cm的标本,切好的组织块置于10%福尔马林中固定48 h,随后依次置于不同浓度的乙醇中逐级脱水,每级2 h。将组织块进行透明处理、浸蜡后,再进行包埋,切片,最后进行免疫组化染色。
角蛋白、波形蛋白在0.01 mol/L柠檬酸钠缓冲溶液中进行高压抗原修复,大火沸腾后中火10 min较为适宜,ERα为中火20 min,VEGF在1 L EDTA抗原修复液中进行修复,同样为大火沸腾后中火10 min。3% H2O2中湿盒孵育10 min,消除内源性过氧化物酶的活性,并在补充有10%正常山羊血清的磷酸盐缓冲盐水(PBS)中封闭1 h。然后,将组织切片与针对细胞角蛋白(1∶50),波形蛋白(1∶200),VEGF(1∶150)及ERα(1∶100))的一抗一起4℃孵育过夜,添加maxvision二抗,37℃静置30 min,DAB染色,苏木精复染,烘干后透明,封片。最后,使用显微成像系统,每个切片在高倍率(×400)下随机选取三个区域以获得子宫内膜的免疫组织化学切片图像。通过对细胞角蛋白、波形蛋白、VEGF和ERα的免疫组化检测来分析子宫内膜细胞的再生情况,采用平均光密度法,平均光密度(AOD mean density)=IOD(integrated optical density)累积光密度/area,并进行组间的分析比较。
1.3.5 生育力评估
第二组造模后全部存活小鼠进行生育力评估实验。其中空白组与对照组在造模过程中无小鼠意外死亡,实验组II(单侧损伤)1只小鼠死亡,实验组I(双侧损伤)3只小鼠死亡。所有存活小鼠于第三个动情期的每天下午5:30同时与雄性小鼠以雌雄2∶1的比例进行合笼交配。每天早上08:00观察阴栓,以确定是否成功交配。
若交配成功,即将雌、雄小鼠分开饲养,并进行标记。若交配不成功,继续合笼,但合笼大约一周后,停止合笼。观察到阴栓约16 d后,将雌性小鼠颈椎脱臼处死以确定怀孕情况。暴露子宫,观察小鼠子宫妊娠情况,如胚胎数量、胚胎颜色等,拍照、记录,并进行组间统计学分析。
1.4 统计学分析

2 结果
2.1 免疫组织化学鉴定
三个动情周期后,通过免疫组织化学检测各组子宫内膜细胞角蛋白、波形蛋白、VEGF和ERα的表达。免疫组织化学染色根据待检测蛋白与其抗体特异性结合的原理,通过化学反应使标记抗体的显色剂显色,来确定组织细胞内抗原及其含量,显色面积与抗原量成正相关。免疫组织化学结果显示实验组细胞角蛋白、波形蛋白、VEGF和ERα的平均光密度值(average optical density,AOD)明显低于空白组和对照组(P< 0.05),但空白组与对照组相比差异无统计学意义(P> 0.05)(见图1~4)。
2.1.1 子宫内膜细胞角蛋白的表达
角蛋白,对维持上皮细胞的形态完整性有重要作用,主要表达于子宫内膜腺上皮和腔上皮细胞中(见图1A-C),细胞角蛋白表达量的高低反映了子宫内膜上皮细胞的生长情况。空白组与对照组间细胞角蛋白的AOD差异无统计学意义(P> 0.05);然而,与空白组和对照组相比,实验组的AOD显著降低(P< 0.01)(见表1)。
2.1.2 子宫内膜细胞波形蛋白的表达
波形蛋白存在于中胚层起源的细胞中,是间质细胞中最主要的中间纤维,主要表达于基质细胞的胞质中(见图2A-C),波形蛋白表达量的高低反映了子宫内膜基质细胞的生长情况。免疫组化结果显示,空白组与对照组间波形蛋白的AOD差异无统计学意义(P> 0.05);然而,与空白组和对照组相比,实验组的AOD显著降低(P< 0.01)(见表2)。
2.1.3 子宫内膜VEGF的表达
VEGF是目前已知的促血管生成的重要细胞因子,主要表达于子宫内膜、腺体和血管内皮细胞的细胞质中(见图3A-C)。 如表3所示,空白组与对照组间VEGF的AOD差异无统计学意义(P> 0.05)。然而,与空白组和对照组相比,实验组VEGF显示出明显较低的AOD,且差异具有显著性(P< 0.01)(表3)。

注:A:空白组;B:对照组;C:实验组。图1 子宫内膜中细胞角蛋白的表达(×400)Note. A: Blank group; B: Control group; C: Experimental group.Figure 1 Protein expression of cytokeratin in the mouse endometrium. Immunohistochemical staining.

组别Groups空白组(n=10)Blank group对照组(n=10)Control group实验组(n=8)Experimental group细胞角蛋白Cytokeratin0.071±0.00320.075±0.00200.058±0.0019*#
注:与空白组比较,*P< 0.01;与对照组比较,#P< 0.01。
Note. Compared with the blank group,*P< 0.01. Compared with the control group,#P< 0.01.
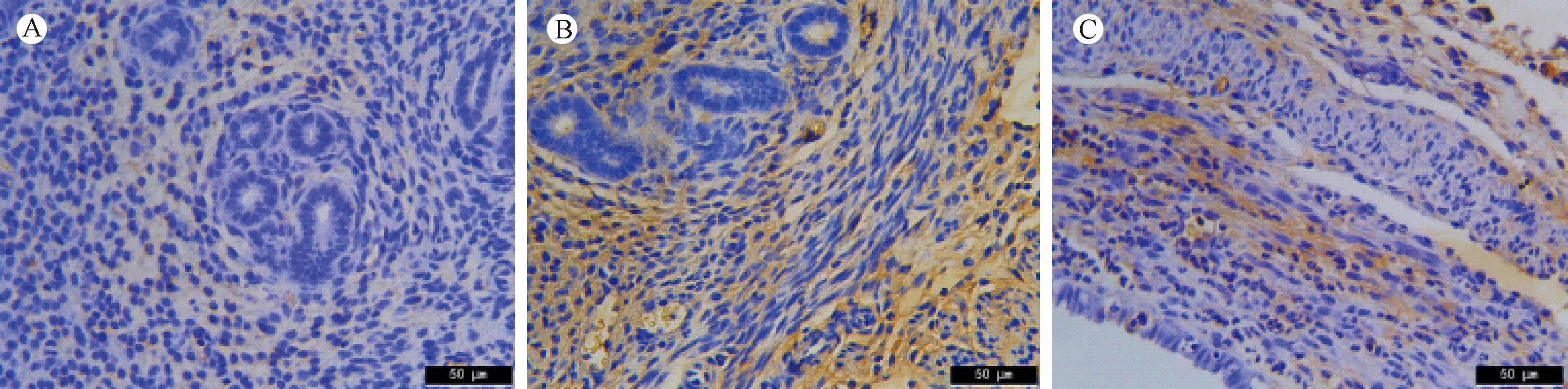
注:A:空白组;B:对照组;C:实验组。图2 子宫内膜中波形蛋白的表达(×400)Note. A: Blank group; B: Control group; C: Experimental group.Figure 2 Protein expression of vimentin in the mouse endometrium. Immunohistochemical staining.

组别Groups空白组(n=10)Blank group对照组(n=10)Control group实验组(n=8)Experimental group波形蛋白Vimentin0.049±0.00300.047±0.00160.029±0.0050*#
注:与空白组比较,*P< 0.01;与对照组比较,#P< 0.01。
Note. Compared with the blank group,*P< 0.01. Compared with the control group,#P< 0.01.
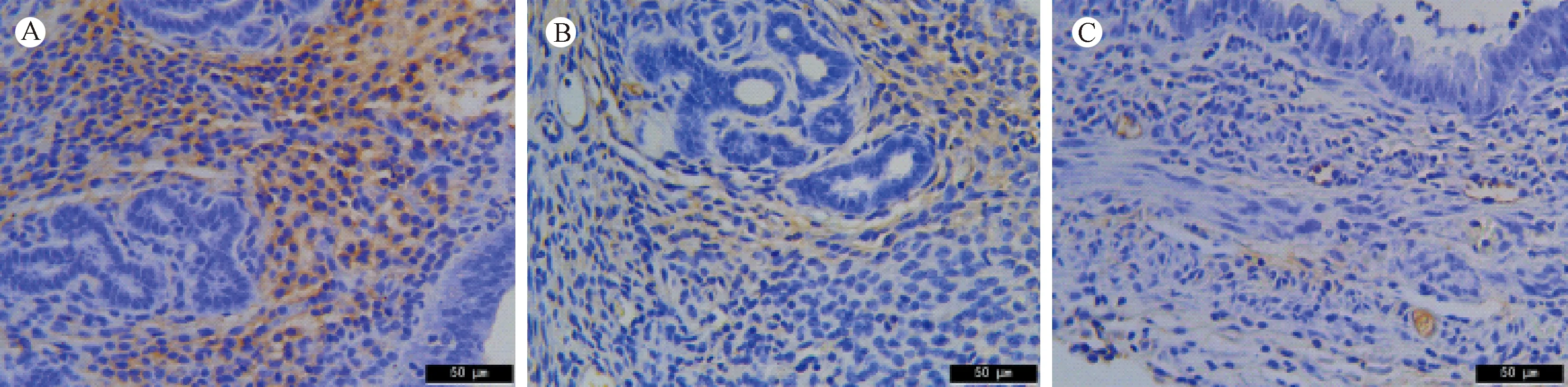
注:A:空白组;B:对照组;C:实验组。图3 子宫内膜中VEGF的表达(×400)Note. A: Blank group; B: Control group; C: Experimental group.Figure 3 Protein expression of VEGF in the mouse endometrium.Immunohistochemical staining.

组别Groups空白组(n=10)Blank group对照组(n=10)Control group实验组(n=8)Experimental group血管内皮生长因子VEGF0.051±0.00210.047±0.00200.021±0.0018*#
注:与空白组比较,*P< 0.01;与对照组比较,#P< 0.01。
Note. Compared with the blank group,*P< 0.01. Compared with the control group,#P< 0.01.
2.1.4 子宫内膜ERα的表达
雌激素是调节子宫内膜生长的主要激素,而雌激素受体是雌激素对子宫内膜发生作用的桥梁。ERα主要表达于子宫内膜腺上皮和腔上皮细胞的胞核和胞浆中,胞核表达大于胞浆,基质细胞中也有表达(见图4A-C)。如表4所示,空白组与对照组间ERα的AOD差异无统计学意义(P> 0.05)。然而,与空白组和对照组相比,实验组ERα显示出明显较低的AOD,且差异具有显著性(P< 0.01)(表4)。
2.2 生育力评估
生育力是检验子宫功能的重要指标,生育力评估实验也是用于进一步验证薄型子宫内膜小鼠模型是否建立成功的关键方法。
造模过程中,由于实验操作或化学试剂等影响,空白组和对照组无小鼠意外死亡,实验组II(单侧损伤)一只小鼠意外死亡;而实验组I(双侧损伤)三只小鼠意外死亡。将造模后所有存活小鼠进行合笼交配用于生育力评估实验。生育力评估结果显示,手术损伤侧子宫的平均怀孕率明显低于对侧(未损伤侧子宫)(P< 0.01)(见表5)。
空白组8只小鼠怀孕,怀孕率为66.7%(与文献资料接近)[12],子宫两侧均见胚胎,且胚胎质量良好(见图5A);对照组小鼠怀孕情况与空白组相同(见图5B);实验组II有7只小鼠怀孕,怀孕率为63.6%,胚胎位于未损伤一侧子宫,且靠近宫颈部位的胚胎较小,发育不良,考虑可能是由对侧子宫注入的95%乙醇的渗入导致。同时,损伤侧子宫未见受孕(见图5C);实验组I中仅一只小鼠怀孕,怀孕率为11.1%。子宫体形态不规则,粗细不均,子宫颜色发白或发黄,且局部有出血点。(见图5D)。
生育能力评估结果显示,空白组与对照组比较,小鼠的怀孕率差异无统计学意义(P> 0.05)。但与其他三组比较,实验组Ⅰ小鼠的怀孕率显著降低(P< 0.01)。同时,与空白组和对照组相比,实验组II整体怀孕率差异具有统计学意义(P< 0.05),但损伤侧和未损伤侧子宫的怀孕率之间存在显著性差异(P< 0.01)(见表5)。

注:A:空白组;B:对照组;C:实验组。图4 子宫内膜中ERα的表达(×400)Note. A: Blank group; B: Control group; C: Experimental group.Figure 4 Protein expression of ERα in the mouse endometrium.Immunohistochemical staining.

组别Groups空白组(n=10)Blank group对照组(n=10)Control group实验组(n=8)Experimental group雌激素受体αERα0.059±0.00420.063±0.00360.041±0.0043*#
注:与空白组比较,*P< 0.01;与对照组比较,#P< 0.01。
Note. Compared with the blank group,*P< 0.01. Compared with the control group,#P< 0.01.

注:A:空白组,子宫两侧均见胚胎,胚胎质量较好;B:对照组,子宫两侧均见胚胎,胚胎质量良好;C:实验组II(单侧损伤),胚胎位于未损伤一侧子宫,且靠近宫颈部位的胚胎较小,发育不良, 损伤侧子宫未见受孕;D:实验组I(双侧损伤),子宫体形态不规则,粗细不均,子宫颜色发白或发黄,且局部有出血点。图5 合笼后四组小鼠的怀孕情况Note. A: In the blank group, embryos were present in the bilateral uterus, and the quality of embryos was good. B: In the control group, embryos were present in both sides of the uterus and the embryos were of good quality. C: In experimental group II (unilateral injury), embryos were present in the undamaged side of the uterus, but embryos were smaller and dysplasia occurred near the cervix. No embryos were found in the damaged side of the uterus. D: In the experimental group I (bilateral injury), the uterus was irregular in shape, uneven in thickness, and whitish or yellow in color with some bleeding.Figure 5 Pregnancy in the mice of the four groups after being caged

组别Groups存活小鼠数量Number of surviving mice怀孕数量Number of pregnant mice怀孕率(%)Pregnancy rate空白组Blank group12866.7对照组Control group12866.7实验组II(单侧损伤)Experimental group II (unilateral injury)11763.6*#实验组I(双侧损伤)Experimental group I (bilateral injury)9111.1**##
注:与空白组比较,*P< 0.05,**P< 0.01;与对照组比较,#P< 0.05,##P< 0.01。
Note. Compared with the blank group,*P< 0.05,**P< 0.01. Compared with the control group#P< 0.05,##P< 0.01.
3 讨论
薄型子宫内膜严重威胁着育龄女性的生育健康,更是临床医生经常会遇到的棘手难题。Miwa等[13]描述薄型子宫内膜的特点是腺体上皮细胞生长受限、子宫内膜血流阻力高、血管内皮细胞生长因子生成降低,并且血管发育较差。针对这一难题,临床上目前尚未建立统一的诊治标准。有关薄型子宫内膜治疗的方式很多,主要包括补充雌激素、促性腺激素释放激素激动剂等的内分泌治疗[14-15];服用小剂量阿司匹林、己酮可可碱和维生素E等改善子宫内膜血流灌注的治疗[16-18];以及植入粒细胞-集落刺激因子(G-CSF)[19]和骨髓间充质干细胞(BMSCs)[1]等促进子宫内膜再生的新方法等,但治疗效果并不显著,尤其是个体差异非常明显[20]。随着诱导胚胎干细胞、骨髓干细胞、脂肪干细胞等[21-23]相关干细胞技术的不断成熟,干细胞疗法被认为可能是未来最有前景的治疗方法之一[24]。因此,建立一个相似度高且稳定的实验动物模型,为下一步的干细胞或者其他的相关治疗方案提供基础,显得尤为重要。
本课题参考高红[8]构建薄型子宫内膜大鼠模型所用高浓度乙醇宫腔注射损伤法。无水乙醇具有迅速使细胞脱水及蛋白质变性的作用,可对子宫内膜基底层造成损伤,效果显著,且注射剂量及注射时间易于控制。本课题组前期研究[11]发现可能由于小鼠麻醉后新陈代谢较慢,无法维持正常体温,再加之术前75%乙醇对表皮消毒进一步加速了周边温度降低,而手术仅在普通手术板上进行,相关的术中及术后保温条件较差,小鼠的存活率较低;同时发现在术后恢复过程中,个别小鼠出现脱肛的现象,考虑可能是无水乙醇残留外漏所致。因此,本次实验对前期实验过程进行了适当优化,选择整个手术过程以及术后小鼠的苏醒在动物保温台上进行,完善了保温条件;宫腔注入95%乙醇时,用无菌纱布保护周围组织,特别注意保护小鼠膀胱和肛门附近区域,并防止注射针穿透子宫导致乙醇外漏以及注射过程中拉直子宫选用弯钩无损伤眼科镊,损伤后及时将无水乙醇吸出,酌情增加生理盐水冲洗次数等,尽可能避免因乙醇外漏对实验动物其他组织部位造成损伤。本课题组前期研究[11]已对造模后小鼠子宫从子宫外观形态、颜色,组织结构和子宫内膜厚度等方面对薄型子宫内膜小鼠模型进行鉴定,研究发现,95%乙醇宫腔注射后,小鼠子宫迅速脱水、变白、失去弹性;三个动情周期后,小鼠子宫体形态不规则,且局部有出血点,红白相间[11]。HE染色显示,与空白组和对照组相比,实验组子宫内膜层较薄,腺体和血管数量均减少,血管分布情况改变[11],这与Asherman综合征中子宫内膜的变化类似[25],也符合临床薄型子宫内膜相关症状。
子宫内膜是一种具有高度动态循环的组织,可发生周期性的变化,主要由上皮细胞、基质细胞和血管细胞组成[26]。细胞角蛋白、波形蛋白和VEGF分别表达于上皮细胞、基质细胞和血管细胞,因此,这些指标表达量的高低反映了子宫内膜细胞的生长情况,进而反映子宫内膜再生情况。细胞角蛋白是外胚层细胞的重要蛋白,主要功能是维持上皮组织的完整性和连续性,且细胞中角蛋白的含量与上皮细胞的增殖分化密切相关。波形蛋白是间质细胞中最主要的中间纤维,与微管、微丝共同形成一个细胞支架网络来维持间质细胞的完整性。VEGF则是一种重要的血管生成因子,通过增加血管通透性,改变血管内皮细胞中的基因表达谱和促进血管内皮细胞的有丝分裂进而促进新血管形成[27],为子宫内膜再生提供充分的血流灌注。免疫组化检测显示实验组子宫内膜细胞角蛋白和波形蛋白的表达显著低于空白组和对照组,并且实验组中新生毛细血管数量明显减少。由此可见,本实验构建的薄型子宫内膜小鼠模型是成功的。同时,ERα是子宫内ER的主要亚型,在雌激素介导的子宫内膜细胞增殖和生长过程中起主导作用[28],因此,ERα也是反映子宫内膜细胞生长情况的重要指标之一。本研究发现,实验组子宫内膜ERα的表达较空白组和对照组显著降低。ERα表达的降低也符合薄型子宫内膜的病理特征。
参考相关文献[29-31],为了验证造模是否成功,对模型都做了关于生育力评估的实验。并且本次建立薄型子宫内膜小鼠模型的最终目的是研究修复薄型子宫内膜的方法及相关机制,因此,生育力评估也是验证后期修复实验是否成功的重要环节。本次研究中,生育力评估实验结果显示,实验组中损伤侧子宫的平均怀孕率与未损伤侧子宫的平均怀孕率相比有显著性差异,进一步表明成功建立了薄型子宫内膜小鼠模型,且发现在单侧损伤实验组中损伤侧子宫并不影响对侧子宫的受孕情况,这表明损伤侧子宫的生育力下降的确是由宫腔注射95%乙醇导致。
以上研究结果表明,本实验通过宫腔注射95%乙醇已经成功建立薄型子宫内膜的C57BL/6J小鼠模型,为进一步研究薄型子宫内膜的形成、修复机制以及寻求有效的治疗手段提供了理想的动物模型。

