不同方法诱导大鼠非酒精性单纯性脂肪肝模型的CYP酶活性比较研究
金 毅,邢 伟,吕爱贞,张金龙,杨 雯,徐愉林,王 茜,李 静
(1.深圳市药品检验研究院(深圳市医疗器械检测中心)深圳药品质量标准研究重点实验室,广东 深圳 518057;2.广东东阳光药业有限公司,广东 东莞 523000)
非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)是与胰岛素抵抗和遗传易感密切相关的代谢应激性肝损伤,疾病谱包括非酒精性单纯性脂肪肝(nonalcoholic fatty liver,NAFL),非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)以及相关肝硬化和肝细胞癌[1-2]。随着发病率的增加和年轻化趋势,已成为全球重要的公共健康问题。NAFL被认为是早期病理过程,发展为肝硬化和肝癌的比例分别为5%~10%和1%~2%[1,3-4]。
目前国际公认的NAFL指标中,肝脏组织学表现符合单纯性脂肪肝诊断标准即可诊断,其病理特征主要为肝腺泡3区大泡性或以大泡为主的混合性肝细胞脂肪变[1, 5-8]。
肝脏是药物体内代谢的重要器官,而细胞色素P450酶(CYP450)是参与药物Ⅰ相代谢反应的主要超家族酶系,广泛参与脂肪酸、类固醇、胆酸、前列腺素、白三烯、生物胺以及类维生素等物质的生物合成和代谢,与内外源性的物质代谢密切相关[9]。通过评价NAFLD模型大鼠体内CYP酶活性,对研究脂肪肝等肝疾病及合理用药治疗肝病具有潜在意义。CYP450酶系已明确的有18个家族,43个亚家族。参与药物代谢的家族主要有CYP1,CYP2和CYP3,其中CYP1A2、2B6、2C9、2D6和3A4共同参与了约95%以上的经CYP酶催化的临床药物的代谢。在肝硬化模型中大鼠的肝微粒体CYP总量明显降低,肝损伤大鼠模型中CYP3A基因表达量会减少等几种亚酶活性变化情况,但是,未找到CYP1A2、2B6、2C9、2D6和3A4活性变化在NAFL动物模型研究数据[10-13]。
国内外研究CYP450酶活性的方法有很多,主要包括体内和体外两大方面。其中体外的研究方法有肝微粒体孵育法、肝S9孵育法、药物探针法等。肝微粒体和肝S9均是肝细胞中内质网的亚细胞组分,含有丰富的药物代谢酶P450酶,是肝匀浆液经过不同离心速度得到的组分。与肝微粒体制备对比,肝S9所需的离心速度较低,是肝匀浆液去线粒体的上清液,组分中含有的代谢酶种类也更多,包括各种I相代谢酶和II相代谢酶,添加NADPH(还原型辅酶II),可以检测I相代谢酶。目前肝S9系统在药代动力学方面、毒理学和药物相互作用等方面应用比较广泛[14]。
鉴于目前尚未见对CCl4或高脂饲料诱导的大鼠NAFL模型CYP酶活性方面的比较研究报道,本研究采用大鼠肝S9孵育体系法探讨CCl4和高脂模型2种因素诱导的大鼠NAFL模型中主要CYP酶活性的变化。
1 材料和方法
1.1 实验动物
SPF级雄性SD大鼠,体重160~180 g,购自湖南斯莱克景达实验动物有限公司,动物质量合格证号:43004700035137,生产许可证号[SCXK(湘)2016-0002];动物使用许可证号[SYXK(粤)2014-0135]。动物饲养于广东东阳光药业有限公司东阳光研究院屏障环境动物实验室,在20℃~26℃温度和40%~70%湿度下饲养,采用12 h∶12 h昼夜间断照明,严格按照SPF级动物实验室标准操作规程(SOP)规范操作[15](实验动物福利伦理审查号 IAEC-K-170712-01)。
1.2 主要试剂与仪器
高脂饲料(为自拟高脂饲料配方,具体成分为:基础饮料:50%,豆粉:12.5%,蛋黄粉:12.5%,猪油:10%,蔗糖:10%,奶粉:5%,浓鱼肝油:1/100 g。委托广东省医学实验动物中心配制);非那西汀购自阿拉丁(批号:WXBC1218V)、双氯芬酸钠(批号:100334-200302)购自中国食品药品检定研究院;丁呋洛尔购自TRC(批号:1-EJB-67-6)、安非他酮(批号:100671-200301)购自中国药品生物制品检定所,紫杉醇(批号:130326)购自上海康标化学有限公司,0.01 mol/L Tris-HCL缓冲盐(批号:批号ST774)购自碧云天。色谱纯甲醇与乙腈购自SPECTRUM,色谱纯甲酸和甲酸铵购自阿拉丁,其余试剂为色谱纯,其余试剂详见参考文献[15]。
IKA T10B 手持匀浆机(德国IKA公司);冷冻研磨仪(上海静信实业发展有限公司);Eppendorf 5810R冷冻离心机(德国Eppendorf 公司);AB sciex 4500质谱仪(美国AB SCIEX公司);Agilent 1200型高效液相色谱仪(美国Agilent公司);其余仪器见[15]。
1.3 实验方法
1.3.1 两种大鼠NAFL模型的建立
实验动物分为CCl4模型组和溶媒组,CCl4模型组大鼠每周2次皮下注射CCl4(40%,四氯化碳溶于橄榄油),给药量为2 mL/kg,溶媒组平行处理,背部皮下注射橄榄油,直至实验结束。用于实验4周,6周和9周剖杀的CCl4模型组和溶媒组动物数量分别为:5只,5只;5只,5只;10只,10只。
高脂模型组及空白对照组,每组各10只。高脂模型组每天给予高脂配方饲料,空白对照组给予正常饮食喂养。
根据笔者前期多次实验确认皮下给予CCl4造模4周造模成功,故设置的第一个时间点为4周;文献中,高脂饲料喂养大鼠实验多选择8周确认造模成功,根据笔者经验,将高脂饲料造模的时间点设置为9周,以便与CCl4模型形成相似的肝细胞脂肪变性为主的病理学改变,在病理基本相近或相似的基础上比较肝脏微粒体CYP酶活性变化特点[16-17]。此外,考虑主要实验目的及周期,为观察CCl4模型在不同时间点CYP酶活性特点,本课题组把CCl4模型实验的结束时间点设置为9周。
实验结束时,大鼠禁食不禁水16 h,腹腔注射3%戊巴比妥钠(2 mL/kg)麻醉,处死。
1.3.2 大鼠肝S9制备
分别于CCl4造模4周、6周、9周,高脂造模9周,取边长3 mm的新鲜肝组织,用冰水冷却的生理盐水冲洗净,保存于-80℃,用于制备肝S9。
制备肝S9时,称取500 mg大鼠肝组织于5 mL离心管中,于冰上剪碎肝组织,按1∶3(W∶V)比例加入匀浆液(0.25 mol/L蔗糖、0.01 mol/L Tris-HCl和1 mmol/L EDTA,pH=7.4),用手持匀浆机于冰上以6000 r/min匀浆1 min,将匀浆后的混合液转入2 mL离心管中,9000 r/min,4℃离心30 min,每管取200 μL上清液用于实验[12]。
1.3.3 肝S9体外温孵孵育系统条件
肝S9体外温孵优化后系统包括30 μL大鼠肝S9(对上述制备的S9用磷酸钾缓冲液稀释100倍),15 μL探针底物溶液(1A2底物非那西汀浓度120 μmol/L、2B6底物安非他酮浓度40 μmol/L、2C9底物双氯芬酸钠浓度40 μmol/L、2D6底物丁呋洛尔浓度40 μmol/L、3A4底物睾酮浓度320 μmol/L)预孵10 min,于各孔加入15 μL 8 mmol/L NADPH,37℃(pH=7.4)共孵育45 min后,加入150 μL乙腈(含100ng/mL普萘洛尔)终止反应,4000 r/min,4℃离心5 min取上清100 μL加水100 μL混匀,用于样品分析。
1.3.4 检测条件
色谱柱:ACE Excel3 C18-Amide(50×2.1 mm),流速0.4 mL/min,柱温40℃,A相(水+2 mmol/L甲酸铵+0.1%甲酸),B相(甲醇+2 mmol/L甲酸铵+0.1%甲酸),梯度为B相0~0.8 min,2%~2%;0.8~1.0 min,2%~85%;1.0~2.8 min,85%~90%;2.8~2.9 min,90%~2%;2.9~3.8 min,2%~2%。ESI+(电喷雾离子源),雾化气(N2)压力55 psi,源温度550℃。选择正离子方式检测,检测电压5500 V,采用多反应监测(MRM)方式进行定量。内标普萘洛尔离子对(Q1/Q3)为260.2/116.1、1A2探针底物代谢物Q1/Q3为152.1/110.0、2B6探针底物代谢物Q1/Q3为256.1/238.0、2C9探针底物代谢物 Q1/Q3为312.0/231.2、2D6探针底物代谢物 Q1/Q3为278.4/186.3、3A4探针底物代谢物 Q1/Q3为305.0/269.2。
1.3.5 ALT,AST检测
腹主动脉采血,室温放置2 h后4℃、3000 r/min,离心15 min,取血清,采用常规生化方法检测ALT、AST。
1.3.6 肝脏甘油三酯及胆固醇的检测
剪取新鲜肝脏部分左大叶,称取约20 mg肝组织,用无水乙醇匀浆,离心取上清,测TG及CHO的浓度,计算肝内TG及CHO的含量,详见参考文献[15]。
1.3.7 组织病理学检查
福尔马林固定肝组织,7 d。常规脱水浸蜡后,HE染色制片,光学显微镜下观察。
1.4 统计学方法


注:A:溶媒组肝脏(4周);B:CCl4模型组肝脏(4周);C:CCl4模型组肝脏(6周);D:CCl4模型组肝脏(9周)。图1 CCl4诱导的NAFL模型大鼠在4,6,9周的组织病理学改变(×200,HE染色)Note. A: Liver of the vehicle control group(week 4); B: Liver of the NAFL model group established by CCl4 (week 4); C: Liver of the NAFL model group established by CCl4 (week 6); D: Liver of the NAFL model group established by CCl4 (week 9).Figure 1 Histopathological changes in the NAFL rats established by CCl4 at weeks 4, 6, and 9 (HE staining)
2 结果
2.1 病理学确认CCl4造模成功
NAFL模型组与溶媒组比较,肝脏表面色泽发黄,体积、重量增加。组织病理学观察,溶媒组未见异常(图1A),模型组第4周主要病变为肝细胞大泡性脂肪变性(图1B),第6、9周可见肝组织以大泡性脂肪变性为主,偶见炎细胞浸润灶(图1C,1D)。
2.2 病理学确认高脂造模成功
大体观察,与空白对照组比较,模型组肝脏表面发黄,重量增加。组织病理学观察,空白对照组肝脏未见异常(图2A),模型组为以大泡性脂肪变为主的病变(见图2B)。
2.3 2种模型动物肝脏脂质含量及肝脑比均有显著增加
CCl4模型组大鼠在实验第4,6和9周与各自的溶媒组比较,肝内TG、CHO含量及肝脑比明显增加,有统计学意义(表1);与空白对照组相比,高脂模型组动物肝内TG、CHO含量及肝脑比增加,有统计学意义(表2)。

注:A:空白对照组肝脏;B:高脂饲料诱导NAFL模型组肝脏(9周)。图2 高脂饲料诱导的NAFL模型大鼠的组织病理学改变(HE染色, ×100)Note. A: Liver of the control group; B: Liver of the NAFL model group established by a high fat diet (week 9).Figure 2 Histopathological changes in the NAFL rats established by a high fat diet (HE staining)
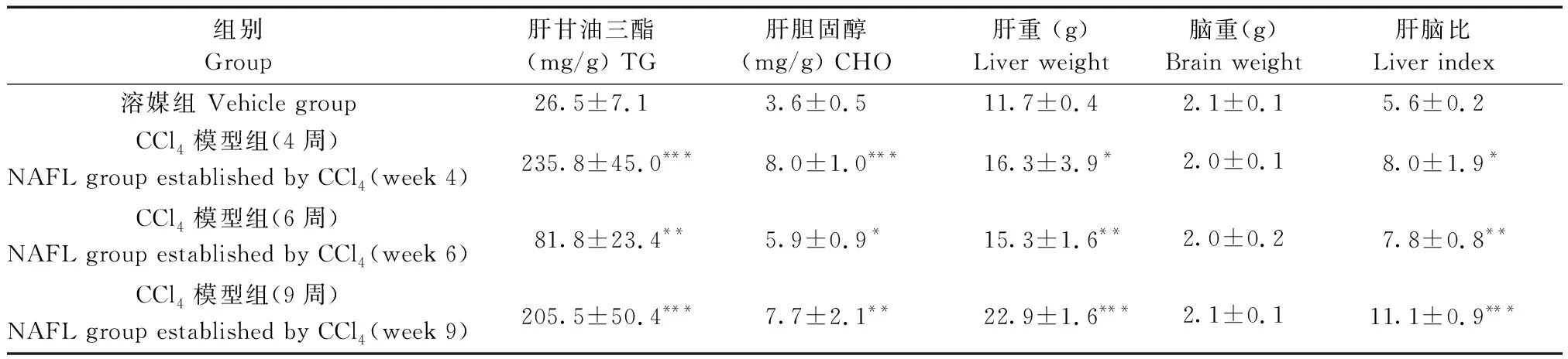
组别Group肝甘油三酯(mg/g) TG 肝胆固醇(mg/g) CHO 肝重 (g) Liver weight脑重(g) Brain weight肝脑比 Liver index溶媒组 Vehicle group 26.5±7.13.6±0.511.7±0.42.1±0.15.6±0.2CCl4模型组(4周)NAFL group established by CCl4(week 4)235.8±45.0***8.0±1.0***16.3±3.9*2.0±0.18.0±1.9*CCl4模型组(6周)NAFL group established by CCl4(week 6)81.8±23.4**5.9±0.9*15.3±1.6**2.0±0.27.8±0.8**CCl4模型组(9周)NAFL group established by CCl4(week 9)205.5±50.4***7.7±2.1**22.9±1.6***2.1±0.111.1±0.9***
注:与溶媒组比较,*P<0.05,**P<0.01,***P<0.001。
Note. Compared with vehicle group,*P<0.05,**P<0.01,***P<0.001.

表2 高脂饲料诱导NAFL实验中各组大鼠肝脂质,脏器重量,肝指数变化Table 2 Changes of liver lipids, organ weight, and liver index in each group of NAFL rat models established by a high fat diet
注:与空白对照组比较,*P<0.05,**P<0.01。
Note. Compared with control group,*P<0.05,**P<0.01.

表3 CYP450底物和代谢产物Table 3 CYP450 substrate and metabolites
2.4 色谱行为
本研究采用文献报道的特异性底物研究主要CYP酶的代谢,底物总结见表3;各底物的代谢物色谱行为显示,各底物代谢物色谱峰不受内源性物质干扰,基线平稳,本方法具有一定的专属性和特异性(图3)。

注:A:空白S9样品中1A2代谢物离子通道色谱图;B:空白S9样品中2B6代谢物离子通道色谱图;C:空白S9样品中2C9代谢物离子通道色谱图;D:空白S9样品中2D6代谢物离子通道色谱图;E:空白S9样品中3A4代谢物离子通道色谱图;F:空白S9样品中内标普萘洛尔离子通道色谱图;G:S9样品加底物孵育后1A2代谢物离子通道色谱图;H:S9样品加底物孵育后2B6代谢物离子通道色谱图;I:S9样品加底物孵育后2C9代谢物离子通道色谱图;J:S9样品加底物孵育后2D6代谢物离子通道色谱图;K:S9样品加底物孵育后3A4代谢物离子通道色谱图;L:S9样品加底物孵育后内标普萘洛尔离子通道色谱图。图3 各CYP酶底物代谢物LC/MS/MS色谱图Note. A: Chromatogram of the 1A2 metabolite ion channel in the control S9 sample; B: Chromatogram of the 2B6 metabolite ion channel in the control S9 sample; C: Chromatogram of the 2C9 metabolite ion channel in the control S9 sample; D: Chromatogram of the 2D6 metabolite channel ion in the control S9 sample; E: Chromatogram of the 3A4 metabolite ion channel in the control S9 sample; F: Chromatogram of the internal standard propranolol ion channel in the control S9 sample; G: Chromatogram of the 1A2 metabolite ion channel in the S9 sample plus substrate after incubation; H: Chromatogram of the 2B6 metabolite ion channel in the S2 sample plus substrate after incubation; I: Chromatogram of the 2C9 metabolite ion channel in the S9 sample plus substrate after incubation; J: Chromatogram of the 2D6 metabolite ion channel in the S9 sample plus substrate after incubation; K: Chromatogram of the 3A4 metabolite ion channel in the S9 sample plus substrate after incubation; L: Chromatogram of the internal standard propranolol ion channel in the S9 sample plus substrate after incubation.Figure 3 LC/MS/MS chromatogram of each CYP enzyme substrate metabolites
2.5 CCl4诱导的NAFL模型中,主要CYP酶活性均下降
模型组与溶媒组比较,亚酶CYP1A2、2B6、2C9、2D6、3A4酶活性均有不同程度下降,以CYP1A2、2C9、2D6、3A4从第4周起,下降显著(P<0.001)(图4A,C-E),CYP2B6则第6周起下降显著(见图4E)。
2.6 高脂饲料诱导的NAFLD模型中,主要CYP酶活性无明显变化
CYP各亚酶活性在模型组与空白溶媒组比较,CYP1A2, CYP3A4 可见轻度上升,CYP2D6基本没有改变,CYP2B6和CYP2C9可见下降,但均无统计学意义(见图5)。
2.7 CCl4诱导的NAFL模型中,ALT和AST均有显著升高
主要反映肝脏功能的ALT和AST在CCl4诱导的NAFL模型与各自的溶媒组比较,在3个时间点(4周,6周,9周)均有明显增加,具有统计学意义(图6)。

注:A:CCl4诱导大鼠NAFL模型中CYP1A2酶活性变化;B:CCl4诱导大鼠NAFL模型中CYP2B6酶活性变化;C:CCl4诱导大鼠NAFL模型中CYP2C9酶活性变化;D:CCl4诱导大鼠NAFL模型中CYP2D6酶活性变化;E:CCl4诱导大鼠NAFL模型中CYP3A4酶活性变化。模型组与同一时间点溶媒组比较对比,***P<0.001。图4 CCl4诱导的大鼠NAFL模型中CYP酶活性变化Note. A: Changes of CYP1A2 enzyme activity in the rat NAFL model established by CCl4; B: Changes of CYP2B6 enzyme activity in the rat NAFL model established by CCl4; C: Changes of CYP2C9 enzyme activity in the rat NAFL model established by CCl4; D: Changes of CYP2D6 enzyme activity in the rat NAFL model established by CCl4; E: Changes of CYP3A4 enzyme activity in the rat NAFL model established by CCl4. Compared with the vehicle group, ***P< 0.001.Figure 4 Changes of CYP enzyme activity in the NAFL rat models induced by CCl4

图5 高脂饲料诱导的大鼠NAFL模型中CYP酶活性变化Figure 5 Changes of CYP enzyme activity in the NAFL rat models established by a high fat diet

注:A:CCl4诱导大鼠NAFL模型中ALT变化;B:CCl4诱导大鼠NAFL模型中AST变化。模型组与同一时间点溶媒组比较对比,*P<0.05,**P<0.01,***P<0.001。图6 CCl4诱导的大鼠NAFL模型中ALT,AST的变化Note. A: Changes of ALT in the rat NAFL model established by CCl4; B: Changes of AST in the rat NAFL model established by CCl4. Compared with the vehicle group, *P<0.05, **P<0.01, ***P<0.001.Figure 6 Changes of ALT and AST in the NAFL rat models established by CCl4

图7 高脂饲料诱导的大鼠NAFL模型中ALT,AST变化Figure 7 Changes of CYP enzyme activities in NAFL rats established by a high fat diet
2.8 高脂饲料诱导的NAFLD模型中,ALT和AST无明显变化
ALT和AST在高脂饲料诱导9周的NAFL模型与空白对照组比较,无明显变化(图7)。
3 讨论
NAFL是由单个或多个因素引起的以甘油三酯为主的脂类物质在肝细胞中蓄积,其发病机制尚未研究透彻,包括NAFL在内的NAFLD的治疗目前还缺乏有效的方案和药物。NAFL导致肝脏对肝损伤因素的抗力降低,特别是对肝毒性物质、肝脏的缺血、缺氧等耐受性下降。研究不同肝损伤机制诱导的大鼠NAFL模型中CYP酶活性,有助于NAFL发病机制的探索,为NAFL的治疗提供基础研究数据,具有一定的参考价值。
CYP450超家族中,CYP1A,CYP2C和CYP3A是参与药物代谢的主要家族[11, 14]。本研究发现在CCl4诱导的NAFL模型中主要CYP酶活性(CYP1A2,CYP2B6(第4周除外),CYP2C9,CYP2D6,CYP3A4)均有较大程度的降低(P<0.001)。且CCl4模型中溶媒对照组的酶活性随着大鼠周龄增加而明显下降,但大鼠还不属于老龄化大鼠,这有待近一步研究[19]。在高脂饲料诱导的NAFL模型中,主要CYP亚酶活性与空白对照组相比较,无明显差异。同时,反映肝功能的外周血ALT、AST在两个模型中有显著差异:CCl4模型组在3个时间点(第4,6,9周),和溶媒组比较均显著增加,而在高脂模型组(第9周)中尚无显著性变化。由此提示,两种不同方法建立的NAFL模型,虽然均为以大泡性脂肪变为主的肝脏病变,但是,CCl4通过抑制CYP450亚酶活性,引起肝脏功能受损;而高脂饲料虽引发了肝细胞的脂肪变性,尚未造成显著的肝脏功能受损。
截至目前,虽有大量NAFL临床研究数据,以及高脂饲料诱导NAFL的专利和论文,但尚无对CCl4诱导NAFL模型的分析及与高脂模型的比较研究[19-23]。本研究填补了这一空白,结果显示在不同机制诱导的NAFL病变,CYP酶活性变化模式有明显不同,提示CYP酶活性变化可用于鉴别CCl4等化学性肝损伤诱导的NAFL。

