EDU脉冲追踪小鼠心脏第二心场细胞迁移方法的优化
袁白银 刘钟颖
(武汉科技大学生命科学与健康学院,武汉 430065)
先天性心脏缺陷是人类死亡率最高的疾病之一,影响约 1% 的新生儿[1]。30% 的人类先天性心脏缺陷是由流出道(Outflow tract,OFT)发育异常引起的[2-3]。OFT 和右室(Right ventricle,RV)是由第二心场(Second heart field,SHF)祖细胞发育而来的[4-5]。哺乳动物心脏主要是由第一心场(First heart field,FHF)和 SHF 组成的[6]。在心脏发育过程中,位于咽中胚层(Pharyngeal mesoderm,PM)和内脏中胚层(Splanchnic Mesoderm,SpM)的 SHF细胞通过动脉极向 OFT 和 RV 迁移部署,通过静脉极贡献于心房心肌细胞[5,7]。SHF 祖细胞向 OFT 贡献不足会使 OFT 延长受损,在人和小鼠中导致心室分割、动脉排列的缺陷,如双出口右心室(Double outlet right ventricle,DORV),主动脉骑跨,大动脉转位,肺动脉闭锁和永存动脉干(Persistent truncus arteriosus,PTA)等[3,8-9]。迄今,许多学者在进行 SHF 祖细胞迁移部署的研究,并取得了一定的研究成果和进展,但是 SHF 祖细胞迁移部署的细胞生物学过程尚不清楚。因此,研究追踪 SHF 细胞迁移部署的细胞生物学过程对于阐明哺乳动物心脏发育过程具有重要意义,将会为 SHF 发育缺陷提供新的视角。
现有标记追踪 SHF 迁移部署的方法主要有胚胎显微注射染料标记[3,10-11]和孕鼠注射染料标记[12-13],前者对实验者的操作及实验条件要求相对较高。5-乙炔基-2’-脱氧尿嘧啶核苷(5-ethynyl-2’-deoxyuridine,EDU)是一种胸腺嘧啶核苷类似物,在细胞增殖时能够插入正在复制的 DNA 分子中,基于 EDU 与染料的共轭反应可以进行高效快速的细胞增殖检测分析。SHF 祖细胞在 SpM 处具有很强的增殖能力并不断的向远端 OFT 迁移,而远端 OFT的 SHF 细胞并不具有增殖的能力[14]。根据 SHF 祖细胞增殖和迁移的特性,在特定的时期通过向孕鼠脉冲注射 EDU 就能够将胚胎 SpM 中处于增殖期的SHF 细胞进行有效的标记,而经过一段时间的迁移,在 SpM 处被 EDU 脉冲标记的 SHF 细胞将迁移到达远端 OFT,因此,根据 EDU 标记细胞在 OFT 处的距离就可以追踪 SHF 的迁移情况。Li[13]研究团队报道,在胚胎发育的 9.25 d(E 9.25)采用 250 mg(相当于 10 mg/kg 剂量)EDU 的剂量腹腔注射孕鼠,在注射 EDU 2 h 后,采用腹腔注射 EDU 的类似物胸苷嘧啶核苷(Thymidine)终止 EDU 的作用,于 15 h后检测被 EDU 标记的 SHF 细胞的迁移情况。本研究采用该报道的剂量进行 EDU 标记和追踪发现,大部分胚胎不能被 EDU 有效的标记。
在文献报道的基础上,通过优化剂量和标记时间来改良 EDU 脉冲标记追踪 SHF 细胞迁移部署的实验方法。结果显示,采用 40 mg/kg 剂量和 2 h 的标记时间,在所有检测的胚胎中,SHF 细胞都被有效标记,且与 10 mg/kg 剂量相比,在 SpM 处 EDU标记细胞的数量明显增加。在此条件下,通过 19 h的追踪,EDU 标记的 SHF 细胞迁移进入远端 OFT。统计结果显示,与 10 mg/kg 的剂量相比,采用 40 mg/kg 剂量显著地增加远端 OFT 处 EDU 阳性细胞的百分率;而在两种剂量下,EDU 阳性细胞迁移进入远端 OFT 的距离并没有差异。同时发现,在 40 mg/kg 剂量条件下,2 h 和 4 h 的标记时间对 EDU 标记效率以及 EDU 标记细胞向 OFT 的迁移距离并没有差异。总之,通过优化 EDU 的剂量和标记时间,本研究拟提供一种有效、方便的追踪 SHF 迁移部署的方法。
1 材料与方法
1.1 材料
C57BL/6J 小鼠购自南京大学模式动物研究所,EDU 及染色试剂盒购于 Invitrogen 公司(C10338),DAPI 购于生工生物工程(上海)有限公司(6584)。
1.2 方法
1.2.1 EDU 和胸苷嘧啶核苷腹腔注射 实验前1 d将成年雄鼠和雌鼠合笼,第2天上午检栓,将该天见栓受孕的孕鼠标记为 E 0.5(胚胎发育第 0.5 d)。按照文献报道,在 E 9.25 时,腹腔注射给予孕鼠一定剂量的 EDU,在注射 EDU 2 h 后,给予孕鼠 10倍剂量的 EDU 类似物胸苷嘧啶核苷终止 EDU 作用。追踪 19 h 后处死孕鼠,收获胚胎(约为 E 10.0)。将收获的胚胎进行连续石蜡切片和后续的 EDU 检测。EDU 粉末用灭菌的 PBS 配成浓度为 2.5 mg/mL(10 mmol/L)的原液,原液用 PBS 稀释为 1 mg/mL 的工作浓度使用;胸苷嘧啶核苷用灭菌的双蒸水配成48.5 mg/mL 原液,原液用双蒸水稀释使用。所有操作均在遵守并符合实验动物福利及动物管理等相关条例的条件下进行,本研究得到了南京大学模式动物研究所伦理委员会的批准。
1.2.2 胚胎的固定、脱水、包埋、切片 (1)颈椎脱臼处死孕鼠,于预冷 PBS 中小心分离胚胎;(2)4%多聚甲醛固定胚胎 2 h;(3)PBS 清洗 2 次,每次 5 min;(4)梯度乙醇脱水:30% 乙醇,15 min→50%乙醇,15 min→70% 乙醇,15 min→85% 乙醇,15 min→95% 乙醇,15 min;(5)正丁醇透明 3 次,每次 10 min;(6)65℃ 透蜡 1 h,中间换蜡 2-3 次;(7)将胚胎组织进行石蜡包埋;(8)石蜡包埋胚胎进行连续切片,厚度 5 μm;(9)胚胎石蜡切片进行 EDU染色。
1.2.3 EDU检测 (1)石蜡组织切片复水:二甲苯3 次,每次 10 min→梯度乙醇复水(100% 乙醇,2 min→95% 乙醇,2 min→85% 乙醇,2 min→70%乙醇,2 min→50% 乙醇,2 min→ H2O,2 min);(2)2 mg/mL 甘氨酸清洗 10 min ;(3)0.5% TritonX-100(PBST) 通 透 20 min;(4)PBS 清 洗 5 min;(5)EDU 染色混合液室温避光孵育 1 h,染色混合液成分 如 下 :1×Click-iT EdU reaction buffer:430 μL,10×Click-iT EdU buffer additive :50 μL,CuSO4(10 mmol/L):20 μL,Alexa Fluor 555 azide :1.2 μL ;(6)0.5% Tritonx-100 in 1×PBS 清洗 2-3 次,每次 10 min;(7)甲醇清洗 1-2 次,每次 5 min;(8)PBS清洗 5 min;(9)DAPI 工作液室温避光孵育 30 min;(10)封片,leica 激光共聚焦显微镜下荧光成像。
1.2.4 结果统计分析 使用 ImageJ 软件统计分析EDU 迁移的距离以及 EDU 阳性细胞的百分率,将胚胎中包含 OFT 及 SpM 的部位进行石蜡切片,对每只胚胎 OFT 及 SpM 连续切片的染色结果进行测量。使用 Graphpad 6.0 对测量结果进行统计分析。*代表P< 0.05,**代表P< 0.01,***代表P< 0.001。
2 结果
2.1 10 mg/kg剂量EDU显示较差的标记效果
首先给予孕鼠 10 mg/kg 的 EDU(文献报道的剂量),2 h 后注射 100 mg/kg的胸苷嘧啶核苷终止EDU 作用;19 h 后处死孕鼠,收获 E 10.0 胚胎并进行连续石蜡切片和后续的 EDU 检测。同时为了更好的分析 EDU 标记结果,选取孕鼠的小肠组织检测EDU 的标记情况(存在大量增殖的细胞)。
结果(图 1)发现,所有孕鼠的小肠组织都能被 EDU 有效的标记;在我们由 4 只孕鼠获得的 22枚胚胎中,只有 10 枚(50%)胚胎被 EDU 有效标记,在另外超过 50% 的胚胎中,大部分胚胎没有 EDU标记的细胞,一部分胚胎有极少量的细胞被 EDU标记;且由同一孕鼠获取的胚胎中,有些胚胎能被EDU 标记,有些却未被标记。以上结果显示,采用文献报道 10 mg/kg 剂量的 EDU,可以对孕鼠组织进行有效的标记,但对胚胎的标记效果较差。
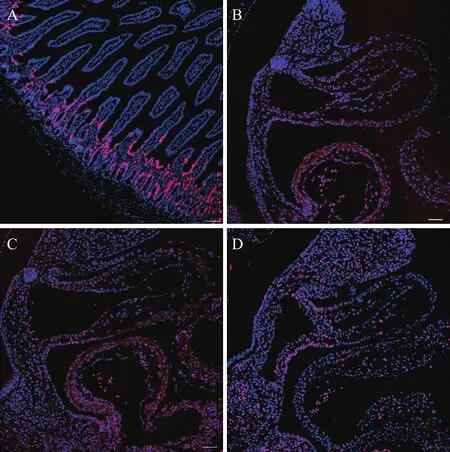
图 1 10 mg/kg 剂量 EDU 在胚胎中的标记效果
2.2 采用40 mg/kg剂量的EDU可对胚胎进行有效的标记
10 mg/kg 剂量的 EDU 可对孕鼠组织进行有效标记,而胚胎则不能进行有效标记。我们推测可能因为胚胎存在胎盘屏障,相对于孕鼠自身的组织,剂量过小的 EDU 较难渗透到胚胎组织中。因此,我们将 EDU 剂量增加至 40 mg/kg,并采用 400 mg/kg 剂量的胸苷嘧啶核苷终止 EDU 标记。
为了检测该剂量的 EDU 和胸苷嘧啶核苷是否对孕鼠及胚胎产生毒性,将注射 EDU 和胸苷嘧啶核苷的孕鼠继续饲养,发现这些孕鼠是可以正常产仔,且产下的小崽与正常小崽并没有区别。在分离胚胎过程中分析观察孕鼠的形态、内脏器官,以及胚胎的发育情况。结果(图 2)显示,该剂量的 EDU 和胸苷嘧啶核苷没有影响孕鼠和胚胎的正常机能和发育,不会对孕鼠和胚胎造成毒性;且由 6 只孕鼠获取的 31 只胚胎均被 EDU 有效标记,在胚胎中出现大量 EDU 阳性的 SHF 细胞,且 EDU 标记的 SHF 细胞已经迁移进入远端 OFT。
检测 EDU 在 SpM 处对 SHF 祖细胞的标记区域及标记百分率(在 SpM 处,EDU 阳性细胞占 SpM处所有细胞的百分率)。结果(图 3)显示,EDU 标记的 SHF 细胞只存在于 SpM,没有出现在 OFT 区域;胚胎连续切片 EDU 检测和统计分析结果表明,SpM处 EDU 阳性细胞约占整个 SpM 细胞的 53%。以上结果说明,采用 40 mg/kg 的剂量属于安全剂量,且对胚胎的 SHF 细胞能够进行有效的标记。
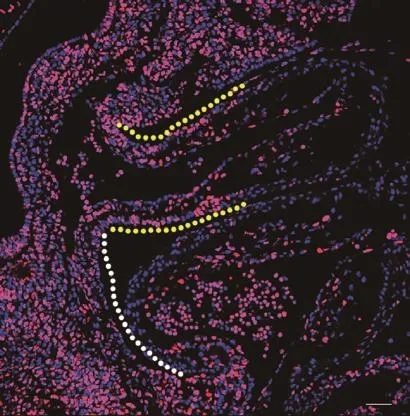
图 2 E 10.0,胚胎中EDU的标记情况

A-A’:E 9.25,胚胎中 EDU 标记 SHF 细胞的分布 ;B :E 9.25,SpM 处 EDU阳性细胞的百分率。白色虚线标识的是 SpM 部位,红色虚线标识的是 OFT部位。标尺= 50 μm
2.3 评估剂量对追踪SHF细胞迁移的效果
为评估剂量对追踪 SHF 细胞迁移的效果,我们将 40 mg/kg 和 10 mg/kg 两种剂量的效果进行对比分析。由于采用 10 mg/kg 剂量对胚胎的标记效率较低,通过增加孕鼠数量来增加被有效标记的胚胎数量。
统计分析 EDU 阳性细胞迁移进入 OFT 处的距离,以及 EDU 阳性细胞在远端 OFT 迁移距离中EDU 阳性细胞的百分率(以下简称 OFT 处 EDU 阳性细胞百分率)。结果(图 4)显示,两种剂量对EDU 阳性 SHF 细胞在远端 OFT 的迁移距离没有差别;相比 10 mg/kg 剂量(OFT 处 EDU 阳性细胞百分率为 31%),40 mg/kg 剂量标记的胚胎中,OFT 处EDU 阳性细胞的百分率有了显著性提高(54%),且OFT 处 EDU 阳性细胞的百分率与 E 9.25 时 SpM 处EDU 阳性细胞百分率一致。
以上结果表明,采用 40 mg/kg 剂量的 EDU 脉冲标记能够真实、有效地追踪 SHF 细胞向 OFT 迁移。
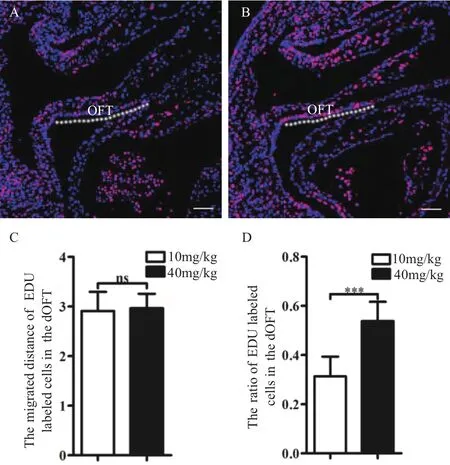
图 4 剂量对追踪 SHF 细胞迁移的影响
2.4 评估EDU脉冲标记时间的影响
为了检测 EDU 标记时间对标记效率及细胞迁移的影响,在 40 mg/kg EDU 剂量条件下,分析比较 2 h 和 4 h 的标记效率。由于 E 10.0 时 OFT 处 EDU 阳性细胞的百分率与 E 9.25 时 SpM 处 EDU 阳性细胞百分率一致,这里用 E 10.0 处 EDU 阳性细胞的百分率分析 EDU 的标记效率。
注射 EDU,分别在 2 h 和 4 h 给予 400 mg/kg 胸苷嘧啶核苷终止标记,19 h 后收获 E 10.0 胚胎,分析统计 OFT 处 EDU 阳性 SHF 细胞的百分率和迁移距离。结果(图 5)显示,4 h EDU 标记时间与 2 h EDU 标记时间,在 OFT 处 EDU 阳性 SHF 细胞的百分率和迁移距离中没有表现出差异。说明 2 h 标记时间即可将 SpM 处增殖的 SHF 进行充分有效的标记。考虑到 4 h 的标记可能会对细胞迁移产生一定的影响,采用 2 h 的 EDU 标记时间具有一定的优势。
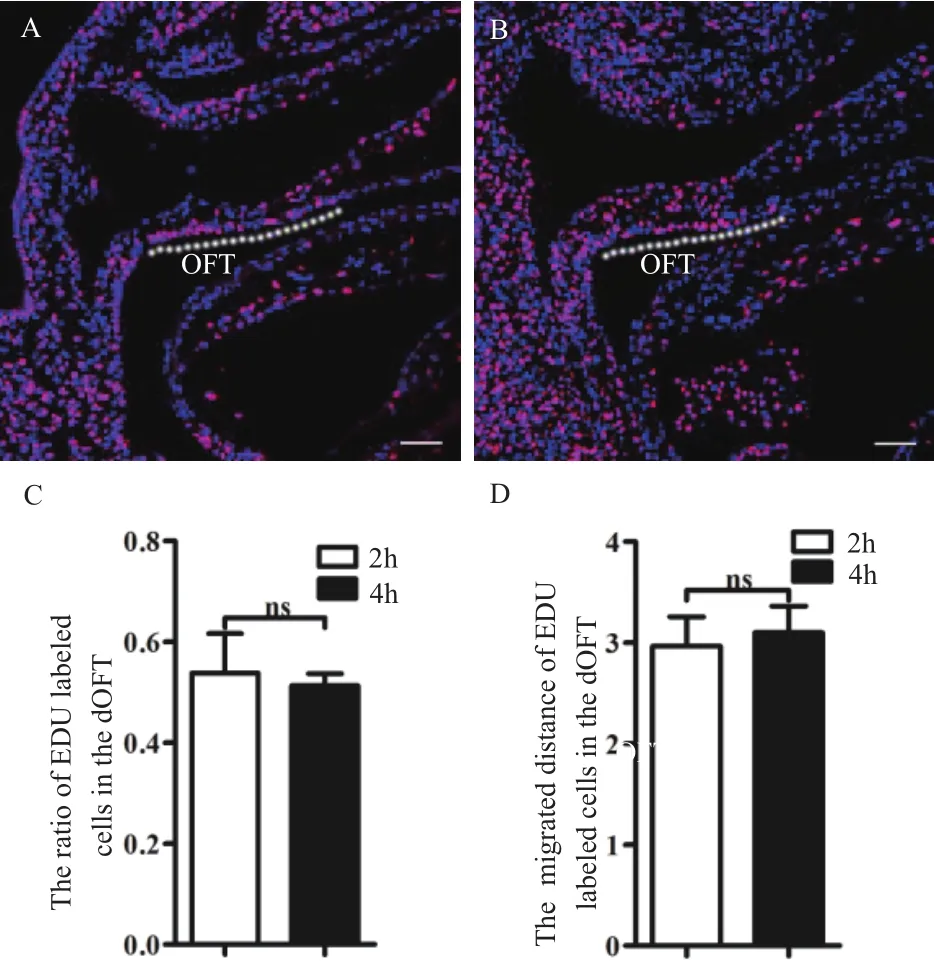
图 5 EDU 标记时间的影响
3 讨论
先天性心脏缺陷中约有 30% 是由于 OFT 发育缺陷引起的。OFT 和 RV 是由第二心场祖细胞贡献发育而来的,SHF 祖细胞发育缺陷将引起动脉及对应心室排列、动脉分隔的缺陷,在人和小鼠中导致DORV、大动脉转位、PTA 等心脏发育的异常。迄今为止,SHF 祖细胞向 OFT 迁移、部署的细胞生物学过程仍是尚未阐明清楚的问题,也是目前很多科学工作者正在研究攻克的方向。目前,研究 SHF 迁移、部署过程所采用的实验方法有胚胎显微注射染料并结合胚胎体外培养[3,10]、胚胎厚切片培养结合双光子显微成像系统[15]、孕鼠腹腔注射 EDU 脉冲标记结合石蜡切片免疫荧光染色技术[12-13]等。前两种方法对实验条件、操作环境、仪器设备及实验人员的操作等均有很高的要求和难度,需要配套有相应的实验条件和设备,给实验的实施带来了很大的挑战。而 EDU 脉冲标记是通过将 EDU 腹腔注射孕鼠,EDU 掺入处于细胞增殖 S 期正在复制的 DNA分子中,基于 EDU 与染料的共轭反应可以对 EDU进行简单、快速、准确的检测,实验操作简单,对操作人员的技术、实验设备和条件要求不高。因此,EDU 脉冲标记追踪 SHF 细胞的迁移部署过程具有很强的实施性和操作性。
本研究在使用文献报道的方法进行 EDU 脉冲标记追踪 SHF 细胞的迁移过程中发现,EDU 不能将胚胎中处于增殖期的细胞进行有效的标记。在此基础上,通过调整 EDU 的剂量及标记时间,我们探索并优化出标记追踪 SHF 细胞迁移的有效方法:给予孕鼠腹腔注射 40 mg/kg 剂量的 EDU,标记 2 h 后,腹腔注射给予 400 mg/kg 的胸苷嘧啶核苷终止 EDU标记,继续追踪 19 h 可在远端 OFT 处观察到大量EDU 阳性的细胞。
4 结论
本实验优化了EDU脉冲标记追踪 SHF 细胞迁移部署的方法,在对孕鼠和胚胎不产生毒性的前提下,显著提高 EDU 在胚胎中的标记效果以及在 SHF细胞的标记效率,提供了一种有效、方便的追踪SHF 迁移部署的方法。

