布鲁菌L7/L12蛋白的原核表达及多克隆抗体的制备
成 璐,张冬星,吴 娟,李 影
(吉林农业大学动物科学技术学院,吉林长春 130118)
布鲁菌属是一组微小的球杆状革兰阴性菌,宽0.3 μm~0.6 μm,长0.6 μm~1.5 μm,为无芽胞、无鞭毛、不形成荚膜的兼性胞内病原菌,主要感染牛、羊、猪、鹿等哺乳类动物及人[1]。根据宿主易感性不同,有6个经典的种,即羊布鲁菌(Brucellamelitensis)、牛布鲁菌(B.abortus)、猪布鲁菌(B.suis)、绵羊布鲁菌(B.ovis)、犬布鲁菌(B.canis)和沙林鼠布鲁菌(B.neotomae)。此外,从田鼠中分离到了B.microti,从海洋动物鲸和海豚中分别分离到了B.pinnipedialis和B.ceti,从病人乳房植入体中分离到了B.inopinata。其中牛、羊和猪种布鲁菌最为常见,且羊布鲁菌的侵染力与感染力最强,对人的危害也是最大的,其次是猪布鲁菌、牛布鲁菌和犬布鲁菌。绝大多数人感染的布鲁菌病由羊布鲁菌引起[2-3]。
目前,已有多种布鲁菌抗原被证明可以作为潜在的保护性抗原。L7/L12蛋白属于核蛋白,为重要的免疫优势抗原,在布鲁菌各菌株中具有高度的保守性[4]。其中,以L7/L12为基础构建的疫苗可以诱导较强的细胞免疫,在小鼠感染模型中具有显著的抵抗作用[5]。以布鲁菌核糖体蛋白粗提物作为疫苗抗原的研究最早可追溯到20世纪70年代,而重组蛋白L7/L12的提取方法也在不断改进。司瑞等用原核表达载体pGEX-4T-1表达了L7/L12基因,用GSTrap FF亲和层析法获得了布鲁菌重组蛋白L7/L12[6]。梁晓英等用原核表达载体pET-28a(+)构建了重组原核表达质粒pET-28a-L7/L12,使用Ni-NTA亲和层析法获得了布鲁菌重组L7/L12蛋白,且该重组蛋白以包涵体形式表达[7]。
本试验以布鲁菌S2型减毒活疫苗基因组为模板,克隆其L7/L12基因,用原核表达系统表达重组L7/L12蛋白,并制备其多克隆抗体,以期为进一步研究L7/L12蛋白对布鲁菌感染的诊断方法和基因工程疫苗的研发奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与载体 布鲁菌S2型减毒活疫苗,大肠埃希菌Top10、BL21(DE3)感受态细胞,原核表达载体pET-28a(+)由上海市公共卫生临床中心病原细菌感染与免疫课题组保存。
1.1.2 实验动物 SPF级Balb/c小鼠,雌性,6周龄~8周龄,体重20 g左右,购自上海西普尔必凯实验动物有限公司,正常饲养于上海市公共卫生临床中心实验动物部SPF级动物房中。
1.1.3 主要试剂 限制性内切酶BamHⅠ、XhoⅠ和T4 DNA连接酶为NEB公司产品;DNA Marker、PrimerSTAR GXL DNA聚合酶、dNTPs和蛋白质Marker为TaKaRa公司产品;琼胶糖凝胶回收试剂盒和小量细菌质粒DNA抽提试剂盒为Axygent公司产品;HRP标记的羊抗鼠IgG为Abbkine公司产品;化学发光底物为Millpore公司产品;Ni-Bind Resin为GE Amersham公司产品;其他化学试剂均为国产分析纯。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中布鲁菌L7/L12蛋白基因序列 (GenBank number:F362131.1) 设计1对特异性引物,引物序列为:F:5′-GCGGATCCATGGCTGATCTCGCAAAGAT- CG-3′(下划线部分为BamHⅠ酶切位点),R:5′-CCCTCGAGTTACTTGAGTTCAACCTTGGCG- C-3′(下划线部分为XhoⅠ酶切位点),预期扩增的片段大小为375 bp,引物浓度为10 μmoL/L,由苏州金唯智生物科技有限公司合成。
1.2.2 L7/L12基因的扩增及纯化 以S2型减毒活疫苗基因组为模板,F、R为引物,PCR扩增L7/L12基因完整编码区片段,PCR反应体系50 μL:Primer Star DNA酶1.5 μL,5×Primer Star buffer 10 μL,上、下游引物F/R各2.0 μL,DNA模板2.0 μL,dNTPs 4 μL,ddH2O补足体系。PCR反应条件:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,30个循环;72℃延伸7 min。PCR扩增产物用10 g/L 琼脂糖凝胶电泳检测,用DNA胶回收纯化试剂盒纯化回收PCR产物。
1.2.3 重组质粒的构建与鉴定 将L7/L12基因的PCR扩增产物和pET-28a(+)载体分别用BamHⅠ和XhoⅠ双酶切,胶回收L7/L12基因片段和载体酶切产物,按照T4 DNA连接酶使用说明书,于22℃连接1 h。将10 μL连接产物转化至Top 10感受态细胞中,涂布于含50 μg/mL卡那霉素(K+)的LB琼脂平板,37℃培养过夜。阳性克隆经PCR筛选,提取重组质粒,经BamHⅠ和XhoⅠ双酶切鉴定正确后,送至苏州金唯智生物科技有限公司测序。鉴定正确的重组质粒命名为pET-28a-L7/L12。
mxd.replace Workspaces(gdbpath,"FILEGDB_WORKSPACE",newgdbpath,"FILEGDB_WORKSPACE")
1.2.4 重组蛋白的诱导表达 将重组质粒转化至大肠埃希菌BL21(DE3)感受态细胞中,筛选阳性克隆,接种于LB液体培养基(K+),37℃培养过夜。次日菌液按1∶100接种于250 mL LB培养基(K+),37℃、220 r/min摇床培养3 h~4 h至OD600nm值为0.6左右。加入IPTG至终浓度为1.0 mmol/L,37℃诱导3 h,离心收集菌体,超声破碎后分别收集上清和沉淀,进行150 g/L SDS-PAGE分析。
1.2.5 重组蛋白的纯化 将重组表达菌大量培养并进行IPTG诱导表达后,4℃离心收集菌体,菌体沉淀经PBS洗涤2次,用25 mL PBS重悬菌体,在冰浴中进行超声破碎至菌体变清亮,4℃离心收集上清,将上清通过已平衡好的Ni2+NTA His Bind Resin柱,在重力作用下完全通过镍柱后,用含20 mmol/L咪唑的洗涤缓冲液洗脱目的蛋白,再用不同咪唑浓度(40、80、120、160、200、400 mmol/L)的洗脱缓冲液洗柱,收集洗脱的目的蛋白,进行150 g/L SDS-PAGE分析。将纯化的重组蛋白进行透析,并用PEG 8000进行浓缩,SDS-PAGE分析蛋白纯度,BCA法测定蛋白浓度,置-80℃保存。
1.2.6 小鼠多克隆抗体的制备 将纯化的布鲁菌L7/L12蛋白皮下多点注射免疫Balb/c小鼠,免疫用量为25 μg/只,取纯化的重组蛋白rL7/L12与完全弗氏佐剂1∶1乳化后进行首次免疫,空白对照组注射等体积的PBS,14 d后取纯化的重组蛋白与不完全弗氏佐剂等量乳化后进行加强免疫3次,每隔2周加强免疫1次,最后1次免疫后的14 d,眼眶采血,3 000 r/min离心10 min分离血清,置-80℃保存。
1.2.7 小鼠多克隆抗体的效价测定 用间接ELISA方法检测L7/L12蛋白小鼠多克隆抗体效价:以纯化后的L7/L12重组蛋白包被96孔酶标板,2 μg/孔,4℃包被过夜,一抗为不同稀释倍数的L7/L12蛋白小鼠多克隆抗体,PBS组小鼠血清为阴性对照,1∶8 000稀释的HRP标记的羊抗鼠IgG为二抗,用酶标仪检测450 nm处吸光值。判定标准为:以PBS组小鼠血清为阴性对照,高于阴性血清OD450nm值2倍的最高血清稀释度为抗体效价。
1.2.8 多克隆抗体的 Western blot分析 将纯化的重组蛋白经150 g/L SDS-PAGE分离后,将凝胶转移到PVDF膜上,用50 g/L脱脂奶粉室温封闭1 h;加入L7/L12蛋白小鼠多克隆抗体(1∶2 000稀释),4℃ 孵育过夜;用TBST缓冲液洗涤3次,加入HRP标记的羊抗鼠IgG(1∶8 000稀释),37℃孵育1 h;TBST洗涤3次,加入化学发光底物显影,进行Western blot分析。
2 结果
2.1 L7/L12基因扩增产物的鉴定
L7/L12基因的PCR扩增产物经10 g/L琼脂糖凝胶电泳检测,结果显示在375 bp处扩增得到一条特异性条带(图1),与预期大小一致。
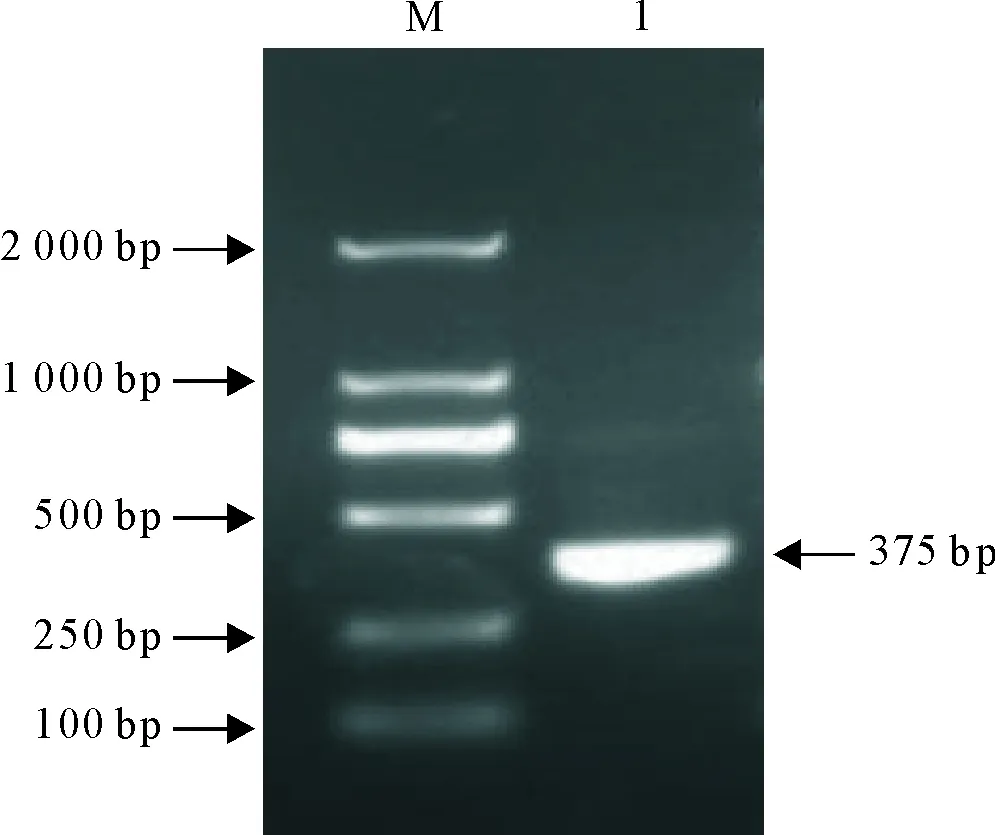
M.DNA标准DL 2 000; 1.L7/L12 基因PCR产物M.DNA Marker DL 2 000; 1.PCR products of L7/L12 gene
2.2 重组表达质粒的鉴定
重组表达质粒pET-28a-L7/L12,经限制性内切酶BamHⅠ和XhoⅠ双酶切后,10g/L琼脂糖凝胶电泳检测,可见大小约5 300 bp(pET-28a(+))和375 bp(L7/L12基因)的2条特异性条带,与预期目的条带大小相符(图2)。测序结果与GenBank中已有的L7/L12基因序列(GenBank number:F362131.1)同源性达到100%,进一步表明重组质粒pET-28a-L7/L12构建成功。
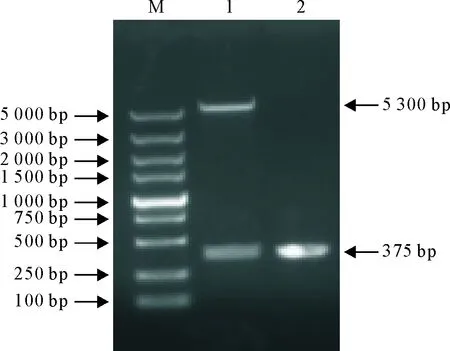
M.DNA标准DL 5 000; 1.pET-28a-L7/L12的BamHⅠ+XhoⅠ双酶切产物; 2.PCR扩增产物;
M.DNA Marker DL 5 000; 1.Products from pET-28a-L7/L12 digested byBamHⅠ andXhoⅠ; 2.PCR product
图2重组表达质粒的PCR及酶切鉴定
Fig.2 PCR and restriction enzyme digestion analysis of the
recombinant plasmid pET-28a-L7/L12
2.3 重组蛋白表达和纯化产物的鉴定
重组菌株经IPTG诱导后收集菌体超声破碎,菌体裂解液经150 g/L SDS-PAGE分析,可见重组L7/L12蛋白在大肠埃希菌中高水平表达,分子质量约为17 ku,且在咪唑浓度为160 mmol/L时rL7/L12蛋白条带单一,蛋白纯度最高(图3)。经BCA法测定,其蛋白浓度为0.715 mg/mL。

M.广谱蛋白标准; 1.pET-28a空载体; 2.未诱导的pET-28a-L7/L12全菌; 3.诱导后pET-28a-L7/L12菌体裂解上清; 4.诱导后pET-28a-L7/L12菌体裂解沉淀; 5.纯化的重组L7/L12蛋白
M.Protein Marker; 1.pET-28a as control; 2.Total protein of pET-28a-L7/L12 without induction; 3.Supernatant of pET-28a-L7/L12 after induction; 4.Precipitate of pET-28a-L7/L12 after induction; 5.Purified rL7/L12 protein
图3重组L7/L12蛋白表达及纯化
Fig.3 Expression and purification of fusion L7/L12 protein
2.4 小鼠多克隆抗体的效价
将纯化的重组L7/L12蛋白免疫组和PBS对照组血清进行1∶1 000稀释,2倍倍比稀释后进行间接ELISA检测,按照阳性血清与阴性血清D450nm值的比值(P/N)大于2的判定标准,L7/L12蛋白小鼠多克隆抗血清效价为1∶128 000,表明重组L7/L12蛋白具有良好的免疫原性(图4)。
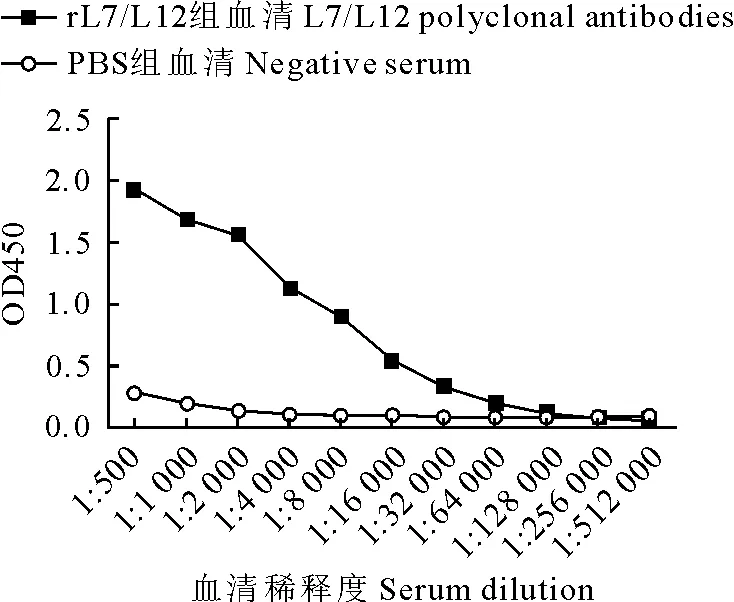
图4 L7/L12蛋白多克隆抗体效价
2.5 多克隆抗体的Western blot分析
Western blot结果表明,本试验制备的小鼠多克隆抗体能与重组L7/L12蛋白发生特异性反应,在大小约17 ku处可见一条特异性杂交条带,且与PBS组小鼠血清反应无特异性条带出现,说明所制备的抗血清具有良好的反应特异性(见图5)。
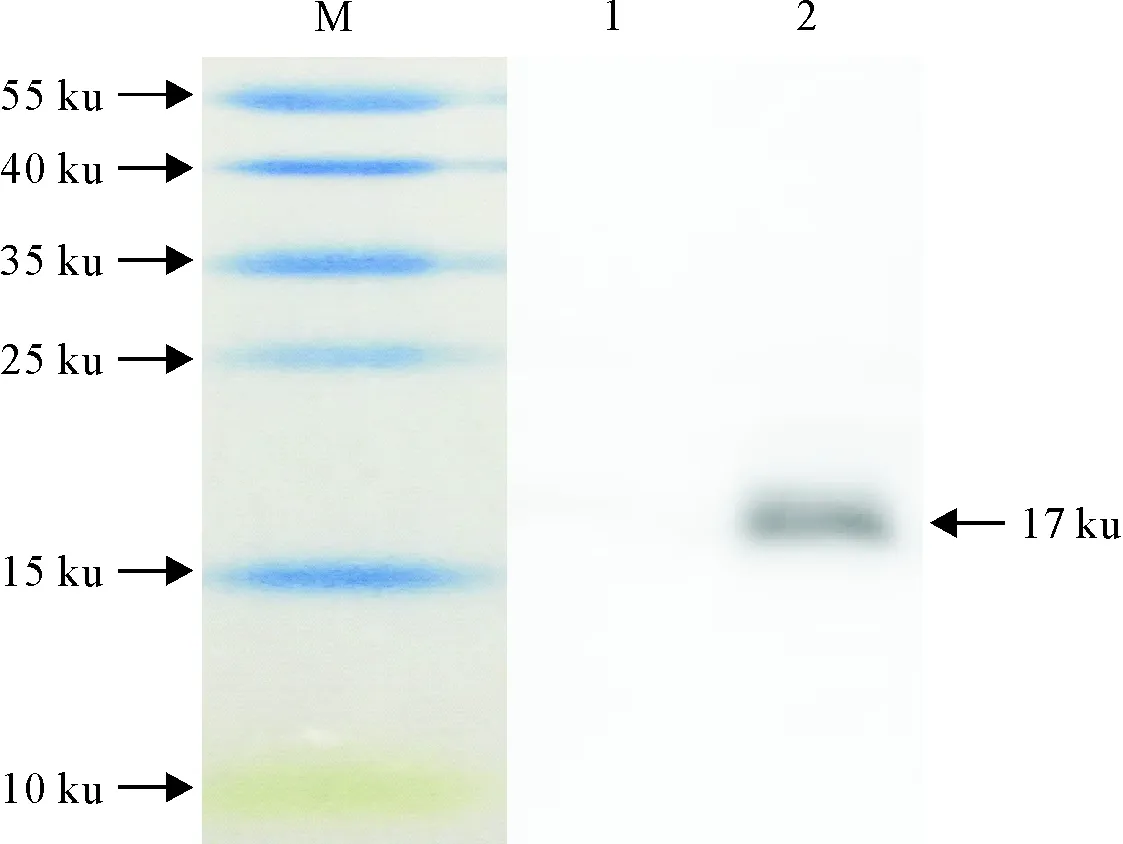
M.预染蛋白标准; 1.PBS组小鼠血清; 2.小鼠抗L7/L12蛋白多克隆抗体
M.Protein Marker; 1.Negative serum; 2.Polyclonal antibody against the L7/L12 protein
图5多克隆抗体的Western blot分析
Fig.5 Western blot analysis of the polyclonal antibody
3 讨论
布鲁菌病最早在欧洲发现。1860年,Morston根据临床特点、尸体剖检结果等进行分析研究,将其认定为临床上一种独立的传染病,命名为“地中海弛张热”[8]。1886年,由David Bruce首次从一个死亡于“马耳他热”的士兵身上分离得到病原菌,后来证明为羊布鲁菌[9]。此间,经过人类不断研究,完善了对该菌的认识。布鲁菌感染家畜和野生动物时,主要引起妊娠母畜流产和公畜不育[10]。此外,该菌也严重威胁着人类的健康,人类感染布鲁菌,可产生许多非特异性表症,如间歇性发热、出汗、寒颤、不适、恶心,还有厌食、头痛、肌痛和背痛[11]。迄今为止,对于人布鲁菌病还没有可用的疫苗,有关疫苗的人体临床试验的相关数据也很少[12]。因此,为了研究安全有效的疫苗,深入了解布鲁菌感染所产生的免疫反应和保护性机制是必不可少的。当前研究表明,布鲁菌感染后,机体可产生细胞免疫反应和体液免疫反应,主要通过诱导CD4+和CD8+T淋巴细胞反应或促炎性细胞因子,活化巨噬细胞和树突状细胞(DCs),从而增强机体的细胞免疫反应[13]。
L7/L12蛋白以4个拷贝形式存在于核糖体亚单位中,C端具有与EF-G和EF-Tu相结合的延伸因子,N端的二聚体与L10的核糖体蛋白结合,这种结构有利于在GTP水解过程中获取能量。研究发现,布鲁菌L7/L12蛋白能够特异性刺激感染动物的单核细胞,上调IFN-γ的转录和表达,从而对机体起到保护作用[14]。Oliveira J等[15]用原核表达载体构建了L7/L12-BMP融合蛋白,腹腔注射免疫小鼠,免疫3次后以B.abortus攻毒,发现其保护效率可达到S19疫苗的一半。Mallick等将L7/L12核糖体蛋白进行脂化形成一种牛布鲁菌B-T细胞抗原,结果证明重组L7/L12蛋白的脂质体形式大大提高了重组蛋白的免疫原性,能够诱导更强的体液免疫和细胞免疫反应,且其攻毒保护效果也明显增加[16]。Singh D等[17]用PLGA(85∶15)纳米粒在小鼠体内递呈rLl7/L12,结果表明用这种纳米载体可以抗B.abortus544感染,可替代传统蛋白佐剂。Luo D等[18]研制了能同时表达布鲁菌L7/L12蛋白和Omp16蛋白的二价DNA疫苗,该二价疫苗能够刺激T淋巴细胞的大量增殖与IFN-γ产生,诱导更强的体液免疫和细胞免疫反应,且其保护水平明显高于单个抗原。Tabynov K等[19]首次构建了以流感病毒为载体编码布鲁菌L7/L12蛋白的疫苗,该载体疫苗可以提供与商品化疫苗B.abortusS19和B.abortusRB51相当的保护效果。Du Z Q等[20]以布鲁菌rL7/L12-BLS免疫家兔检测其免疫原性,结果表明该融合蛋白可诱导高水平的IgG,且rL7/L12-BLS组和rL7/L12组IFN-γ含量显著上调。因此,L7/L12作为一种优秀的T细胞免疫优势抗原,可作为潜在的布鲁菌疫苗候选分子。
本试验用pET-28a原核表达载体高效表达了布鲁菌L7/L12重组蛋白,通过Ni-NTA亲和层析法获得了高纯度的布鲁菌重组L7/L12蛋白。SDS-PAGE分析表明布鲁菌L7/L12蛋白未经IPTG诱导也可大量表达,且存在可溶和包涵体两种形式,为蛋白的进一步纯化和性质鉴定提供了基础材料。Western blot分析显示,该重组蛋白能与布鲁菌rL7/L12免疫小鼠血清发生特异性反应,说明L7/L12的结构在大肠埃希菌中得到了正确折叠,其免疫学活性没有受到影响,且特异性强。间接ELISA也证明了布鲁菌L7/L12蛋白具有良好的抗原性,是一种重要的布鲁菌诊断抗原和疫苗后选分子。综上所述,本研究成功制备了纯化的重组L7/L12蛋白和小鼠抗L7/L12蛋白多克隆抗体,为下一步比较布鲁菌DNA疫苗和重组蛋白亚单位疫苗的免疫效果提供了材料,为进一步研究L7/L12蛋白对布鲁菌感染的诊断方法和基因工程疫苗的研发奠定了基础。

