338例胰腺癌诊治分析
毕淑龙 葛春林
胰腺癌是一种症状隐匿、早期诊治困难、恶性程度高、预后极差的消化系统恶性肿瘤。美国胰腺癌新发病例数男性列第11位,女性列第10位,居恶性肿瘤死亡率第4位[1],5年生存率不到6%[2]。在我国,胰腺癌发病率呈快速上升趋势,居恶性肿瘤死亡率的第5位[3],中位生存期只有6个月[4]。为了进一步提高对胰腺癌疾病的认识,改善胰腺癌病人预后,特对中国医科大学附属第一医院收治的338例胰腺癌病人的临床资料作回顾性分析。
资料与方法
一、研究对象
回顾性收集中国医科大学附属第一医院普外科2011年1月至2018年1月收治胰腺癌病人338例(病例资料完整),其中男性213例,女性125例,年龄(59.07±10.44)岁,年龄范围为28~80岁。肿瘤位于胰头部178例,胰颈部36例,胰体尾部120例,全胰癌4例。按病人就诊时的主要症状分类:腹痛122例,黄疸178例,腹胀伴腰背酸胀125例,腹部包块14例,恶心呕吐59例,体检发现31例。多数病人伴有乏力、消瘦症状。
二、观察指标
包括病人性别、年龄、吸烟、肥胖、既往史(慢性胰腺炎、糖尿病)、家族史;首发症状;肿瘤标志物水平,辅助检查结果;临床诊治经过(手术、化疗、放疗等),计算病人生存率,统计影响胰腺癌预后的单因素和多因素分析等。
三、随访方法
对病人进行电话随访,术后1年内及未手术病人每3个月随访一次,术后1年以上每3~6个月随访一次,了解病人预后情况,记录生存时间(手术时间至末次随访时间、死亡时间或随访数据截止时间)。
四、统计学方法
采用SPSS(17.0版)统计学软件包进行分析。采用Kaplan-Meier法和寿命表法计算生存率,采用Log-rank检验做组间比较、分析影响病人预后的因素,用Cox风险模型进行多因素预后分析。P<0.05为差异有统计学意义。
结 果
一、不同影像学检查及肿瘤标志物阳性率比较
338例病人采用不同的影像学检查明确诊断及判断胰腺外受累情况,结果见表1,肿瘤标志物包括癌抗原(CA)19-9、癌胚抗原(CEA)、甲胎蛋白(AFP)、CA72-4、CA125、CA15-3,具体结果见表2。
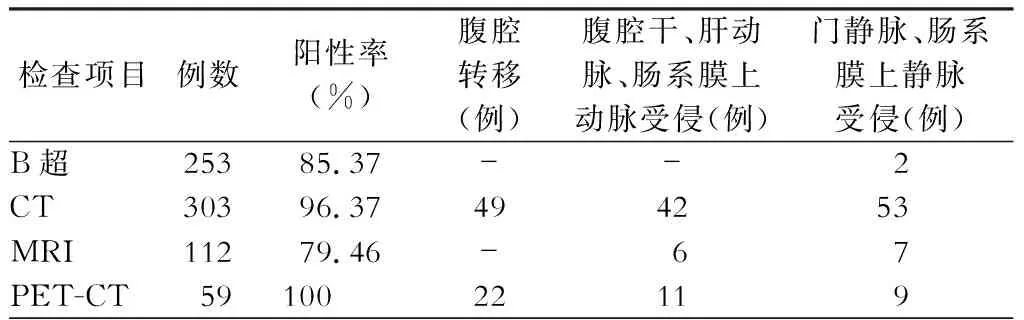
表1 不同影像学检查阳性率及胰腺外受累比较
二、胰腺癌治疗方式及并发症情况
在多学科诊治(MDT)模式下,充分结合病人年龄、一般状况、临床症状、合并症、既往史、辅助检查,得出诊断与相关鉴别诊断,评估病人能否进行手术以及病灶能否切除。
338例胰腺癌病人行手术治疗229例,其中行胰十二指肠切除术79例、行胆肠、胃肠吻合术(旁路手术)41例、行胰腺次全切除术6例,胰体尾脾切除术103例;病人术后出现胰瘘者22例,术后出血者5例。未进行手术治疗109例,部分病人因肿瘤无法切除或伴有远处转移,选择行减黄治疗。于介入科行经超声或CT引导下经皮经肝胆管穿刺引流(PTCD)或胆道支架植入术。未进行手术治疗病人中经MDT讨论病灶不可切除53例、伴有远处脏器转移或重要血管受侵及37例、因高龄、心肺功能差等原因放弃手术治疗19例。
行放化疗病人共122例,其中未进行手术直接进行化疗的有32例,术后进行化疗的有69例,化疗以吉西他滨为主,行放疗的病人共21例。针对肿瘤晚期疼痛,于疼痛科行内脏神经损毁术者34例。
三、不同治疗方式生存率比较
338例胰腺癌病人,共获得随访资料263例。随访时间3~48个月,生存1~48个月,平均生存期10.68个月。病人3个月、6个月、12个月、18个月、24个月、30个月、36个月、42个月、48个月总体生存率分别为73.26%、57.19%、36.42%、19.34%、17.21%、13.29%、9.37%、8.22%、6.31%。获得随访的263例病人,其中根治性手术153例、旁路手术30例、未做手术80例,分别计算了生存率,具体结果见图1~图4。
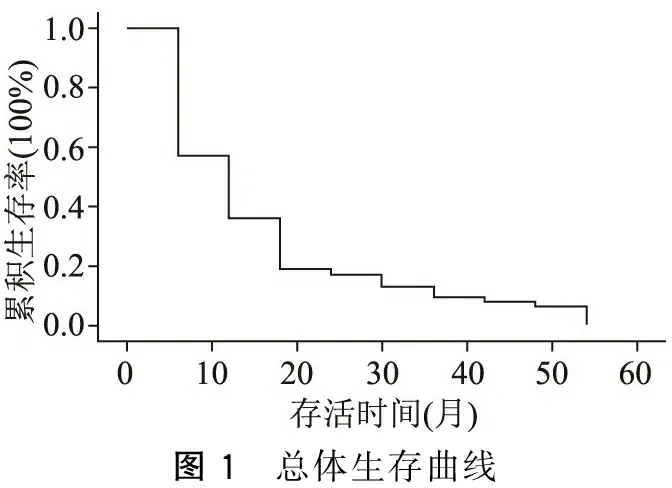
图1 总体生存曲线

表2 肿瘤标志物阳性率比较
注:括号内为各标志物的参考值

图2 根治手术病人生存曲线

图3 旁路手术病人生存曲线
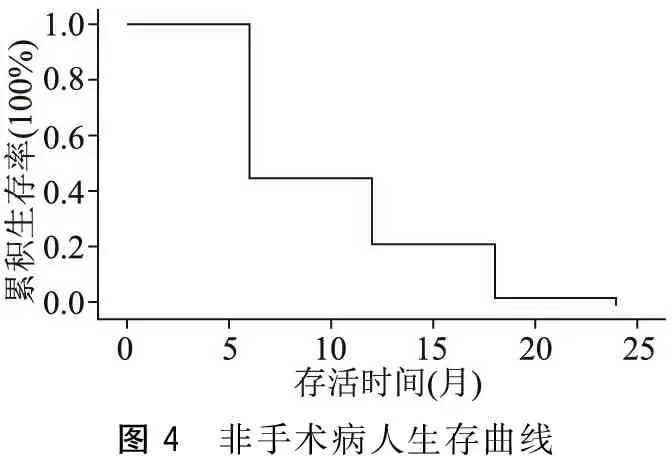
图4 非手术病人生存曲线
四、影响病人预后单因素分析
263例随访病人,分别按照年龄、血清CA19-9检测值、肿瘤TNM分期、治疗方式等分组。本组病例的生存时间与CA19-9水平、肿瘤TNM分期、肿瘤部位、是否伴有脏器转移及治疗方式等因素有关(P<0.05),具体结果见图5及表3。

表3 胰腺癌病人预后影响因素的单因素分析
五、影响病人预后多因素分析
经过统计学分析,CA19-9水平、TNM分期、肿瘤部位、手术方式、肝转移在多因素分析后的结果比较差异有统计学意义(P<0.05),结果见表4。

表4 胰腺癌病人预后影响因素的多因素分析
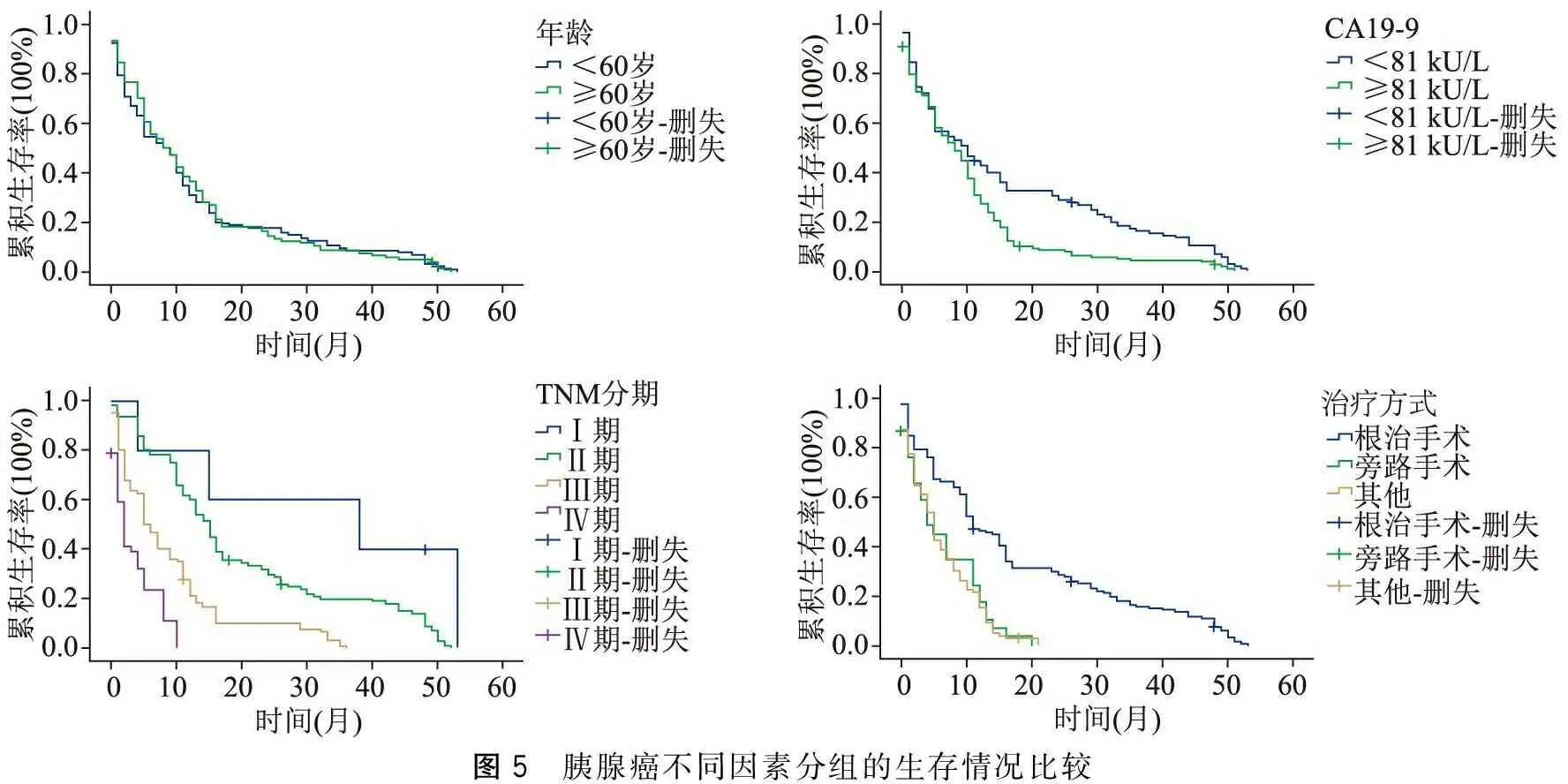
图5 胰腺癌不同因素分组的生存情况比较
讨 论
胰腺癌早期诊治困难、恶性程度高、发展快、病死率高。胰腺癌临床上多以腹痛、腹胀伴腰背部不适、恶心、消瘦或出现黄疸为主要症状,临床症状不典型,不易与其他消化道疾病相鉴别。因此发现较晚,在本文病例中,当发现时已无法切除的病例有90例。因此在临床工作中,要时刻对这些非特异性症状提高警惕,对中老年人、伴有糖尿病、慢性胰腺炎或有吸烟史、家族史的病人,应当尽早进行胰腺癌筛查,以免发生漏诊。
胰腺癌早期筛查可首选肝胆脾胰超声检查,其检查方便、无创、快捷。但是由于胰腺特殊的解剖位置,当胃肠道内气体较多时,易受干扰看不清。另外超声检查很大程度上取决于操作者的技术水平,误差相对较大。本组病例中肝胆脾胰超声对胰腺肿瘤的检出率可达85.37%。
目前CT仍是胰腺癌术前诊断和评估最常用的首选影像学检查方法[5]。腹部增强CT以无创、分辨率高和重复检查性好为特点[6],可以清楚地显示肿瘤大小、形态、范围、边界以及与周围重要脏器、血管的关系[7]。本文病例中行CT检查病人303例,对胰腺肿瘤检出率达96.37%。随着影像技术的发展,通过三维重建技术可以合成3D-CT,对术前评估肿物可切除性有较大价值[8,11]。MRI临床应用也在逐步增加[9]。PET-CT在发现胰腺外转移,评价全身肿瘤负荷方面具有明显优势[10]。
CA19-9是目前最常用的胰腺癌肿瘤标志物,阳性率85%~95%。监测CA19-9有助于胰腺癌的病情监测及预后判断[12]。有的研究显示CA19-9高低与胰腺癌预后呈正相关,CA19-9水平越高、胰腺癌预后越差,而CA19-9相对低者,预后相对较好[13-14]。本文病例中将CA19-9≥81 kU/L和CA19-9<81 kU/L分成2组比较生存率,CA19-9水平较高相对生存率偏低。但是CA19-9在慢性胰腺炎、胆道系统梗阻等疾病中也能升高,当发现CA19-9升高而且能排除胆道梗阻或胆道系统感染等相关因素后则高度怀疑胰腺癌[13],临床中需结合影像学资料进行判断。
根治性手术切除仍是目前治疗胰腺癌最有效的方法[15]。术前积极开展MDT讨论,依据影像学检查将胰腺癌分为[16]:①可切除胰腺癌;②交界可切除胰腺癌;③局部进展期胰腺癌;④合并远处转移胰腺癌。针对可切除胰腺癌选择根治性胰十二指肠切除术或根治性胰体尾脾切除术或全胰腺切除[9]。针对交界可切除胰腺癌新辅助治疗是首选的治疗方式,一项美国研究结果显示术前新辅助治疗可以使潜在可切除胰腺癌病人生存获益,为胰腺癌新辅助治疗提供依据[18]。针对局部进展期胰腺癌或合并远处转移胰腺癌可以选择胆道支架或胃空肠吻合术、胆囊/胆管空肠吻合术,同时探查过程中应当尽量取得病理学诊断证据[17,19]。本文病例中手术治疗(包括根治性切除、姑息手术)的病人总体生存率高于未做手术病人。
胰腺癌只要有病理学诊断依据均应当进行化疗,辅助化疗以吉西他滨或氟尿嘧啶、替吉奥为主的单药治疗,辅助化疗起始时间应尽可能控制在术后8周内[20],疗程在6个疗程以上[21]。放射治疗是一种局部姑息治疗,放疗必须与化疗相结合。
胰腺癌病人预后受到许多因素的影响,如性别、年龄、CA19-9水平、肿瘤大小、部位、分期、伴有转移、神经血管侵犯、治疗方式等。通过回顾分析本病例资料,年龄的差异无统计学意义,CA19-9水平、TNM分期、伴有转移及治疗方式是影响其预后的独立危险因素。
胰腺癌预后差、生存率低,早发现、早诊断、早治疗是提高胰腺癌预后的重要方法。针对临床怀疑有胰腺癌病人,应当行腹部CT和肿瘤标志物检测(如CA19-9)等检查以尽早明确诊断。手术治疗仍是提高胰腺癌生存率的主要方法,针对中晚期胰腺癌或不耐受手术治疗病人,可考虑抗肿瘤综合治疗,如介入、化疗、放疗等方法来提高生存质量、延长生存期。

