2016年-2017年吉安市乙型流感病毒基因特性分析
刘丽 ,孙爱猛 ,罗青 ,朱端昊 ,李健雄 ,施勇 ,周信云 ,冯萍英 ,罗滢娟
(1、吉安市疾病预防控制中心,江西 吉安 343000;2、江西省疾病预防控制中心,江西 南昌 330029)
乙型流感病毒是引起人流行性感冒的重要病原,致病性较强,人普遍易感,只在人间传播,常呈暴发或小流行。其在世界范围内多个国家都有过流行,我国在1994年、1997年、和2000年出现乙流高峰,2005年呈引起小规模暴发[1],近年来我市监测的流感样病例阳性标本中,乙型流感病毒占居较大比例,2016年为我市优势型别,且在2016年3月及2017年12月均出现过乙型流感病毒引起的局部流行。流感病毒的抗原漂移性强,易发生变异,及时正确掌握流感流行及变异趋势,对预防和控制流感大流行具有重要的作用。本文通过对吉安市2016年-2017年分离到的乙型流感病毒的HA(血凝素)和NA(神经氨酸酶)进行基因测序,分析其系统进化及分子变异特征,了解乙型流感病毒的基因特点,为吉安市流感流行的防控工作提供一定的科学依据。
1 材料与方法
1.1 样本选择我市2016年-2017年不同时间段的流感样病例监测及疑似流感疫情咽拭标本中分离到的乙型流感病毒,进行基因扩增和测序。
1.2 病毒RNA提取采用德国QIAGEN公司的RNeasy Mini Kit对选取的乙型流感病毒毒株进行病毒RNA提取,具体步骤参考试剂说明书。
1.3 引物 基因测序引物序列参考WHO[2],由上海生工生物工程技术服务有限公司合成。
1.4 基因RT-PCR扩增 扩增采用Qiagen One Step RT-PCR Kit试剂盒进行RT-PCR反应,RT反 应 条 件 :60℃ ,1min;42℃ ,10min;50℃ ,30mm;95℃,15min,PCR 循 环 条 件 :94℃,30s;55℃,30s;72℃,2min,循环 35 次,72℃ 10min。
1.5 核苷酸序列测定PCR产物送上海生工生物工程技术服务有限公司进行双向测定。
1.6 序列分析采用DNAStar5.0、Mage6.0软件对测序结果进行拼接及分析。从Influenza Sequence Database中下载B/Brisbane/60/2008(2016年-2018年度疫苗株,Victoria 系,CY115151,CY115153),B/Phuket/3073/2013(2016年-2018年度疫苗株,Yamagata 系,EPI544264,EPI544263)HA 和 NA 基因序列作为参比序列进行分析。
2 结果
2.1 2016年-2017年吉安市乙型流感基因亚型分布2016年-2017年吉安市流感监测样本中乙型流感占一定比例,2016年乙型流感病毒的阳性率超过甲型流感,占 51.3%;2017年有所降低,占29.6%;病毒培养结果显示本市2016年乙型流感病毒主要为Bv系,占乙型流感病毒培养阳性总数的89.2%,2017年主要为BY系,占该年乙型流感病毒培养阳性总数的71.7%。
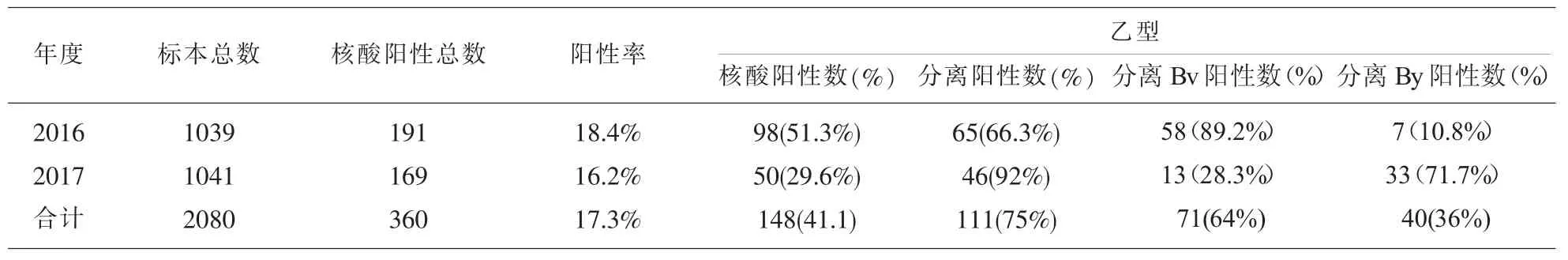
表1 2016年-2017年吉安市乙型流感病毒核酸检测及病毒分离情况
2.2 乙型流感病毒序列测定 选取乙型流感病毒2016年的毒株11株 (6株Victoria系,5株Yamagata系),2017年的毒株 4株(2株 Victoria系,2株Yamagata系)进行HA和NA基因。15株病毒的HA、NA基因扩增产物经纯化、双向测序、序列拼接后,Victoria系B型流感病毒获得1758bp HA基因序列和1401bp NA基因序列,Yamagata系B型流感病毒获得1401bp HA基因序列和1041bp NA基因序列,所有毒株序列均未发现核苷酸的丢失和插入。
2.3 HA基因特征分析
2.3.1 核苷酸同源性 8株 Victoria系 B型毒株HA 基因之间的同源性为 99.3%~99.9%,7株 Yamagata系乙型毒株HA基因之间的同源性为98.8%~99.8%。 HA 基因核苷酸进化树(见图 1)上显示,8株Victoria系B型毒株HA基因均为同一分支,且与疫苗株B/Brisbane/60/2008处于同一分支,同源性为 98.7%~99.0%。7株 Yamagata系 B 型毒株 HA基因均为同一分支,与疫苗株B/Phuket/3073/2013处于同一分支,同源性为 99.1%~99.5%。

图1 HA基因进化树
2.3.2 与WHO推荐疫苗株在HA1区域氨基酸序列的比较 2016年-2018年 WHO北半球 B型Victoria系流感疫苗推荐株为B/Brisbane/60/2008,本研究的8株Victoria系毒株HA1氨基酸变异较小,与其的差异数为2~3个,分别有1株毒株发生172P>S、189T>A 变异,7 株毒株发生 117I>V 变异、并且全部发生了129N>D变异,其中117位和129位均位于抗原决定簇上。
与乙型Yamagata系流感疫苗推荐株B/Phuket/3073/2013相比,本研究的7株Victoria系毒株HA1氨基酸变异较小,与其的差异数为1-4个 , 分 别 为 56D>N、137L>I、150I>V、172L >Q、196D>N、211K>R、251M>V、278R>K, 其中 8 株毒株均在172、251、278位发生了变异。137位和150位位于抗原决定簇上,且该处变异发生于同一毒株(B/JiangxiJizhou/1306/2016)。
2.4 NA 基因特征分析
2.4.1 核苷酸同源性 8株Victoria系乙型毒株NA基因之间的同源性为 99%~99.8%,7株Yamagata系乙型毒株 NA基因之间的同源性为 98.3%~99.9%。NA基因核苷酸进化树(见图2)上显示,8株Victoria系乙型毒株NA基因均为同一分支,且与疫苗株B/Brisbane/60/2008处于同一分支,同源性为 98.7%~99.1%。7 株 Yamagata系乙型毒株 HA基因均为同一分支,与疫苗株B/Phuket/3073/2013处于同一分支,同源性为99%~99.6%。

图2 NA基因进化树
2.4.2 NA基因耐药性位点分析 与乙型流感病毒神经氨酸酶抑制剂敏感株B/JiangxiJizhou/1306/2016相比,本研究的15株毒株NA基因酶催化活性位点 (R-116、D-149、R-150、R-223、E-275、R-292、R-374 和 P-406)氨基酸和辅助位点(E-117、R-154、W-177、S-178、D-197、I-221、E-226、H-273、E-276和 N-294,E-428 位) 氨基酸均未发生替 换 。 对 E105、G108、G141、N144、S249、T325、R374、G407等其他位点进行分析,均未发生氨基酸替换。
3 讨论
乙型流感病毒1940年在美国的一次流感中首次被检出,为单股负链分节段带包膜的RNA病毒[3],1983年以来根据其基因特征和抗原性的不同分成两大谱系,分别为Yamagata系和Victoria系[4]。2016年-2017年我市监测流感样病例阳性标本中,乙型流感病毒占居较大比例,且2016年为我市优势病毒株,2016年-2017年吉安市B型流感病毒分离情况表明,我市人群中流行的乙型流感毒株中 2016年以 Victoria系为优势,2017年以Yamagata系为优势。
乙型流感病毒在复制过程中易发生基因变异,通过抗原漂移和抗原转变方式引起抗原性改变,乙型流感病毒基因组分8个节段编码11种蛋白,其中RNA4与RNA6分别编码血凝素(HA)及神经氨酸酶(NA),血凝素(HA)变异最大,乙型流感病毒和甲型一样都是依靠病毒外膜蛋白,尤其是血凝素的重链HA1的变异,改变抗原特性,逃避抗体已有的免疫保护,导致流感流行[5-8]。目前,已知的B型流感病毒HA1蛋白分子的抗原决定簇主要包括了4个区域,分别是:120环 (116~137)、150 环 (141~150)、160 环 (162~170) 和 190 螺旋(197~205),其中 Victoria系的120环还包括了 75和77两个位点[9],这些位点氨基酸的改变,会引起病毒抗原性发生改变[10]。本研究的8株Victoria系流感毒株与疫苗株相比在120环上发生了两处变异,提示我市2016年-2017年Victoria系可能发生了抗原性的改变,有可能会导致疫苗的保护作用减弱,从而导致流感的流行,这与我市2016年Victoria系流行可能存在一定的关系。但一般认为,一个具有流行病学意义的新变种必须具备,在其血凝素重链(HA1)区蛋白分子上,至少有4个以上氨基酸发生了替换,而且这4个替换必须分布在两个以上抗原决定簇区[11]。
神经氨酸酶抑制剂(NAIs)为乙型流感的特效治疗药物,其药物靶点为神经氨酸酶,因为它不仅在病毒传播中发挥重要的抑制作用,而且其酶催化活性位点氨基酸以及周围的辅助氨基酸非常保守。流感病毒神经氨酸酶的8个氨基酸(R-116、D-149、R-150、R-223、E-275、R-292、R-374 和 P-406)作为酶催化活性位点直接作用底物或者作为维持功能的重要因素,而其他11个氨基酸(E-117、R-154、W-177、S-178、D-197、I-221、E-226、H-273、E-276 和 N-294,E-428 位) 作为辅助位点[12]。NA抑制剂作用于酶催化活性位点或辅助位点[13],可以有效地阻断流感病毒感染、复制和传播的过程。目前美国FDA批准的NAIs有Oseltamivir和Zanamivir,我国2002年批准了Oseltamivir在我国注册,然而随着NAIs的临床使用,耐药株将不可避免的出现。许多研究人员从临床研究中发现分离自NAIs治疗的病人标本的流感病毒出现耐药位点的突变[14,15],这些研究都提示B型流感NA的耐药位点的多样性和耐药病毒株越来越多的涌现。
本次研究并未发现我市乙型流感毒株HA基因抗原性发生较大的变异和NA基因耐药位点的变异,但是乙型流感病毒抗原性和耐药性监测应予以长期、持续的加强,以期及时在监测中发现有意义的变异,为本市流感的预防和控制提供技术支持。

