CYP2C19基因多态性对冠心病PCI术后氯吡格雷抵抗的影响及替代治疗方案的比较
郭亚娜,蒋翠霞,杜金红,王静珠,齐林
(郑州市第七人民医院,河南 郑州 450006)
冠心病是我国常见的心血管疾病,长期位于危害我国健康疾病的第一位。经皮冠状动脉介入(PCI)是目前临床冠心病治疗的重要手段,其中氯吡格雷是术后常用的抑制血小板聚集的药物。研究[1]发现,部分患者存在氯吡格雷抵抗,从而增加心血管不良事件的发生率。国外的研究[2]提示,替格瑞洛的疗效明显优于氯吡格雷,但我国的临床研究较单一,资料参考价值不高。
此外,研究[3]提示氯吡格雷的抗血小板作用与CYP2C19酶关系密切,可抑制ADP受体形成依赖性的血小板糖蛋白,进而抑制血小板聚集现象的出现,并提示CYP2C19酶可能与CYP2C19基因多态性具有密切相关性。因此,本研究探讨了CYP2C19基因多态性对冠心病PCI术后氯吡格雷抵抗的影响及替代治疗方案的选择。
1 资料与方法
1.1 一般资料 选取2016年4月至2017年4月在我院治疗的冠心病患者90例,其中心肌梗死30例,不稳定型心绞痛32例,稳定型心绞痛28例;其中男性58例,女性32例;年龄51~72岁,平均年龄(62.10±5.22)岁。 纳入标准:①均经冠脉造影确诊;②在我院行PCI治疗;③患者及家属知情同意。排除标准:①合并有严重心力衰竭、恶性肿瘤、肝肾功能衰竭等;②有心脏瓣膜病、心肌病、心肌炎等其他心脏疾病。
1.2 治疗方法 氯吡格雷双倍剂量组:患者术后3d晨起服用氯吡格雷150mg/d,1个月后减量为75mg/d;替格瑞洛组:患者术后3d晨起服用替格瑞洛,90mg/d,每日分2次服用,所有患者均持续治疗12个月。
1.3 CYP2C19基因型检测方法 取患者空腹静脉血4ml置于含乙二胺四乙酸(EDTA)的抗凝EP管中,血液标本由北京协和医学院药学研究室进行DNA分离、纯化及PCR扩增-扩增产物杂交实验等相关操作,引物的序列分别为CYP2C19*2:正义链 5′-GCAGGTATAAGTCTAGGAAATG-3′,反义链5′-TAAAGTCCCGAGGGTTGTTG -3′,CYP2C19*3正义链:5′-AAATTGTTTCCAATCATTTAGCT-3′,反义链:5′-ACTTCAGGGCTTGGTCAATA-3′。PCR反应总体积 25μl, 反应条件为:94℃变性 5min,94℃变性 30s,57℃退火 30s,72℃延长 45s,循环 35次,72℃再延伸 5min,CYP2C19*2 和 CYP2C19*3目的片段长度分别为381bp和27lbp。CYP2C19试剂盒(南京建成生物研究所)分析PCR代谢产物并进行基因型的判定[4,5]。
1.3 氯吡格雷抵抗检查方法 散射比浊法检测血小板最大聚集率 (MAR)≥55%定义为氯吡格雷抵抗(CR),MAR<55%定义为氯吡格雷非抵抗(NCR)[6]。
1.4 统计学处理 采用SPSS 19.0统计软件进行统计分析,计量资料采用(±s)表示,两组间比较使用t检验,计数资料比较采用χ2检验或Fisher精确检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 基因检查结果 90例患者基因检查结果显示:CYP2C19*1/*1患者28例,CYP2C19*1/*2患者48例,CYP2C19*2/*2患者8例,CYP2C19*2/*3患者6例。根据基因结果将患者分为野生型组(CYP2C19*1/*1) 和非野生型组(CYP2C19*1/*2、*2/*2、*2/*3),两组患者性别、年龄等一般资料比较差异无统计学意义(P>0.05),见表 1。
2.2 野生型组和非野生型组氯吡格雷抵抗发生比较 野生型组氯吡格雷抵抗发生比例明显低于非野生型组,两组比较差异有统计学意义(P<0.05),见表2。
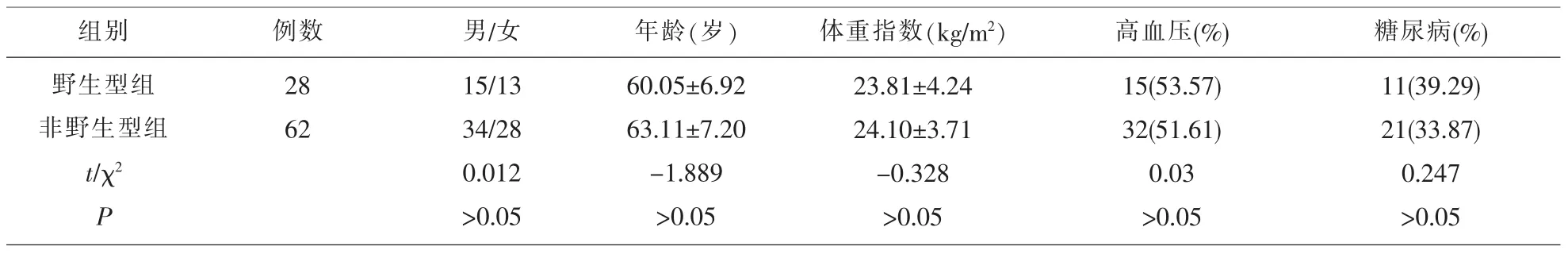
表1 两组患者一般资料比较

表2 野生型组和非野生型组氯吡格雷抵抗发生率比较
2.3 不同治疗方案氯吡格雷抵抗患者术后12个月血小板抑制率比较 采用随机数字表法,将47例氯吡格雷抵抗患者随机分为氯吡格雷双倍剂量组(n=25),其中男性 14 例,女性 11 例;年龄 51~70,岁,平均(61.93±9.20)岁;体重指数 23.10~24.89kg/m2,平均(24.05±5.10)kg/m2。 替格瑞洛组(n=22),其中男性13例,女性9例;年龄51~69岁,平均(62.01±8.71)岁;体重指数 23.02~25.01kg/m2,平均(23.81±6.20)kg/m2。 替格瑞洛组术后 12 个月血小板抑制率为(55.03±9.10)%,明显高于氯吡格雷双倍剂量组(P<0.05),见表 3。
2.4 不同治疗方案氯吡格雷抵抗患者术后12个月不良心血管事件比较 替格瑞洛组术后12个月未发生不良心血管事件,氯吡格雷双倍剂量组发生不良心血管事件6例(支架内再狭窄1例,非致死性心肌梗死3例,不稳定心绞痛2例),两组不良心血管事件发生率比较差异有统计学意义 (P<0.05),见表 3。
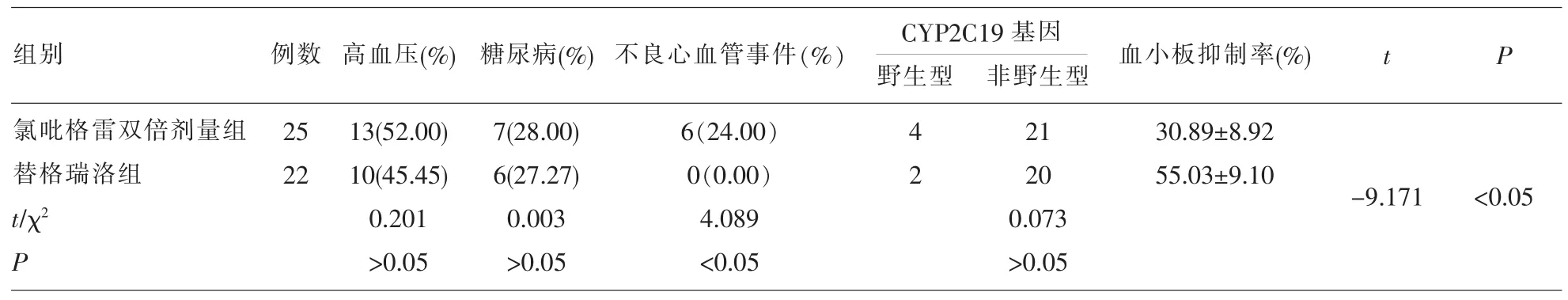
表3 不同治疗方案氯吡格雷抵抗患者一般资料及术后12个月血小板抑制率比较
3 讨论
冠心病术后抗血小板治疗是保证PCI手术效果的重要因素,其中氯吡格雷作为最常用的抗血小板治疗药物已在临床应用多年。但最新的研究[7]提示,使用氯吡格雷约5%的患者存在氯吡格雷抵抗。氯吡格雷本身并无抗血小板聚集的作用,需通过CYP系统降解成硫醇衍生物才可发挥抗血小板作用[8]。CYP2C19酶是氯吡格雷的重要代谢酶,相关研究[9,10]均提示CYP2C19基因多态性可能与氯吡格雷的抗血小板作用具有密切联系,但相关研究较少。CYP2C19的基因突变位点可分为CYP2C19*2、*3、*4、*5、*17,而 CYP2C19*2 是具有最高突变频率的位点,亦是最为常见的失功能等位基因,其外显子5第681位碱基由鸟嘌呤可突变为腺嘌呤,提前终止密码子产生时间进而终止合成蛋白质,降低CYP2C19酶活性,甚至使其失效,降低了氯吡格雷活性代谢产物阻断血小板ADP受体的概率,进而无法发挥抗血小板聚集的作用[11-13]。 本研究结果显示,90例患者中,CYP2C19*1/*1患者28例,CYP2C19*1/*2患者48例,CYP2C19*2/*2患者 8例,CYP2C19*2/*3患者6例。上述结果提示,CYP2C19基因多态性与冠心病PCI术后氯吡格雷抵抗有关,其中CYP2C19*2是具有最高突变频率的位点。非野生型CYP2C19*1/*2、*2/*2、*2/*3 冠心病 PCI术后氯吡格雷抵抗较高,术后临床可进行个体化给药以保证术后的抗凝效果。
目前,临床为减轻对氯吡格雷反应性差或无反应及缺血事件的发生率,主要使用以下两种方案:①增加氯吡格雷剂量;②换用替格瑞洛等新型受体拮抗剂。研究[14]提示PCI术后增加氯吡格雷剂量能够加强血小板抑制作用,进而改善氯吡格雷抵抗,但仍存在争议。我国替格瑞洛的使用时间较短,其临床效果和不良反应还需要进一步评估研究[15]。本研究结果显示,替格瑞洛组术后12个月血小板抑制率明显高于氯吡格雷双倍剂量组;替格瑞洛组术后12个月不良心血管事件发生率为0,明显低于氯吡格雷双倍剂量组的24.00%。上述结果提示,替格瑞洛对氯吡格雷抵抗患者有较好的效果,安全性较高。替格瑞洛属于ADP受体拮抗剂,能够可逆性地结合ADP受体进而发挥抗凝血作用。此外,由于替格瑞洛不是前体药物,无需经肝脏代谢激活即可直接起效,不受基因多态性影响,因此血小板抑制率较高,临床效果更好。
综上所述,CYP2C19基因多态性与冠心病PCI术后氯吡格雷抵抗有关;氯吡格雷抵抗患者应用替格瑞洛具有较好的效果。

