慢性肾病患者检测SDF-1、P-糖蛋白及8-iso-PGF2α水平的临床意义分析
马凤莲,崔丹,刘卫永
(郑州市第七人民医院,河南 郑州 450016)
慢性肾病具有“三高”、“三低”特征,即发病率高、病死率高、心血管并发症发生率高,以及民众对疾病知晓率低、防治率低、心血管并发症知晓率低[1,2]。流行性病学调查表明,我国40岁以上人群慢性肾病发病率高达10%以上,但对疾病的知晓率仅为5%左右[3]。随着饮食习惯的改变,我国慢性肾病发病率呈逐年增高趋势,严重影响国民健康[4]。 基质细胞衍生因子-1(SDF-1)是趋化家族成员之一,对淋巴细胞趋化作用具有重要意义,同时还参与着造血、血管发生、免疫等多个生理过程。P-糖蛋白是细胞保护分子泵。8-异前列腺素F2α(8-iso-PGF2α)是新发现的一种异前列腺素代谢产物,是机体氧化反应的理想评估指标[5,6]。本研究即探讨慢性肾病患者检测 SDF-1、P-糖蛋白、8-iso-PGF2α的临床意义,现报告如下。
1 资料与方法
1.1 患者一般资料 选取 2016年 3月-2017年7月在我院接受治疗的60例慢性肾病患者作为观察组,其中 38例,女 22例;年龄 55~74岁,平均64.32±4.13 岁;病程 5~11 年,平均 6.89±1.17 年。纳入标准:⑴年龄≥18周岁;⑵符合慢性肾病的诊断标准;⑶无其他系统严重疾病者;排除标准:⑴临床资料不全者;⑵免疫功能异常者。此外,选取同期内在我院接受体检的60例健康成年人作为对照组,要求年龄≥18周岁,且无肾脏疾病者,其中男 30 例,女 30 例,年龄 54~75 岁,平均 64.35±4.21岁。两组研究对象年龄、性别等一般资料比较差异无显著性(P>0.05),具有可比性。
1.2 方法 对所有研究对象进行肾功能、血脂、血糖等指标检测。抽取两组研究对象空腹静脉血5ml,3000r/min离心 8min,取上清,选用酶联免疫吸附法进行 SDF-1、IL-6以及 TNF-α 检测; 选用免疫散射比浊法进行 8-iso-PGF2α、hs-CRP 检测;选用蛋白免疫印迹法检测P-糖蛋白,所有试剂盒均由R&D公司提供。同时选用贝克曼-库尔特CX3生化分析仪检测两组研究对象BUN、Cr水平。全自动免疫散射比浊仪由南京惠杰医疗科技有限公司提供;酶标仪由美国BIO-RAD公司提供,所有操作均根据说明书进行。
1.3 统计学处理 采用SPSS 11.5软件进行统计分析。计量资料采用均数±标准差表示。组间计量资料比较采用u检验,相关分析采用Pearson相关分析法,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组研究对象各指标的比较 观察组SDF-1、GFR 显著低于对照组 (P<0.05),P-糖蛋白、8-iso-PGF2α、IL-6、hs-CRP、TNF-α、BUN、Cr 水平显著高于对照组(P<0.05)。 见表 1、表 2、表 3。
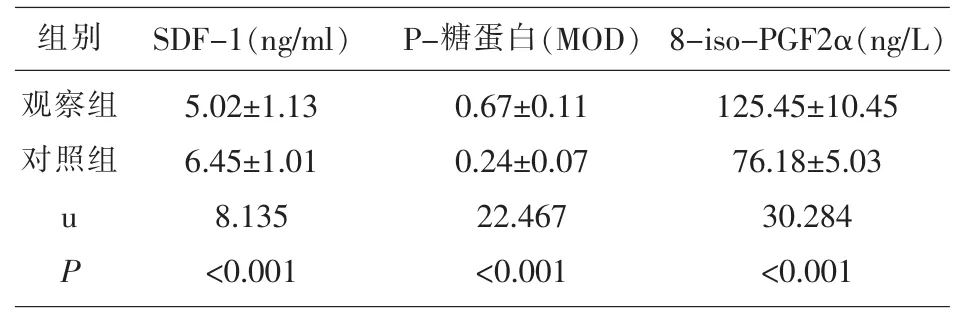
表1 两组研究对象SDF-1、P-糖蛋白、8-iso-PGF2α水平的比较
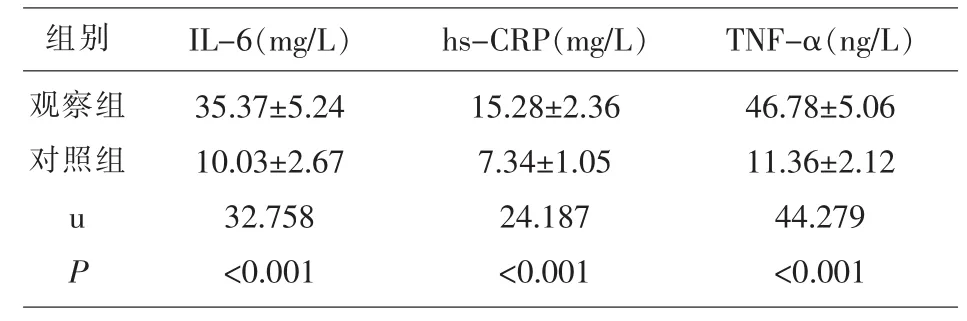
表2 两组研究对象细胞因子水平的比较
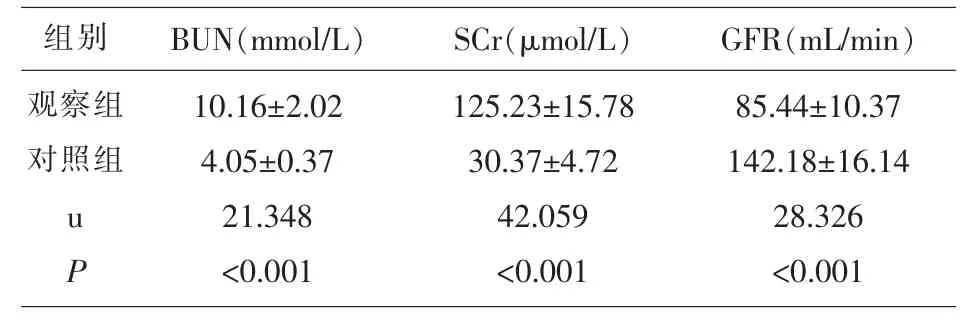
表3 两组研究对象肾功能指标的比较
2.2 观察组 SDF-1、P-糖蛋白、8-iso-PGF2α 与细胞因子、肾功能指标的相关性 观察组SDF-1水平与 IL-6、hs-CRP、TNF-α、BUN、Cr水平呈显著负相关(r=-0.605、-0.613、-0.582、-0.597、-0.621、,P<0.05), 与 GFR 水平呈显著正相关 (r=0.611,P<0.05)。 观察组 P-糖蛋白、8-iso-PGF2α 水平与 IL-6、hs-CRP、TNF-α、BUN、Cr水平呈显著正相关(r=0.587、0.648,0.565、0.597,0.603、0.498,0.632、0.503,0.641、0.617,P<0.05), 与 GFR 水平呈显著负相关(r=-0.605、-0.608,P<0.05)。
3 讨论
SDF-1是内分泌型趋化蛋白,其受体CXCR4是动脉硬化的重要参与因子。已有研究表明,SDF-1/CXCR4可通过趋化、黏附、捕获等方式促进炎症细胞进入血管壁,最终介导动脉硬化[7]。本组研究中,观察组患者SDF-1水平显著低于对照组,这种低表达促使血管壁与血液内SDF-1浓度梯度增大,诱使更多的炎症细胞迁移至肾小球内,加速肾小球动脉硬化。亦有研究表明,SDF-1具有潜在的抗炎效用,SDF-1高表达可抑制单核细胞趋化因子-1表达,而低表达时则形成促进作用[8]。单核细胞趋化因子-1具有炎症趋化及激活功能,可诱导炎症介质向炎症部位聚集,而单核细胞聚集是肾脏疾病进展的重要特征,将引发基底膜增厚、间质纤维化以及肾小球硬化等一系列病理改变[9]。相关性研究显示,慢性肾病患者SDF-1水平与IL-6、hs-CRP、TNF-α、BUN、SCr水平负相关,与 GFR 水平正相关,表明SDF-1水平越低,患者炎症水平越高,提示SDF-1与慢性肾病密切相关。
P-糖蛋白是位于细胞膜上的一种跨膜蛋白,分子量为170kDa[10]。P-糖蛋白主要表达于肾近曲小管上皮细胞、血脑屏障毛细血管内皮细胞以及肝细胞毛细胆管膜等区域,是细胞膜上的药物外排运转载体蛋白。本组研究中,观察组患者P-糖蛋白表达水平显著高于对照组,这可能与慢性肾病患者长期服药有关,患者耐药情况明显。有研究发现,在原发性肾病综合征患者中,其P-糖蛋白阳性时预后更差[11]。相关性研究显示,P-糖蛋白水平与IL-6、hs-CRP、TNF-α、BUN、SCr水平正相关,与GFR水平负相关,表明慢性肾病患者疾病越严重,P-糖蛋白越高,这与同类研究结果近似[12]。
8-iso-PGF2α是生物膜上的花生四烯酸经自由基催化后发生过氧化反应的生成物,具有多种生物学效用,如促血管收缩;刺激血管内皮细胞分化,增强内皮素-1表达;增强血小板的黏附、聚集[13];可于炎症初期通过直接或间接作用,促单核细胞聚集,损伤内皮细胞[14]。 8-iso-PGF2α 结构稳定,不易被脂质饮食影响,可特异、灵敏反应机体氧化应激水平,并提示相关疾病严重程度[15]。本组研究中,观察组患者8-iso-PGF2α水平显著高于对照组,提示慢性肾病患者存在普遍氧化应激反应。随后的相关性研究发现,8-iso-PGF2α 水平与 IL-6、hs-CRP、TNF-α、BUN、SCr水平正相关,与 GFR 水平负相关,表明慢性肾病患者氧合应激水平随疾病严重程度增高而增高,提示8-iso-PGF2α或可成为慢性肾病疾病评估新指标。
本研究通过分组实验发现SDF-1、P-糖蛋白及8-iso-PGF2α对慢性肾病发生发展具有重要作用,并且与患者疾病严重程度密切相关,提示SDF-1、P-糖蛋白及 8-iso-PGF2α 或可成为慢性肾病病情评估的新指标。但受限客观条件,本组研究样本容量较少,这三个指标是否适用于大范围的慢性肾病病情评估,这有待我们随后的大范围调查验证。综上所述,慢性肾病患者的SDF-1水平较低,P-糖蛋白及8-iso-PGF2α水平较高,其与细胞因子和肾功能指标密切相关,三个指标或可成为慢性肾病病情进展的新检测指标。

