扬州市乙型肝炎病毒B基因型前S基因特征分析
肖越胜 ,张军 ,唐阳 ,杨立坤 ,张晋
(1、扬州市医学检验中心,江苏 扬州 225001;2、扬州市疾病预防控制中心,江苏 扬州 225001)
人乙型肝炎病毒(hepatitis B virus,HBV)属嗜肝DNA病毒科,基因组是不完全闭合环状双链DNA,长度约3.2kb,有四个部分重叠的开放式阅读框(ORF),前 S/S 区(PreS/S)、PreC/C、Pol、X。 其中PreS/S区编码大、中、小3种包膜蛋白。HBV序列异质性是一个特征,源于其较高的病毒复制产量及突变率,该突变是由于在逆转录过程中缺乏校对的酶而造成的。长期的自发性突变使基因序列产生差异,依据HBV DNA全序列的核苷酸差异,共分 A-I九个基因型[1,2]。HBV 基因型中存在混合感染的现象和明显的地域分布,我国HBV感染以 B和 C型为主,占 90%以上[3,4],南方以 B和 C型为主,A型和D型在我国东部地区有少量存在。HBV在复制过程中催化逆转录过程的酶缺乏3’-5’核酸外切酶活性,从而缺乏校正功能,不能修正在外界选择压力改变下C、S区等产生的变异,使其抗原性减弱,产生免疫逃逸现象。目前有关HBV S区基因变异与乙肝疫苗免疫失败、肝移植乙肝免疫球蛋白逃逸、隐匿性HBV感染等方面的研究较多[5,6]。扬州市HBV感染以基因B、C型为主[7],但在感染过程中病毒的前S基因变异和特征目前未有报道。
1 材料与方法
1.1 样本来源 样本采自本中心门诊,静脉采血,3000rpm离心,取血清进行乙型肝炎病毒核酸(HBV-DNA)荧光PCR检测,留取核酸阳性样本-70℃冻存备用。
1.2 试剂和仪器 HBV DNA荧光定量PCR,艾肯生物技术有限公司(杭州);Viral Nucleic Acid Iso鄄lation Kit,江苏硕世生物科技有限公司;PreS引物,生工生物工程(上海)股份有限公司;PCR试剂,宝生物工程(大连)有限公司;普通PCR仪和电泳仪,美国BIO-RAD公司。
1.3 研究方法
1.3.1 血清荧光PCR检测,取具有典型荧光扩增曲线的标本,按文献[7]进行基因分型,取基因B型病毒 7株 YZ01-YZ07,其中 YZ01-YZ04病毒载量大 于 105copies/ml,YZ05-YZ07 病 毒 载 量 小 于105copies/ml。
1.3.2 PreS PCR 引物, 采用 DNAStar PrimerSelect设计HBV PreS基因区间通用引物,上游引物YZS-A:5′-cgaaaaggcatggggacaaatc(nt2872-2983);下游引物 YZS-B:5′-ggagccaccagcaggaaagta(nt49-70), 产物 414bp。 扩增条件:94℃ 1min;98℃ 10s,60℃ 15s,68℃ 30s,35 个循环。
1.3.3 PreS 基因扩增片段,1.5%琼脂糖凝胶电泳,扩增产物送南京金斯瑞公司进行测序。
1.3.4 基因分析 参考序列为从GenBank下载的HBV A-H基因型的序列,分别为A基因型:X51970;B 型 :033554,AB073858,AF121244,AF100309,D00329;C 型 :AB014381,AB033556,AF068756,X04615;D 型 :M32138,X65259;E 型 :AB032431,X75657;F 型 :AB036910,X69798;G型 :AB064310,AF160501;H 型 :AY090454,AY090457。20条参考序列与研究样本序列用BioEdit软件对齐,DNAStar MegAlign软件Clustal W比对构建距离矩阵,采用neighbor-joining法构建系统发生树。
1.3.5 将研究样本序列和基因 B型参考序列(nt2926-70)用EditSeq翻译成氨基酸序列后,输入MegAlign比对。翻译的氨基酸序列共120AA,对应表位是 PreS:AA27-146。
2 结果
2.1 PreS片段PCR结果 将已分型的7株病毒核酸进行PreS基因片段扩增,产物经1.5%琼脂糖凝胶电泳,显示扩增结果与设计扩增片段大小相符,证明PCR扩增模板为HBV DNA(见图1)
图1 PCR产物凝胶电泳图
2.2 同源性分析 扩增产物测序成功6条。将所测PreS基因片段序列和20条参考序列经软件比对,得出基因比对矩阵。扬州市6例样本间同源性分别为 97.2%~98.6%,其中 YZ07 与 YZ02、03 同源最高为 98.6%,与 YZ06 最低为 97.2%,与同基因型参考株的同源性为:92.8%~100%。参考序列033554与研究样本间同源性为:92.8%~94.8%,与 YZ06 的同源性最低为92.8%,低于其他基因B型参考序列。参考序列AF121244与研究样本间同源性高于其他基因B参考序列,与YZ03的同源性最高为100%,。研究样本与其他基因型参考株间的同源性为:78.1%~86.2%,与基因 H 型的同源性最低。
2.3 遗传进化分析 将测序结果和参考序列共26条序列对齐后构建系统发生树,结果显示26条序列分成8个分支,分别对应A~H 8个基因型 (图2)。扬州6株序列与B型参考序列在一个大分支上,证明所选样本均为HBV基因B型。其中YZ01、02、06、07 与 AF121244、AF100309 在同一小分支上,遗传距离较近,YZ03、04各在单一的小分支上,与其他序列无共用分支。另3株B型参考株在其他分支上,与研究样本的遗传距离较远。
2.4 PreS基因突变位点 扬州6株序列和在同一小分支上同源性最高的基因B型参考序列AF121244按1.3.5方法比对后发现存在缺失和突变现象。YZ07发现有4个突变位点,YZ06有3个突变位点,YZ01有1个突变位点,6例研究样本中3例发生突变,分别为PreS:AA39.YZ06缺失谷氨酸,AA44.YZ07天冬氨酸由天冬酰胺替代(D→N突变),AA45.YZ07亮氨酸由苯丙氨酸替代 (L→F突变),AA78.YZ07丝氨酸由天冬酰胺替代 (S→N突变),AA108.YZ07亮氨酸由苯丙氨酸替代(L→F突变),AA109.YZ01和YZ06丝氨酸由苏氨酸替代(S→T突变),AA114.YZ06天冬氨酸由缬氨酸替代(D→V 突变)。 YZ02、03、04与参考序列比对未发现突变。
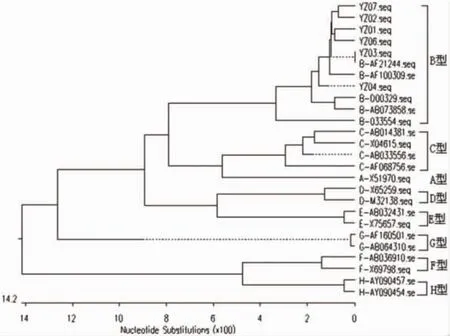
图2 扬州市6株病毒与20条参考序列构建系统发生树
3 讨论
人乙型肝炎病毒的流行在扬州以基因B和C型为主,本研究发现,扬州市HBV B基因型间同源性高,所研究样本之间的同源性高于与参考株间的同源性,且在遗传进化树中,与AF121244和AF100309的在同一小分支上,表现为较强的亲缘关系,说明扬州HBV间遗传距离近,流行地域特征明显。
S 区分为 PreS(preS1、preS2)和 S 基因,分别编码表面蛋白的大蛋白、中蛋白和主蛋白,其中大蛋白对HBV的感染吸附起关键作用。PreS基因包含许多B或T细胞表位并发挥多种功能[8]。因此PreS基因的突变会引起病毒外壳蛋白组成的改变,影响到B或T细胞的识别,影响到免疫系统对病毒的识别,是传统疫苗产生免疫失败主要原因[9]。人类白细胞抗原 (HLA)-I类分子结合来自胞内加工的肽段,因此这些分子提供消除胞内病毒并在胞内浸润的CD8+T细胞[10]。到目前为止人们已在8种HBV基因型中发现60种HBV特异性的HLAI限制性表位和32种HBV特异性的HLA-Ⅱ限制性表位[11]。许智慧[12]发现乙肝患者HBV PreS/S的表位变异降低了病毒对CTL(细胞毒性T细胞)结合的亲和力,S区中S基因为保守区域,其变异率较低,而PreS1基因的变异率高于S基因。本研究的6株样本发现PreS基因有7个位点发生突变,存在较高的突变率。PreS基因突变率随着肝病的进程呈现明显递增的趋势,基因突变促进了肝病的进展[13]。因HBV不同位点的缺失和突变的意义不同,对肝病的进程和病毒免疫都有重要影响,研究不同位点的突变对临床和被动免疫有重要作用。扬州6株PreS区氨基酸的突变为点突变,且氨基酸替代未改变极性,所以蛋白质抗原性未发生改变。低病毒载量YZ06、YZ07发现7个突变点,而高病毒载量病毒株仅YZ01存在1个,低于王社梁等[14,15]的研究,这或许与肝炎病毒是否处于活动期、病情所处阶段以及是否长期服药等有一定的关系。突变积累以及氨基酸替换的点位是否会影响本地的被动免疫,有待进一步观察。由于本次研究样本数较少,影响突变位点和氨基酸替换率统计,未发现突变优势株,不能明确基因型与临床表型之间的关系。研究发现的突变是否对临床有意义,有待以后研究。

