人参皂苷催化转化为稀有皂苷的条件优化研究
丁 杉,刘春莹,徐龙权,宋建国,鱼红闪,姜春杰
(1.大连工业大学 生物工程学院,辽宁 大连 116034; 2.大连大学 生命科学与技术学院,辽宁 大连 116622)
人参(Panaxginseng)属五加科植物,是我国传统的名贵中药,在国内被誉为百草之王[1].人参皂苷是人参的主要活性成分.目前共发现182种人参皂甙[2].人参皂苷从结构上属于四环三萜类皂苷[3].是由苷元和糖相连而形成的糖苷类化合物[4-5].它分为二醇类皂苷和三醇类皂苷[6].其中Re是三醇类皂苷的特征型皂苷,常见于人参、西洋参、三七等植物中,在人参中质量分数在0.15%~1.0%左右[7];然而具有抗休克、抗心衰、抗凝血、抗血栓等作用的20(S,R)—Rg2[8],在人参属植物中的质量分数仅为0.01%~0.03%左右[9].
在稀有人参皂苷的制备方面,以人参中含量较高的Re为底物,催化转化制备稀有皂苷20(S,R)—Rg2,受到各国学者的广泛关注.大多数情况下,使用强酸、强碱在高温、高压的条件下催化转化Re缺乏目的性,副产物多,分离纯化困难,并且会对环境造成严重污染[10].利用生物酶法催化转化Re反应温和,且具有很高的底物特异性,副产物少,对环境没有污染[11],然而生物酶法需要细胞培养、分离提取、纯化等过程,生产酶的周期长,操作严格,并且酶易失活,不易较长时间存储[12].在我们的前期研究中发现,过渡态金属离子,如Fe3+可以催化人参皂苷Rb1转化为人参皂苷Rg3,该催化反应条件温和(30~50 ℃),有定向性,副产物少,对环境无污染等特点.目前有关以金属离子为催化剂催化转化人参皂苷方面尚无相关报道,对于金属离子催化方面Zhao等[13]发现在离子液体中以Cr3+为催化剂可使糖转化为5-羟甲基糠醛.研究中发现Fe3+可催化Re转化成化20(S)-Rg2、20(R)-Rg2,催化反应过程中还有少量的Rg4、Rg6、20(S)-25-OH-Rg2、20(R)-25-OH-Rg2产生.本研究利用金属离子作为催化剂催化转化人参皂苷,与传统强酸强碱法相比,具有定向性和目的性、金属离子易于回收,对环境友好,产物易于分离纯化等优势.
1 材料与方法
1.1 材料与仪器
人参皂苷Re、20(S)-Rg2、20(R)-Rg2、20(S)-25-OH-Rg2、20(R)-25-OH-Rg2、Rg4、Rg6,由本试验室自制,HPLC纯度95%以上.AB-8大孔吸附树脂,购置于南开大学化工厂;薄层层析板,由德国 merck 公司提供;乙腈(色谱纯)、甲醇(色谱纯),购置于Tedia公司;Waters 2695-2424高效液相色谱仪为美国Waters公司产品;MoCl5、FeBr3、NbCl5、CaCl2、NaCl、ZnCl2、KCl、Fe2(SO4)3、NaBr、AlCl3、TiCl4、ZrCl4、CdI2、VCl3、FeCl3、CdCl2、NiCl2、WCl6、TaCl5、Fe(NO3)3、KBr、FeCl2、CuCl、CrCl3、MnCl2、CoCl2、RuCl3、YCl3等金属盐,以及甲醇、正丙醇、正丁醇等溶剂,均为分析纯试剂.
1.2 试验方法
1.2.1 23种金属氯化物对催化反应的影响
分别配制1.4 mol/L的金属氯化物水溶液(金属氯化物选用NbCl5,WCl6,ZrCl4,MoCl5,TiCl4,TaCl5,RuCl3,FeCl3,VCl3,FeCl2,CrCl3,AlCl3,CuCl2,CuCl,NiCl2,CoCl2,ZnCl2,CdCl2,MnCl2,YCl3,CaCl2,NaCl,KCl,Fe2(SO4)3,FeBr3,Fe(NO3)3,Na2SO4,NaBr,NaNO3,K2SO4,KBr,KNO3),配制质量分数1.0%的Re水溶液与上述金属氯化物溶液等体积混合,在40 ℃下反应12 h后,水饱和正丁醇萃取,取正丁醇层加3倍体积水继续萃取以除去Fe3+,重复3遍,取正丁醇层蒸干得到粉末样品,待用.
1.2.2 不同有机相对催化反应的影响
分别配制体积分数50%的甲醇、正丙醇、正丁醇、正戊醇、正己醇、正庚醇、异丙醇、异戊醇、环己醇、乙二醇、丙三醇、异丁醇、环戊醇、苯甲醇、无水乙醇、1,2-丙二醇、1,3-丙二醇、N,N-二甲基乙酰胺、聚乙二醇400、二甲基亚砜、1-丁基-3甲基咪唑氯化物、1-乙基-3-甲基咪唑氯化物作为溶剂,并以无水乙醇、去离子水作为对照,配制质量分数1%的Re.然后加入0.7 mol的FeCl3,在40 ℃下反应12 h后,水饱和正丁醇萃取,取正丁醇层加3倍体积水继续萃取以除去Fe3+,重复3遍,取正丁醇层蒸干得到粉末样品,待用.
1.2.3 有机相浓度对催化反应的影响
选取乙醇体系,分别配制体积分数为100%、75%、50%、25%、0%的乙醇-水混合物,底物反应质量分数为1%,加入0.7 mol FeCl3,40 ℃下反应 12 h.反应后加3倍体积水稀释,水饱和正丁醇萃取,取正丁醇层加3倍体积水继续萃取以除去Fe3+,重复3遍,取正丁醇层蒸干得到粉末样品,待用.
1.2.4 铁离子浓度对催化反应的影响
在上述最适条件下,分别配制0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2、2.4、2.6、2.8、3.0、3.2 mol/L浓度的 FeCl3溶液,取相同体积的FeCl3溶液与等体积1%的底物混合,在40 ℃下反应12 h.水饱和正丁醇萃取,取正丁醇层加3倍体积水继续萃取以除去Fe3+,重复3遍,取正丁醇层蒸干得到粉末样品,待用.
1.2.5 温度对催化反应的影响
在上述最适条件下,取相同体积的1%底物溶液与相同浓度的FeCl3溶液混合,分别放置于25、30、35、40、45、50、55、60 ℃下反应12 h,反应后加3倍体积水稀释,水饱和正丁醇萃取,取正丁醇层加3倍体积水继续萃取以除去Fe3+,重复3遍,取正丁醇层蒸干得到粉末样品,待用.
1.2.6 催化反应时间对产物含量的影响
在上述最适条件下,取等量的质量分数1%底物溶液与 FeCl3溶液混合,每6 h取反应液进行终止反应,反应后加3倍体积水稀释,水饱和正丁醇萃取,取正丁醇层加3倍体积水继续萃取以除去Fe3+,重复3遍,取正丁醇层蒸干得到粉末样品,待用.
1.2.7 金属离子催化反应产物的HPLC检测(HPLC-ELSD)
色谱柱:中汇达C18色谱柱(4.6 mm×250 mm,5 μm);柱温35 ℃;进样量10 μL;流速1.0 mL/min;载气压力206.85 kPa;漂移管温度80 ℃;流动相为水(A)和乙腈(B);流动相洗脱梯度:0~30 min,20% (B);31~40 min,20% ~32% (B);41~70 min,32%~43% (B);71~80 min,43%~100%(B)(百分数均为体积分数).
对照品溶液的制备:精密称取化合物2,化合物3,化合物4,化合物5,化合物6和化合物7对照品10 mg溶于5 mL色谱甲醇中,配成浓度为2 mg/mL的对照品溶液,然后分别取1 mL加入色谱甲醇稀释成质量浓度2.0、1.6、1.2、0.8、0.4 mg/mL的对照品溶液,过膜备用.分别取上述制备的不同浓度对照品溶液质量浓度10 μL,按上述色谱条件进样分析,以测得的峰面积的自然对数对进样质量浓度的自然对数绘制标准曲线,用最小二乘法进行线性回归,得到各个成分的回归方程,结果显示,人参皂苷对照品在上述进样范围内线性关系良好,结果见表1.
参照标准曲线,分别计算粉末样品中含有的20(S)-Rg2、20(R)-Rg2、Rg4、Rg6、20(S)-25-OH-Rg2和20(R)-25-OH-Rg2的质量(W),20(S)-Rg2+20(R)-Rg2归为一组称为20(S,R)-Rg2,Rg4和Rg6归为一组,20(S)-25-OH-Rg2和20(R)-25-OH-Rg2归为一组称为20(S,R)-25-OH-Rg2.
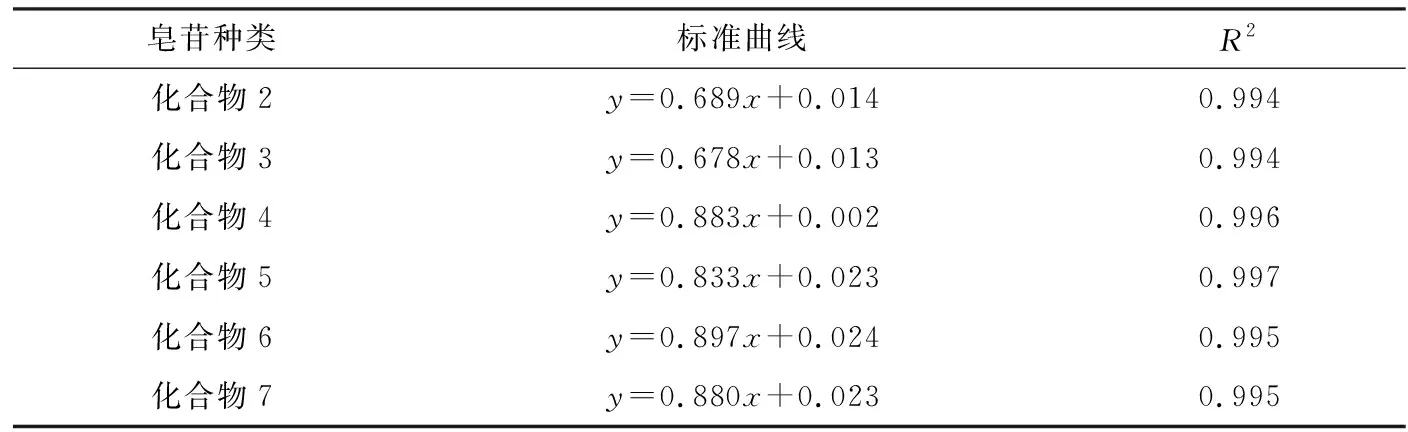
表1 不同人参皂苷浓度标准标准曲线
1.2.8 金属离子催化反应产物的制备
以Re为底物,FeCl3为催化剂进行反应,采用体积分数50%乙醇作为溶剂体系,称取50 gRe和568 g FeCl3溶解于 5 000 mL体积分数 50 %的乙醇中,在40 ℃下,反应12 h后经AB-8大孔吸附树脂进行脱铁脱糖处理,将上述待处理的溶液用去离子水稀释12倍,慢慢流入AB-8大孔吸附树脂柱,反复上样直至用TLC进行检测流出液无皂苷为止.再用5倍体积去离子水冲洗树脂柱,至流出液中无Fe3+为止,之后利用90%乙醇洗脱树脂柱,至TLC检测无皂苷为止,回收洗脱液并旋转蒸发至粉末状,待用.
2 结果与分析
2.1 不同金属离子对催化反应产物的影响
采用1.2.1的方法考察23种不同金属离子对Re催化转化的影响,结果如图1所示.NbCl5,WCl6,ZrCl4,MoCl5,TiCl4,TaCl5,RuCl3,FeCl3,VCl3,FeCl2能彻底转化Re,CrCl3有反应现象,但是底物转化不彻底,有少量产物生成,AlCl3,CuCl2,CuCl,NiCl2,CoCl2,ZnCl2,CdCl2,MnCl2,YCl3,CaCl2,NaCl和KCl没有任何催化效果,底物不发生转化,没有产物生成.查看元素周期表发现,能够使Re发生催化反应的的金属元素都位于元素周期表副族,且仅有第ⅤB、ⅥB族及ⅧB族铁系元素具有催化作用.
选取Fe2(SO4)3,FeBr3,Fe(NO3)3,FeCl3,以及Na2SO4,NaBr,NaNO3,NaCl和K2SO4,KBr,KNO3,KCl,CdBr2,CdI2,Cd(NO3)2.来进一步考察催化反应中阴阳离子的影响.结果如图2所示,Fe3+组的4个反应均能催化转化Re,Cd2+组效果不明显,而Na+、K+组没有任何催化效果,据此判断在催化反应中是阳离子起催化作用.
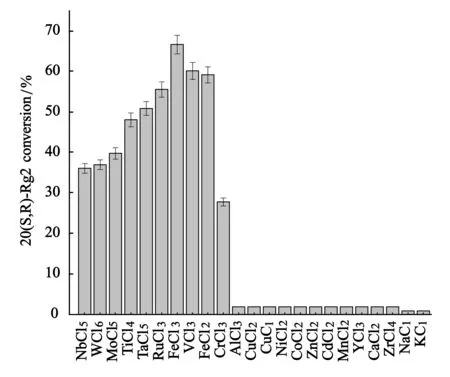
图1 23种金属氯化物对Re催化转化的影响结果
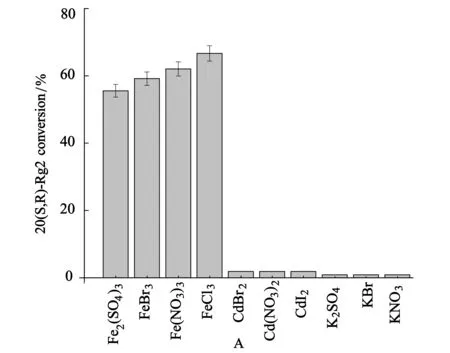
图2 不同阴离子对Re催化转化的影响结果
2.2 不同有机相对催化反应产物的影响
如图3所示,在17种醇体系中,均有20(S,R)-Rg2生成,但生成量不同,甲醇、乙醇体系中反应较彻底,正丁醇、异戊醇体系中Re 并未彻底反应掉.乙醇体系生成20(S,R)-Rg2的量最多,故选择乙醇作为最适反应醇体系,进行试验.
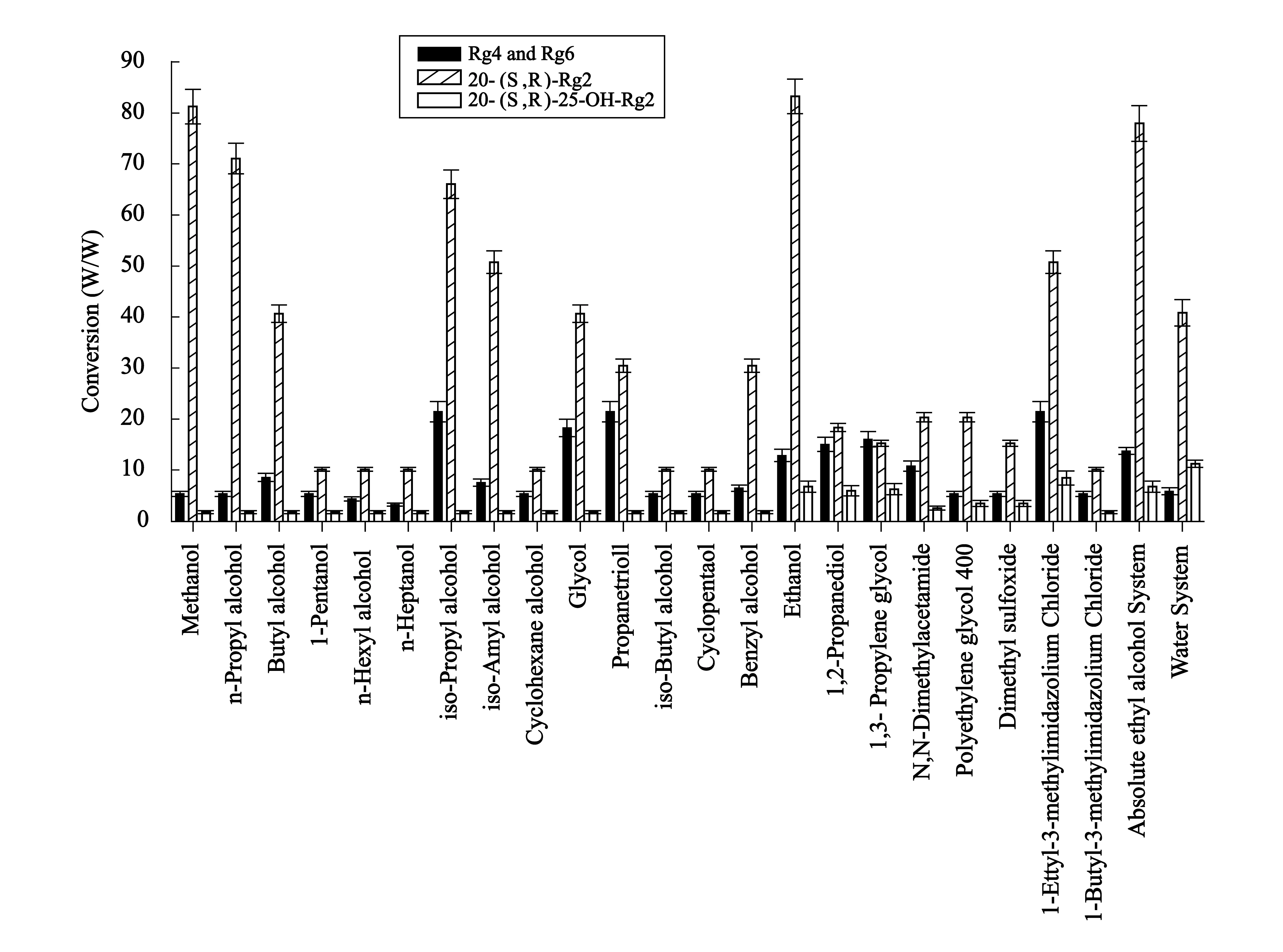
图3 不同体系下Re催化转化成产物的质量分数
2.3 乙醇体系下最佳反应条件的优化
根据1.2.1~1.2.6中试验条件进行试验,各物质质量分数结果如图4所示.由图4看出,在纯水相中,Re并未完全反应,随着醇浓度的升高,20(S,R)-Rg2产率提高,在体积分数50 %时达到最大值55%(W/V).当反应温度为30 ℃时,Re有较多剩余,在40 ℃时,底物完全水解,Rg2产率最高,位43.5%(W/V)随着温度继续升高,产率略有下降.同时,20(S,R)-Rg2产率随FeCl3浓度升高而增加,当FeCl3浓度大于0.7 mol/L时,产率维持在43%(W/V).当反应进行到12 h时,底物Re已彻底被催化转化,20(S,R)-Rg2的含量最多,达到75%(W/W).之后随着反应时间延长,20(S,R)-Rg2含量逐渐降低,Rg4及Rg6含量变化不大,而20(S,R)-25-OH-Rg2含量明显升高.
2.4 20(S,R)-Rg2的催化转化制备
以Re为底物,FeCl3为催化剂进行反应体积分数,采用体积分数50%乙醇作为溶剂体系,称取50 gRe和568 g FeCl3溶解于5 000 mL体积分数50%乙醇中,在40 ℃下,反应12 h后,将反应液用去离子水稀释12倍,并快速经AB-8大孔吸附树脂进行脱铁脱糖处理,并将溶液进行旋转蒸发至粉末状.最终得到催化反应产物粗品的质量为32.4 g,得率为64.8%.制备得到的粗品经HPLC-ELSD测定,结果如图5所示.发现粗品中含有6种催化反应产物,分别为20(S,R)-Rg2、化合物4和化合物5、20(S,R)-25-OH-Rg2.在无水乙醇体系中Fe3+催化人参皂苷Re的主要产物是20(S,R)-Rg2,质量分数为74.3%,Rg4和Rg6的质量分数为12.2%,20(S,R)-25-OH-Rg2的质量分数为14.5%.20(S,R)-Rg2、Rg4和Rg6、20(S,R)-25-OH-Rg2的比例关系为74∶12∶14.
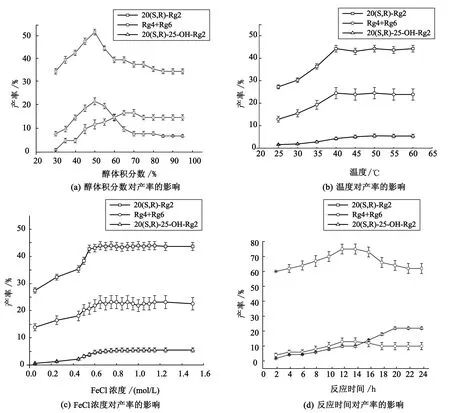
图4 不同条件下产物的浓度变化图
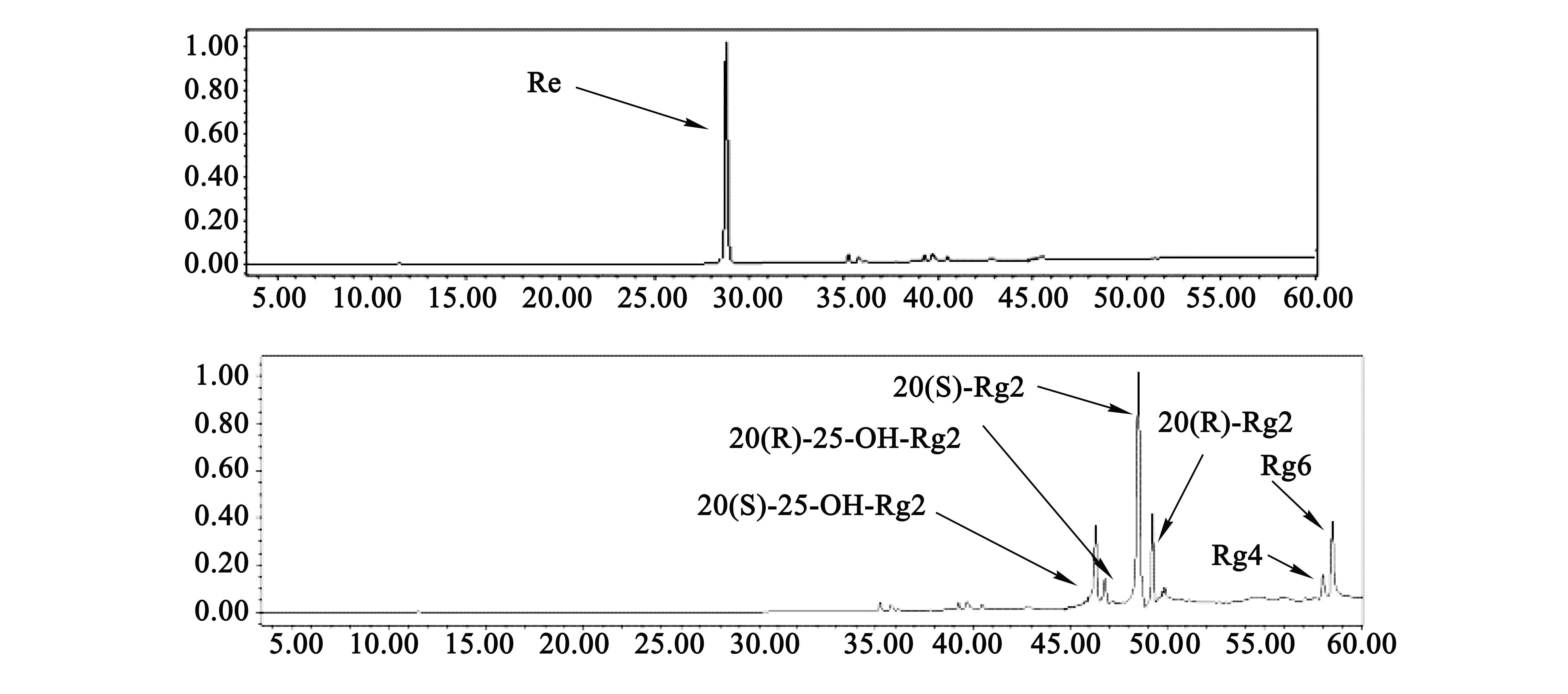
图5 底物及反应产物的HPLC图谱
3 结语
在体积分数50%乙醇中,利用FeCl3在40 ℃下0.7 mol/L FeCl3中反应12 h能够得到最大产率的20(S,R)-Rg2,产率约为74%.在得到的组皂苷中,20(S,R)-Rg2、Rg4和Rg6、20(S,R)-25-OH-Rg2含量之比为74∶12∶14.在人参皂苷Rg2的制备方面,本文研究的方法与生物转化法相比,产率更高,无需培养微生物,操作简单,对未来大规模产业化生产具有重要意义.

