瞿麦治疗小鼠实验性自身免疫性神经炎的疗效及机制研究
乔保俊 周树虎 郑培兵 齐子有 邢春叶 石其光 郝延磊
吉兰-巴雷综合征(Guillain-Barré syndrome,GBS)是以周围神经和神经根的脱髓鞘病变及小血管炎性细胞浸润为病理特点的自身免疫性周围神经病,其病因和发病机制仍不明确[1]。免疫球蛋白和血浆置换治疗GBS有效,但由于其价格昂贵,限制了其临床应用。流行病学资料显示,免疫球蛋白和血浆置换仅对65%的GBS患者有效,约2%~12%的患者因疗效差而死亡,另有7%~15%的患者会遗留有严重残疾[2],给社会和患者家庭带来沉重负担。因此寻找经济有效的GBS治疗方法具有重要意义。
Reid-Adam等[3]首次发现,瞿麦可显著抑制幼稚性和记忆性自身反应性T细胞增殖和分泌γ干扰素(IFN-γ)的作用,并能促进调节性T细胞(Treg)增殖,而Treg数量的增加可促进GBS的疾病恢复。因此,作者推测瞿麦极有可能具有治疗GBS的作用。目前,对于瞿麦调控免疫细胞分化的机制尚不明确,有关瞿麦治疗自身免疫性疾病的研究尚未检索到。本研究利用人工合成的P0180-199肽段混以完全福氏佐剂(CFA)主动免疫C57BL/6小鼠建立实验性自身免疫性神经炎(EAN)模型,观察瞿麦对EAN小鼠临床症状、Th细胞亚群、炎性细胞因子的影响,旨在探讨瞿麦是否具有治疗GBS等自身免疫性疾病的作用。
1 材料和方法
1.1实验动物6周龄C57BL/6雄性小鼠16只,体质量20~24 g,所用小鼠符合SPF级标准并饲养于标准级SPF级动物房中。将小鼠随机分为瞿麦组和对照组,每组8只。本实验已通过济宁医学院附属医院伦理审查。
1.2主要试剂和仪器中药瞿麦购于济宁医学院附属医院中药房,按常规包煎制成1 g/mL的水煎剂,浓缩成3 g/mL。P0180-199肽段购自上海生工公司,CFA购自美国Sigma公司,百日咳毒素干粉购自北京生物制品研究所,胎牛血清、1640培养基、100×青链霉素均购自美国Gibio公司,FITC Anti-mouse CD4抗体、APC Anti-mouse CD25抗体、PE Anti-mouse Foxp3抗体、PE Anti-mouse IFN-γ抗体、APC Anti-mouse IL-4抗体、PE Anti-mouse IL-17F抗体均购自美国e-Bioscience公司,肿瘤坏死因子α(TNF-α)、白细胞介素(IL-1β)和IFN-γ ELISA试剂盒均购自武汉博士德有限公司。流式细胞仪为美国BD公司产品,酶标仪为美国ChroMate®Microplate Reader。
1.3方法
1.3.1EAN造模方法:25 μL生理盐水中加入50 μg P0180-199,25 μL CFA加入0.5 mg结核分支杆菌,用针式混匀器混匀制成油包水,两者混合溶液经小鼠肩胛区皮下注射,分别在第0天、第8天免疫小鼠两次诱导EAN模型。所有小鼠在免疫前1天以及免疫后第1天和第3天经尾静脉分别注射400、300、300 ng百日咳毒素[4]。造模后,每天由专人进行临床评分,观察各小鼠的行为学表现并记录评分变化情况。观察期自初次免疫后持续至免疫后28 d。行为学评分采用如下标准:0分:正常;0.5分:介于正常和临床症状之间;1分:尾部无力;2分:出现后肢瘫;3分:出现明显的后肢瘫;4分:四肢瘫痪;5分:死亡。小鼠临床行为学评分达2分时进行治疗干预。
1.3.2瞿麦治疗干预方案:按体质量15 g/kg给予瞿麦组小鼠瞿麦灌胃,1次/d,连续1周。对照组以相同方式给予同等剂量的生理盐水。
1.3.3外周血Th1/Th2/Th17/Treg细胞水平检测:于免疫后第28天,腹腔注射水合氯醛麻醉小鼠,经颈静脉抽取外周血后分离淋巴细胞,每个流式管取外周血淋巴细胞1×106个,然后分别用FITC标记的CD4、Foxp3、IFN-γ,IL-4、PE、IL-17F抗体进行流式细胞仪检测Th1、Th2、Th17、Treg细胞水平并计算Th1/Th2和Th17/Treg比值,所有实验步骤操作参照说明书进行。
1.3.4TNF-α、IL-1β和IFN-γ水平检测:免疫后第28天,经颈静脉抽取外周血后应用酶联免疫吸附实验检测TNF-α、IL-1β和IFN-γ水平。所有实验步骤操作参照说明书进行。通过标准品制作标准曲线,根据样品吸光度值计算各样品的实际浓度,单位以pg/mL表示。
1.4统计学处理采用SPSS22.0统计学软件进行分析,符合正态分布的计量资料以均数±标准差表示,两组间比较采用独立样本t检验;非正态分布的计量资料以中位数和四分位数间距表示,两组间比较采用Mann-WhitneyU检验。以P<0.05为差异有统计学意义。
2 结果
2.1EAN小鼠造模情况绝大多数小鼠于免疫后第7天开始出现精神不振等非特异性表现,第9天开始发病,出现尾部无力、活动受限等临床表现,临床行为学评分均在2分以上。所有小鼠EAN造模成功。
2.2各组EAN小鼠行为学评分比较同对照组相比,瞿麦组小鼠行为评分的高峰期明显延迟(对照组在第17天,而瞿麦组在第19天),瞿麦组最高评分较对照组降低(4.75±0.46比3.75±0.88;t=2.828,P=0.013),且第28天时其评分依然低于对照组(0.44±0.42比1.06±0.68;t=2.220,P=0.043)。结果见图1。
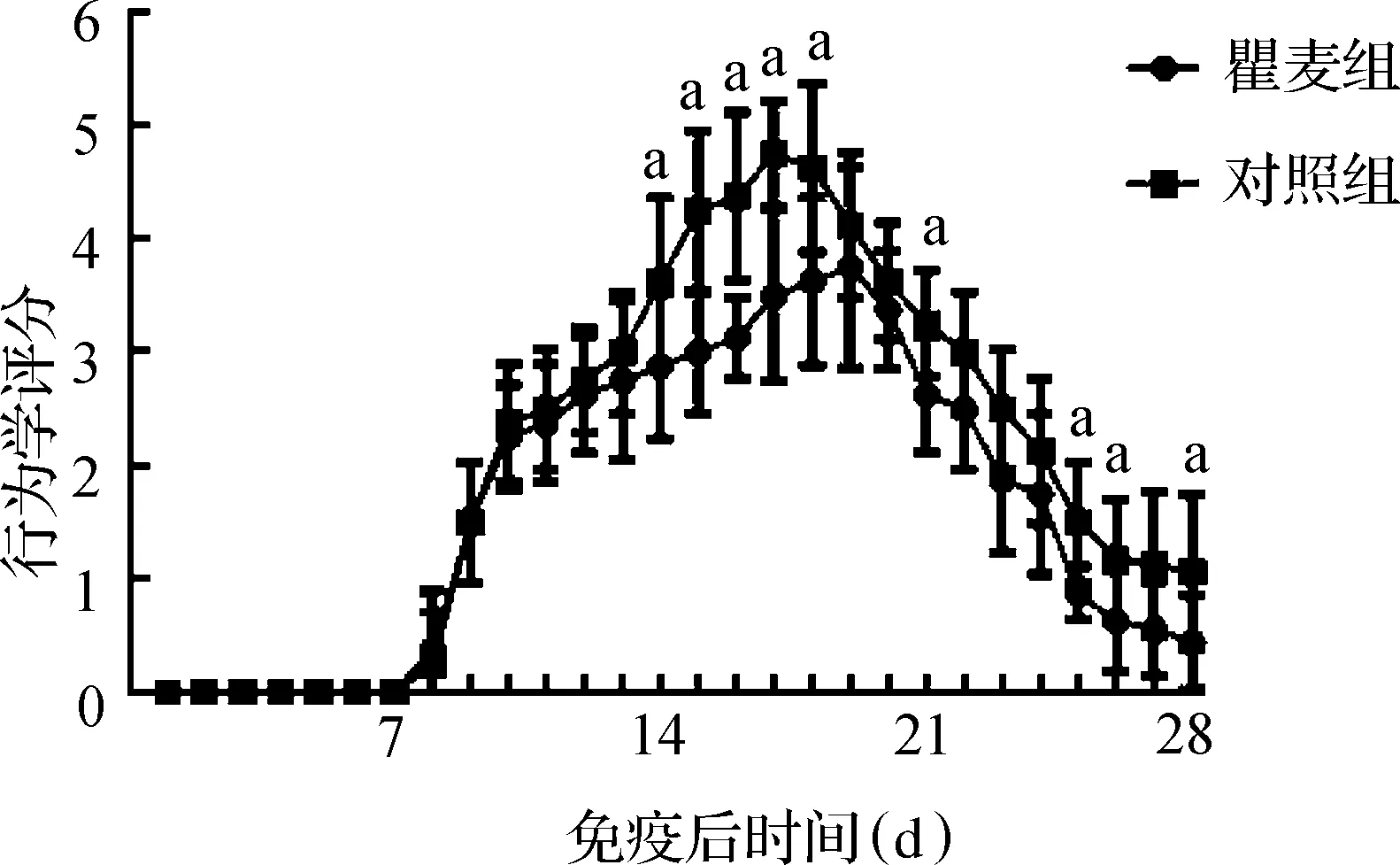
注:EAN:实验性自身免疫性神经炎,图1、表1~2同;与瞿麦组比较,aP<0.05 图1 两组EAN小鼠行为学评分比较
2.3两组EAN小鼠Th细胞亚群分化比较与对照组相比,瞿麦组外周血单个核细胞中CD4+IL-17+(Th17)细胞和CD4+Foxp3+(Treg)细胞水平以及Th1/Th2和Th17/Treg细胞比值降低(P<0.01或P<0.05),而CD4+IFN-γ+(Th1)细胞、CD4+IL-4+(Th2)细胞未发生统计学变化(均P>0.05)。结果见图2和表1。
2.4两组小鼠血清TNF-α、IL-1β和IFN-γ水平比较与对照组相比,瞿麦组EAN小鼠血清TNF-α、IL-1β和IFN-γ水平明显下降(P<0.01或P<0.05)。结果见表2。
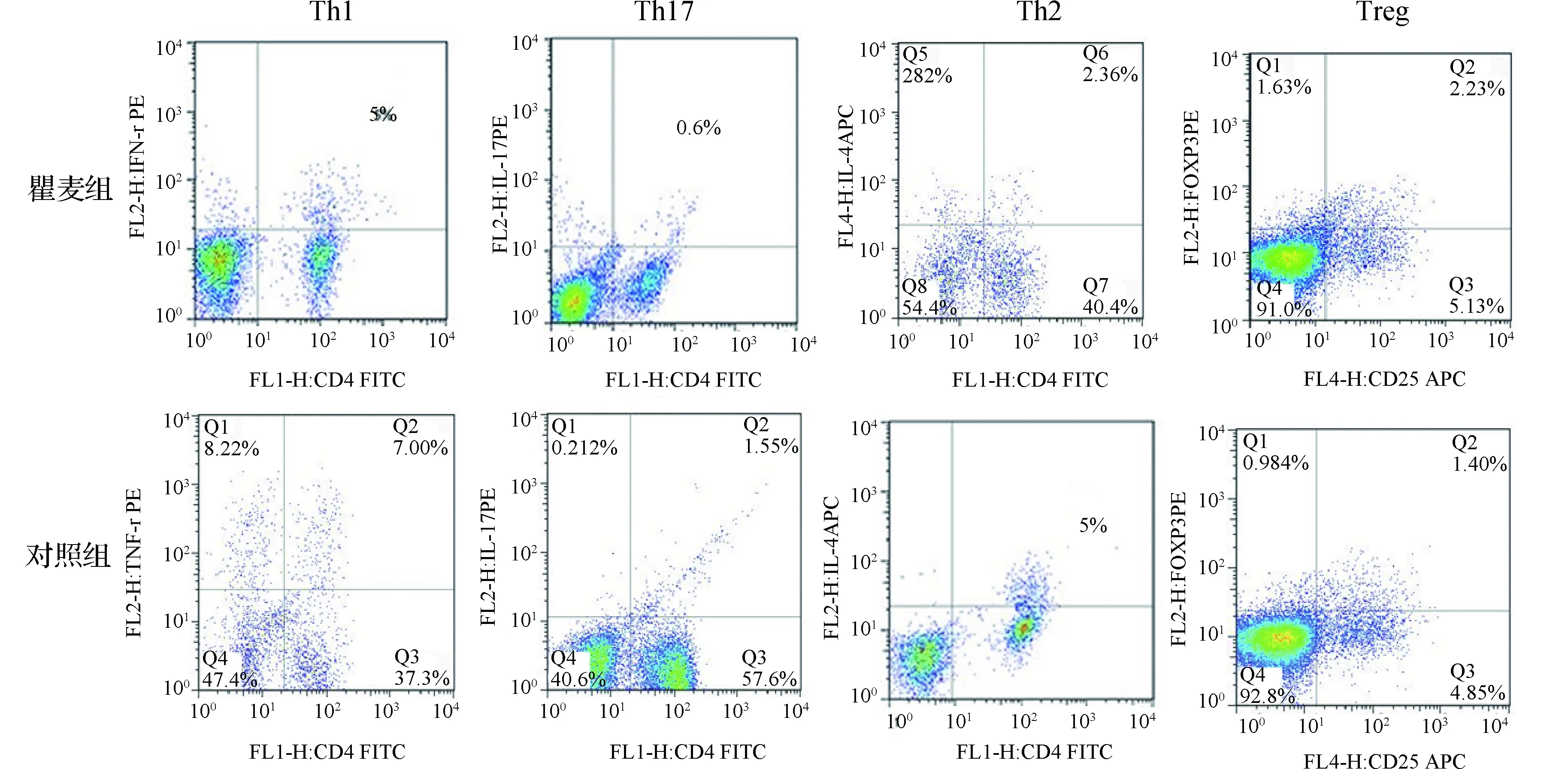
图2 流式细胞仪检测两组EAN小鼠外周血Th细胞亚群水平
表1 两组EAN小鼠外周血Th细胞亚群及Th1/Th2和Th17/Treg细胞比值(n=8,±s)
注:a数据以中位数(四分位数间距)表示
表2 两组 EAN小鼠血清TNF-α、IL-1β和IFN-γ水平比较(n=8,±s,pg/mL)
注:TNF-α:肿瘤坏死因子α;IL-1β:白细胞介素-1β;IFN-γ:γ干扰素
3 讨论
探讨GBS患者免疫耐受失衡的具体机制,将有助于了解其发病机制,进而寻找治疗自身免疫性疾病的临床干预方法。EAN是目前研究GBS的经典动物模型,通过利用优势肽段P0或P2加CFA主动免疫易感动物而建立,其临床表现、电生理表现以及免疫学特征与GBS相似,因此广泛被用于研究GBS的发病机制及治疗策略[5-6]。本研究选用6周龄C57BL/6小鼠制作EAN模型,能够代表经典的GBS和其他炎性周围神经病的动物模型。
瞿麦为石竹科植物瞿麦的带花全草,味苦性寒,归心、膀胱、小肠经,具有清热利尿、破血通经的效果,临床疗效广泛。现代药理学研究表明,瞿麦具有抗瘤作用、利尿、兴奋子宫、抗菌、抗氧化等多种药理作用。另外,目前研究表明瞿麦还具有调控免疫细胞分化的作用,但其药效物质基础尚不清楚。傅旭阳等[7]从瞿麦全草石油醚萃取物中分离得到9个化合物,分别鉴定为5-羟基-7,3′,4′-三甲氧基二氢黄酮、5,3′-二羟基 -7,4′- 二甲氧基二氢黄酮、5,4′-二羟基-7,3′-二甲氧基二氢黄酮、β-菠甾醇、胖大海A、(24R)-环阿屯-25-烯-3β,24-二醇、(24S)-环阿屯-25-烯-3β,24-二醇、豆甾-7-烯-3β-醇和羟基二氢博伏内酯。临床真正发挥药理作用的主要成分为黄酮、蒽醌、皂苷等化合物[8]。
研究表明,某种致病因子打破机体免疫稳态,导致自身反应性CD4+Th细胞的产生是GBS发病的基础[9]。根据其免疫学特征的不同,CD4+T细胞可分为Th1细胞、Th2细胞、Th17细胞和Treg细胞4个亚群[10]。在发病初期,GBS患者外周血Th1细胞和Th17细胞及其各自分泌的IFN-γ和IL-17水平均显著增加;在疾病恢复期,Th1细胞和Th17细胞水平及其分泌的细胞因子IFN-γ、IL-17水平均显著下降;同时Th2细胞和Treg在GBS发病过程中的演变与Th1、Th17细胞相反[11]。在GBS的动物模型EAN小鼠中,抑制Th1和Th17细胞的分化或增加Th2细胞和Treg水平均可改善EAN模型的临床症状。因此,Th1细胞和Th17细胞为GBS发病中的致病性细胞,而Th2细胞、Treg被认为在GBS发病中发挥保护性作用,尤其是Treg,它是介导宿主免疫耐受的关键因素,Treg的数量减少或功能抑制被认为与GBS的发生、发展密切相关。本研究结果显示,瞿麦治疗组在免疫后第28天,EAN小鼠临床症状明显改善,外周血Th1细胞和Th17细胞的数量均较发病时明显降低,而Th2细胞和Treg明显增加;酶联免疫吸附实验检测外周血TNF-α、IL-1β和IFN-γ水平明显减少。这与Reid-Adam等[3]研究发现的瞿麦可显著抑制健康人群外周血幼稚性和记忆性自身免疫性T细胞增殖和分泌IFN-γ的能力,并促进调节性T细胞Treg细胞的增殖相一致。本研究结果并未显示瞿麦组和对照组Th1细胞、Th2细胞水平存在统计学差异,这可能与样本量少有关。
综上所述,本研究结果显示,瞿麦可显著改善EAN小鼠模型的临床症状,并可调节小鼠的免疫功能,有望成为一种价廉物美治疗GBS/EAN的药物。由于本研究所用瞿麦为特殊提取物,其具体作用的有效成分并不明确,有必要在今后的工作中进一步探讨。

