组织蛋白酶H在甲状腺乳头状癌中的表达及其意义
周涛,吕云霞,陈万志,许德斌,谢嵘,熊骋峰,张书勇,余济春
(南昌大学第二附属医院 甲状腺外科,江西 南昌 330006)
甲状腺癌是目前最为常见的内分泌系统恶性肿瘤之一[1-2],其来源于甲状腺滤泡上皮细胞的癌变。约占全身恶性肿瘤的1.3%~1.5%,且近些年增长趋势非常明显[3-4]。其病理类型主要包括乳头状癌、滤泡癌、髓样癌及未分化癌等[5]。其中,甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺恶性肿瘤中最常见的类型,约占85%~90%[6]。患者多见于青年女性[7],PTC局部淋巴结转移率较高,少数可出现血行转移及远处转移[8]。其治疗方法主要有手术治疗、放射性碘核素治疗、术后的甲状腺激素抑制治疗以及最新的生物治疗[9](其中主要是分子靶向药物)等。大部分的患者预后良好,生存率高[10],但仍有少数约10%~20%的患者因未分化癌或复发的分化型甲状腺癌而死亡。另外,部分分化型甲状腺癌包括PTC因首次手术方式不规范或出现局部复发需再次手术,而再次手术难度以及手术的并发症风险大大增加[11]。这类现有治疗手段难以取得较好疗效的分化型甲状腺癌被称为难治性分化型甲状腺癌,亟待探索新的治疗方案予以解决。难治性甲状腺癌一直以来就是甲状腺疾病治疗所面临的难关之一。美国甲状腺协会的研究数据显示,影响甲状腺癌患者5年生存率的最主要因素是局部晚期以及远处转移[12]。随着基础医学、分子生物学以及免疫学的发展,基因治疗成为近些年来研究的热点,学术上也不断涌现相关科研成果,许多靶向药物应用于临床,并取得了良好的效果,预后也显著提高[13]。基因治疗越来越被临床医生和患者所认知和接受,靶向药物具有针对性强、副作用小、疗效明显的特点,因此新型靶向药物的应用及基因治疗的普及为难治性甲状腺癌患者带来新的希望[14]。
有越来越多的证据表明,组织蛋白酶H(cathepsin H,CTSH)在乳腺癌,黑色素瘤,神经胶质瘤,结直肠癌和前列腺癌等肿瘤细胞中的表达升高,CTSH能够参与上述不同肿瘤的发生过程,如血管生成,细胞增殖,细胞凋亡和侵袭等[15]。CTSH和其它蛋白酶还可能参与细胞外基质组分的破坏,从而导致癌症的增殖,迁移和转移[16]。蛋白酶的作用在许多方面对于细胞或组织的功能是决定性的,任何对蛋白酶运输的干扰都会导致蛋白水解作用的调节改变,进而导致甲状腺癌发生和进展。而对正常细胞和肿瘤细胞中蛋白酶的转运途径的理解,为寻找新的治疗方法中的药物靶点提供了线索。本研究旨在探讨CTSH在PTC组织中的表达及其与甲状腺肿瘤发生发展的相关性。进一步分析CTSH在不同甲状腺组织中的表达差异与PTC的临床病理特征之间的关系。为临床病理诊断、基因诊疗和预后估计等方面提供参考指标,对于探讨新的可行的治疗方法具有重要意义。
1 资料与方法
1.1 实验标本
经我院医学伦理委员会审批,并征得患者知情同意后,收集2016年7月—2016年12月间南昌大学第二附属医院甲状腺外科手术切除的标本,其中PTC组织50例,甲状腺癌旁组织(即相应癌组织旁1 cm内甲状腺组织)50例,另取50例相应的正常甲状腺组织作为对照。所有患者术前均未行相关药物治疗、放疗及化疗。所有标本均在离体后0.5 h内完成采集,其中一部分放入液氮保存用于RNA及蛋白的表达检测,另一部分用于免疫组织化学检测。所有标本病理类型在术后均有病理科专家报告证实。排除标准:术前合并其他肿瘤;再次手术及复发;南昌大学第二附属医院术后病理诊断为PTC合并甲状腺其他病理类型癌(如合并髓样癌、滤泡状癌等) 。
1.2 主要试剂及仪器
1.2.1 主要试剂 蛋白提取试剂盒(北京普利莱),凝胶制备试剂盒(博士德生物),ECL化学发光检测试剂盒(美国Thermo),酶标山羊抗兔IgG聚合物(北京中杉金桥),内源性过氧化物酶阻断剂(北京中杉金桥),一抗:兔抗人CTSH单克隆抗体(英国Abcam),Alpha Tubulin Antibody Mouse Monoclonal(美国Proteintech),二抗:相应的辣根过氧化物酶标记的山羊抗体(上海碧云天生物),RNA提取试剂盒(美国OMEGA),反转录试剂盒(日本TaKaRa),SYBR® Premix Ex Taq™ II(日本TaKaRa),CTSH及内参 GAPDH引物设计与合成由南京金斯瑞生物提供,CTSH上游引物5'-CAA CTG GAG GAA GAT AAA CG-3',下游引物5'-GCT GAG CAA TTC TGA GGC-3';内参GAPDH上游引物 5'-CAG GGC TGC TTT TAA CTC TGG T-3',下游引物5'-GAT TTT GGA GGG ATC TCG CT-3'。
1.2.2 主要仪器 实时荧光定量PCR仪7500(美国BIORAD),ChemiDoc XRS+化学发光成像分析系统(美国BIORAD),低温超速离心机(德国Eppendorf),超低温冰箱(美国Thermo Forma),垂直电泳仪(美国BIORAD)。
1.3 实时荧光定量PCR(qRT-PCR)法
分别取PTC组织、癌旁组织及正常甲状腺组织各50 mg,液氮研磨后提取总RNA,采用分光光度仪测定RNA纯度及浓度,采用1%琼脂糖凝胶电泳检测RNA的完整性。以RNA为模板,采用反转录法进行cDNA 合成,反转录条件如下:37 ℃5 min; 85 ℃ 5 s,将所得cDNA进行PCR扩增。PCR 反应总体积为20 μL:2.0 μL cDNA模板,1.6 μL CTSH或GAPDH引物,10 μL SYBR® Premix Ex Taq™ II,6.4 μL双蒸水。反应条件:95 ℃预变性30 s,95 ℃变性 5 s,60 ℃复性32 s,循环40次。以GAPDH为内参,不加模板组做为阴性对照,各样品均须设置3个复孔,重复操作2次,设定实验阈值,求出平均CT(cycle threshold)值,并且对实验数据进行校正,按照公式计算出样品的相对表达量,以2-ΔΔCT值表示,计算公式为:RQ值=2-△△CT,△△CT=(实验组目的基因CT值-实验组内参CT值)/(对照组目的基因CT值-对照组内参CT值)。使用相应的统计方法分析CTSH m R N A相对定量值,分析实验数据的统计学意义。
1.4 Western blot法
分别取PTC组织、癌旁组织及正常甲状腺组织各50 mg,液氮研磨后,用蛋白提取试剂盒提取总蛋白,用BCA法测定蛋白浓度。取40 μg蛋白样品和上样缓冲液混匀后煮沸10 min上样,在其两侧加蛋白Marker 10 μL,SDS-PAGE凝胶电泳(80 V约30 min,120 V约1.5 h)。转膜(260 mA 1 h)至PVDF膜,5%脱脂牛奶室温封闭2 h,TBST缓冲液洗膜 10 min×3次;分别加入CTSH或Tubulin一抗后4 ℃过夜,TBST缓冲液洗膜10 min×3次。分别加入二抗,室温孵育1 h,TBST 缓冲液充分洗膜,应用ECL化学发光检测试剂盒进行显色,ChemiDoc XRS+化学发光成像分析系统曝光显影,对蛋白条带灰度值进行定量分析。目标蛋白CTSH的相对表达量用CTSH蛋白与 GAPDH蛋白的灰度比值表示。
1.5 免疫组织化学SP法
石蜡包埋组织4 μm连续切片,使用二甲苯脱蜡,梯度乙醇脱水,3%过氧化氢溶液阻断内源性过氧化物酶10 min,pH 6.0柠檬酸缓冲液抗原微波修复10 min,非免疫动物血清封闭,滴加稀释的CTSH一抗孵育4 ℃过夜,PBS液冲洗后加酶标山羊抗兔IgG聚合物,室温孵育20 min,PBS液冲洗,DAB 显色,苏木素复染、脱水、透明、封片、镜检。此检测中,使用PBS代替一抗作为阴性对照。在显微镜下确定细胞染色强度,无着色为阴性(-),淡黄色为弱阳性(+),棕黄色为中度阳性(++),棕褐色为强阳性(+++)[17]。
1.6 统计学处理
所有数据均采用 SPSS 20.0统计软件处理,使用均数±标准差(±s)表示,计数资料采用χ2检验及Fisher精确检验,两组间的数据比较采用独立样本t检验,多组间数据比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 CTSH mRNA表达检测结果
PTC中CTSH mRNA的表达水平明显高于癌旁组织及正常甲状腺组织,差异均有统计学意义(均P<0.05)。癌旁组织和正常甲状腺组织中CTSH mRNA的表达水平无统计学差异(P>0.05)(图1)。
2.2 CTSH蛋白表达Western blot检测结果
PTC中CTSH 蛋白的表达水平明显高于癌旁组织及正常甲状腺组织,差异均有统计学意义(均P<0.05)。癌旁组织和正常甲状腺组织中CTSH蛋白的表达水平无统计学差异(P>0.05)(图2)。
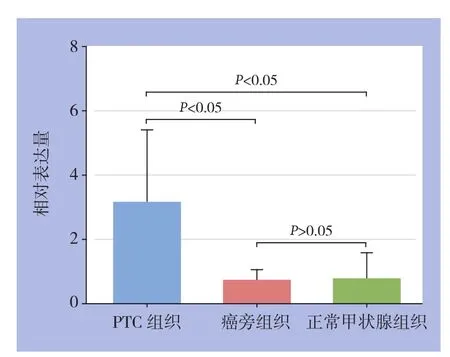
图1 CTSH mRNA相对表达量检测Figure1 Determination of the relative expression levels of CTSH mRNA

图2 CTSH蛋白相对表达量检测Figure2 Determination of the relative expression levels of CTSH protein
2.3 CTSH蛋白表达免疫组化检测结果
免疫组化检测结果显示,CTSH的表达主要位于细胞浆中,少数表达于细胞核中。本组PTC组织中(-)8例,(+)4例,(++)16例,(+++)22例;癌旁组织中(-)46例,(+)3例,(++)1 例,(+++)0例;正常甲状腺组织中(-)47例,(+)2 例,(++)1例,(+++)0例。CTSH蛋白在PTC组织中的阳性表达率明显高于其在癌旁组织(84.0%vs.8.0%)与正常甲状腺组织(84.0%vs.6.0%)(均P<0.05)的表达(图3)(表1)。
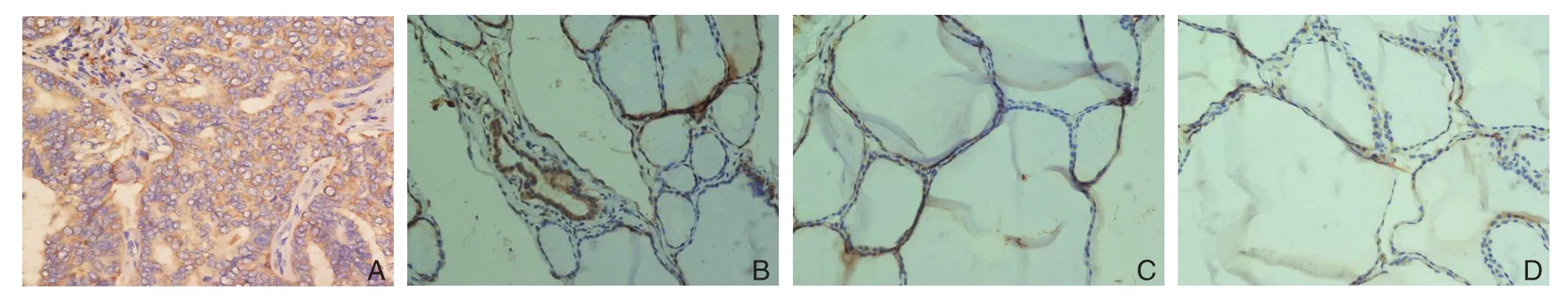
图3 CTSH蛋白免疫组化检测(×400) A-B:CTSH蛋白在PTC组织中的阳性表达;C:癌旁组织中的阴性表达;D:正常甲状腺组织中的阴性表达Figure3 Immunohistochemical staining for CTSH protein (×400) A–B: Positive expression of CTSH protein in PTC tissue;C: Negative expression of CTSH protein in tumor adjacent tissue; D: Negative expression of CTSH protein in normal thyroid tissue
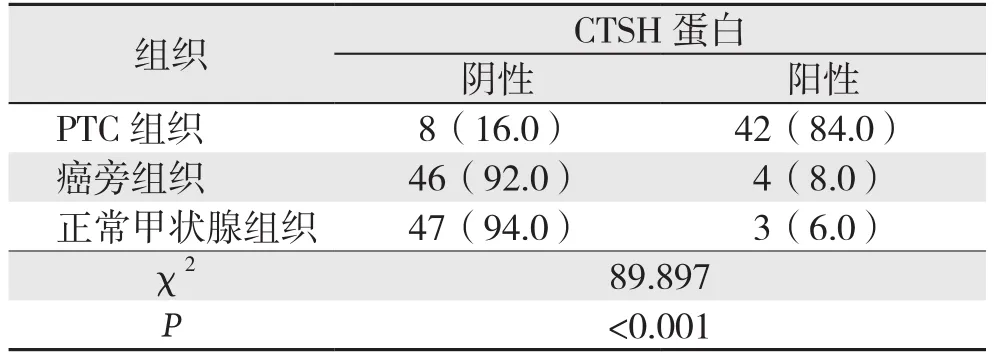
表1 CTSH蛋白阳性表达率比较[n=50,n(%)]Table1 Comparison of positive expression rates of CTSH protein [n=50, n (%)]
2.4 CTSH蛋白的表达与PTC临床病理特征的关系
CTSH蛋白的表达与PTC患者的性别、年龄以及肿瘤直径之间的无明显关系(均P>0.05),而与浸润程度、淋巴结转移明显有关,即浸润被膜、有淋巴结转移的患者CTSH蛋白阳性表达率明显高于未浸润被膜、无淋巴结转移者(均P<0.05)(表2)。
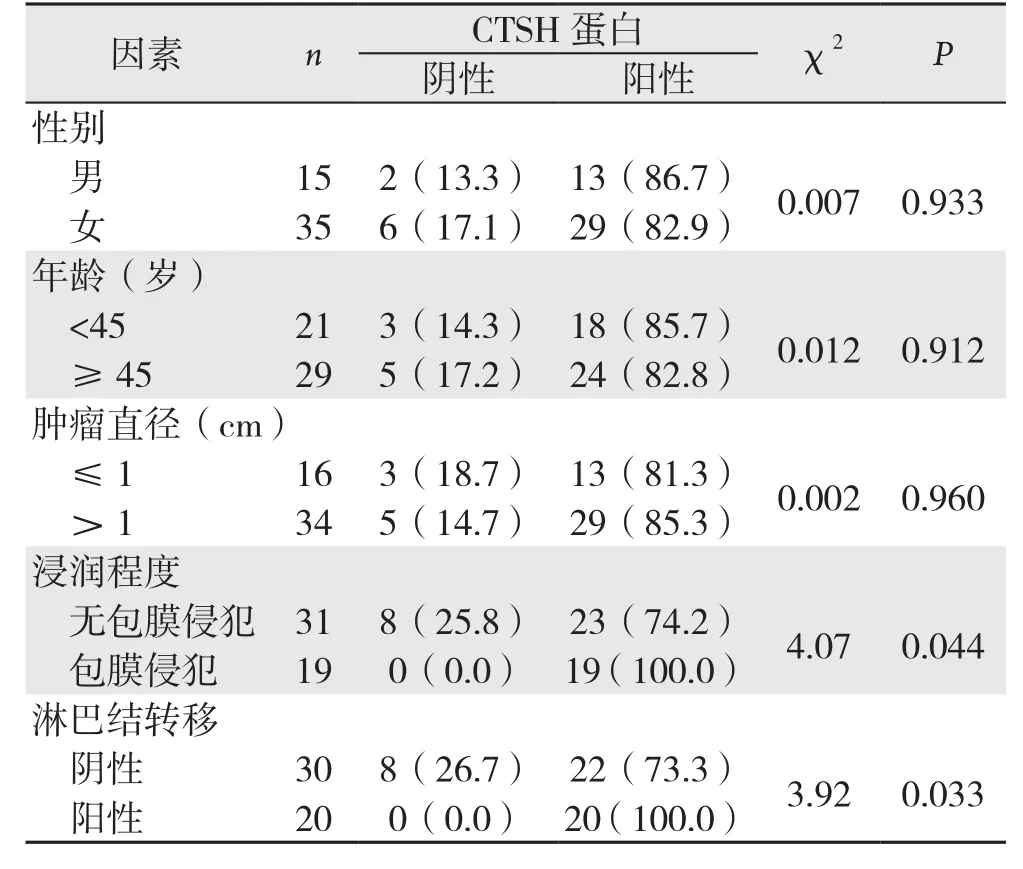
表2 CTSH蛋白的表达与PTC临床病理特征的关系[n(%)]Table2 Relations of CTSH protein expression with the clinicopathologic factors of PTC patients [n (%)]
3 讨 论
CTSH是一种具有硫醇内切酶和氨基肽酶活性的内肽酶,因首次从小鼠肝脏组织中分离而命名[18]。CTSH基因定位于15q24-q25,分子量28 kDa,有两种结构形式,最适pH7.0[19]。由该基因编码的蛋白质是一种溶酶体半胱氨酸蛋白酶,具有水解羧肽酶和氨肽酶活性,在各种组织中广泛表达。CTSH具有限制底物进入它们活性中心的特征。在本次研究中,发现PTC组织中CTSH mRNA及蛋白的表达水平明显高于癌旁组织及正常甲状腺组织,癌旁组织和正常甲状腺组织中CTSH mRNA及蛋白的表达水平无明显差异。故推测CTSH在PTC的发生和发展过程中可能具有重要的作用。研究表明,CTSH参与不同的肿瘤发生的过程,如血管生成,细胞增殖,细胞凋亡和侵袭,CTSH的表达在一些肿瘤中上调,包括乳腺癌,黑色素瘤,神经胶质瘤,结直肠癌和前列腺癌等,CTSH和其它蛋白酶可能参与细胞外基质组分的破坏,从而导致癌症的增殖,迁移和转移[16]。在本研究中发现,CTSH蛋白在PTC中的表达与患者的性别、年龄以及肿瘤直径之间的关系无明显关系(均P>0.05),与浸润程度、淋巴结转移之间的关系存在明显关系(均P<0.05)。且浸润被膜、有淋巴结转移的患者CTSH的阳性表达率明显高于未浸润被膜、无淋巴结转移者。这与上述文献报道CTSH可能导致癌症的增殖和转移一致,提示CTSH蛋白的高表达可能是PTC的侵袭以及转移重要因素。由于CTSH蛋白在正常甲状腺组织中低表达,因此设法干扰CTSH的表达就可能起到抑制PTC侵袭转移的作用,而又不影响人体正常甲状腺组织的功能,达到特异性治疗PTC的目的,成为甲状腺癌的基因治疗的靶点。在肿瘤患者的死因中,细胞外基质、基底膜被降解起着重要的作用,它们可以通过蛋白水解的作用从而促进肿瘤组织的空间扩展、肿瘤新生血管的形成以及血管内外肿瘤细胞的转移[19-20]。组织蛋白酶在不同细胞中的作用不同,有的能够降解胞内蛋白,生成抗原肽,有的则能降解不变链,从而参与到机体的自身免疫反应[19,21-22]。Oda等[23]的研究中,探讨了甲状腺球蛋白可以调节溶酶体内肽酶组织蛋白酶的表达和功能,发现在大鼠FRTL-5甲状腺细胞系甲状腺球蛋白诱导CTSH mRNA和蛋白的表达,以及CTSH的酶活性。表明CTSH参与溶酶体介导的激素前体的降解,并且甲状腺球蛋白通过激活CTSH相关蛋白水解途径刺激激素前体的活化。
CTSH在体内的表达调控机制仍不明确。Tsushima等[24]的研究证实,尽管CTSH在肿瘤进展中的作用尚不清楚,但是CTSH在肿瘤进展中的可能在降解纤维蛋白原和纤维蛋白方面起作用。CTSH和其他蛋白酶可能参与细胞外基质组分的破坏,导致癌症增殖,迁移和转移。Tedelind等[25]的研究表明甲状腺癌组织中的半胱氨酸组织蛋白酶可以通过其他方式促进癌症进展,而不是通过细胞外基质迁移细胞。蛋白水解活性变异的半胱氨酸组织蛋白酶与DNA相关蛋白和其他核蛋白的相互作用可能在甲状腺恶性肿瘤的发展中的发挥作用。其他的研究报道,蛋白质分解的亚细胞定位是调节组织稳态的关键步骤,蛋白酶的作用在许多方面对于细胞或组织的功能是决定性的,任何对蛋白酶运输的干扰都会导致蛋白水解作用的调节改变,进而导致甲状腺癌发生和进展。而对正常细胞和肿瘤细胞中蛋白酶的转运途径的理解,为寻找新的治疗方法中的药物靶点提供了线索[26]。
目前,国内外研究CTSH与肿瘤发生、发展的文献较多,但对其与甲状腺肿瘤关系的报道仍较少。本研究探讨了CTSH在不同甲状腺组织中的表达差异,证实了CTSH与PTC的发生存在某种关系。但其通过何种机制作用于PTC的发生,有待于下一步的研究。相信未来随着对CTSH作用和调控机制的更深入研究,其在甲状腺癌发生发展中的作用能够得到进一步证实,并有望成为甲状腺恶性肿瘤基因治疗的新靶点以及辅助诊断的指标。

