湖南省年轻女性乳腺癌患者生育力保存实施方案专家共识
湖南乳腺癌患者生育力保存专家协作组
乳腺癌已经成为中国女性发病率最高的恶性肿瘤,且年轻患者(≤40岁)比例近20%[1-2]。 随着近年来乳腺癌综合治疗的发展,患者的长期生存率逐步提高,年轻患者的生育需求日益凸显。然而,国内外的数据显示,乳腺癌患者治疗后的妊娠率不容乐观,比正常人群低近70%,在常见癌症种类的患者中处于低水平[3],原因来自多个方面,包括:乳腺癌的一些治疗措施损伤了患者的卵巢功能;由于乳腺癌发生发展与雌、孕激素及遗传因素关系密切,可能带来人们对于疾病复发和子代患病相关的担忧,等等。由于患者治疗后的生育涉及多个学科领域,因此在面对年轻乳腺癌患者的生育需求时,大多数医务人员依然比较困惑,甚至对患者能否生育存在误解。因此,本次共识旨在践行肿瘤生殖学,通过对乳腺癌患者生育力保存的基础背景、适用人群、操作流程等问题进行探讨,在乳腺科、生殖科、遗传科等学科之间搭建合理的跨学科合作方案,制定出适用于年轻女性乳腺癌患者生育力保存的临床流程,使医务人员能够更好地帮助患者实行科学有效的生育规划。
1 乳腺癌疾病及治疗与生育之间的关系
1.1 乳腺癌的综合治疗对于生育的影响
1.1.1 化疗的影响 化疗方案中使用的大多数细胞毒性药物可造成生殖细胞的凋亡和间质血管损伤进而导致卵巢功能损伤(表1)[4-5],乳腺癌化疗方案常涉及烷化剂(如环磷酰胺)等对卵巢有较强毒性的药物。在评定化疗药物对卵巢功能的影响时,尽管需要考虑药物种类、累积剂量、个体差异、患者年龄等因素的影响[6-9],但对于有生育要求的年轻乳腺癌患者,化疗对于卵巢的损伤是确切存在且不可逆的。
1.1.2 放疗的影响 放疗可以导致卵巢的萎缩和原始卵泡储备减少,造成卵巢早衰的累计剂量约20 Gy。目前,标准全乳腺放疗的剂量为50 Gy,但由于放射部位是在乳房,只有2.1~7.6 cGy的剂量通过内部散射到达子宫位置,因此,未见标准全乳腺放疗存在明显的、长期的卵巢毒性作用。尽管如此,因为骨盆部位仍然可检测到轻微辐射剂量,我们建议乳腺癌患者避开在放疗期间妊娠或体外收获卵子[14]。
1.1.3 内分泌治疗的影响 年轻乳腺癌患者的内分泌治疗以雌激素受体拮抗剂或雌激素受体拮抗剂/芳香化酶抑制剂联合卵巢功能抑制为主[15]。内分泌治疗与闭经的发生和持续时间相关,但通常在停药后恢复[16-17]。然而来自于动物实验和临床回顾性研究的结果显示,他莫昔芬治疗期间的妊娠导致胎儿严重先天性异常的发生率较高[18],考虑到其药物代谢产物的半衰期相当长(至少2个月),在服用期间及停药3个月之内不适宜妊娠[16]。目前的指南建议内分泌治疗的时间为5~10年,这使得患者生育年龄不得不推迟,需要考虑的是在这一等待期,女性由于年龄增长造成的卵子数目、质量不可逆的下降,直接影响了可能的生育结局[19]。

表1 乳腺癌单药化疗方案的卵巢损伤风险Table1 Risks of ovarian injury in a single-agent chemotherapy regimen for breast cancer
1.2 遗传因素对于生育的影响
许多基因的胚系突变与乳腺癌的易感明确相关,总的来说,先天性遗传风险在乳腺癌发生中的比例高达10%[20]。根据第3版ESO-ESMO年轻女性乳腺癌国际共识和NCCN指南,每位年轻乳腺癌患者在开始治疗前最好先给予遗传咨询[17],需要让患者意识到存在易感突变可能会对疾病治疗、复发管理、后代以及家庭成员疾病预防所带来的风险和益处。在年轻乳腺癌患者中,携带BRCA1/2基因胚系突变的患者超过5%[21],该类患者发生二次原发性乳腺癌、卵巢癌的风险较普通人群增高5~10倍[22]。另外,其他乳腺癌易感基因突变(如p53,PALB2,CHEK2,ATM)的携带者在年轻乳腺癌患者中比例也比年长患者更高[23]。由于乳腺癌易感基因突变携带者有50%的几率将突变传递给后代,因此有必要在涉及生育问题时确认遗传风险,以便患者在生育选择时,可针对是否进行胚胎筛选等问题进行全面的考虑[24]。乳腺癌常规检测的基因主要为BRCA1和BRCA2,如果遗传学家认为有必要,也可以增加其他基因的检测[17]。
1.3 乳腺癌妊娠与乳腺癌复发的关系
在涉及乳腺癌患者的生育问题时,许多医生和患者都焦虑于妊娠期雌孕激素水平的变化是否与乳腺癌复发相关。目前来自于多中心乳腺癌患者妊娠的长期随访研究表明,不论雌孕激素受体为阳性或阴性,妊娠对患者的无病生存率和总生存率未见不利影响。妊娠安全性亚组分析也表明妊娠结局及哺乳状态对患者的无病生存率和总生存率无明显影响[25-26]。各类权威指南中也对患者妊娠给予了肯定的支持[27-28],综上,妊娠并不是乳腺癌患者的禁忌。
2 生育力保存方法及后续生育策略
目前生育力保存技术逐步发展,许多方法可用于保护年轻乳腺癌患者的卵巢功能,包括体外的冷冻保存技术和/或GnRH激动剂的保护性治疗。但是,这些方法有各自的优势和弊端(表2)。

表2 女性生育力保存方式的比较Table2 Comparison of female fertility preservation methods
2.1 生育力保存的方法
2.1.1 卵子冷冻和胚胎冷冻 在生育力保存技术中,运用得比较成熟的是胚胎冷冻和成熟卵母细胞冷冻。实施卵子冷冻或者胚胎冷冻需要在有经验的生殖中心进行,并通过促排卵以获取足够多的卵子。统计数据显示,35岁以下妇女如果获取6枚卵子,生育1个孩子的几率为50%[29]。年轻乳腺癌患者平均获卵可达7~8枚[30]。一个小样本研究显示,乳腺癌患者化疗前冷冻胚胎后的妊娠率与不孕不育人群经过辅助生殖治疗后的妊娠率没有显著差异,均>40%[31]。乳腺癌患者促排卵可用拮抗剂或微刺激方案,使用或加用AI类药物可以避免在卵巢刺激过程因中雌激素水平过度升高导致的乳腺癌细胞增殖[32-33]。这种特殊情况下的促排卵不受时间限制,可以在女性生理周期的任何时候开始(月经期、排卵期、黄体期均可),且在1~3周内有可能多次进行。有经验的生殖中心还可以采用卵子体外成熟(IVM)方式来尽可能缩短用药时间。建议促排卵方案实施前行乳腺癌手术切除病灶以降低肿瘤负荷,可能对于患者更为有利。
2.1.2 卵巢组织冷冻 卵巢组织冷冻不仅仅保存了生殖细胞,还保存了可恢复生殖内分泌的卵巢组织,是青春期前女性唯一可用的体外生育力保存策略,同时也是已经开始化疗(1~2个周期以内)的女性可以采取的生育力保存方式[34-35]。现有的数
据显示,卵巢组织冷冻不再停留于实验阶段,已经作为一种有效且合理的生育力保存手段。截止到2017年,在实施了卵巢组织冷冻的癌症妇女中,已报道130例通过冷冻卵巢组织回移后的婴儿出生[35]。该方案适用于需要化疗、癌细胞卵巢组织转移风险低的患者,由于不需要使用促排卵药物,在乳腺癌患者中有着很好的适用性[35-37]。
2.1.3 GnRH保护卵巢 目前,GnRH方案运用于生育力保存的效果并无统一结论,相关指南中对于其保护卵巢功能的认可也存在冲突,一些指南认为卵巢抑制作为生育保留的有效性暂缺足够的证据,不能依赖这类药物保留生育功能[32];另一些则认为GnRH似乎可以在女性化疗时保留卵巢功能,降低早期闭经风险,提高未来的生育机会[38-39]。一项荟萃研究[40]表明绝经前早期乳腺癌患者术后卵巢GnRH保护有助于减少术后卵巢早衰率约15%,提高生育率约10%,且生育对患者总生存率和无病生存率无不利影响。但总的来说,该方案对于有生育要求的患者自然妊娠率缺乏大样本数据。考虑到化疗时联用GnRH临床使用简单易行、未对化疗疗效产生影响、且存在减轻化疗导致的卵巢损伤的作用可能,建议可作为所有乳腺癌分型、需接受化疗、有意愿保留生育和/或卵巢功能的女性的一种选择,并可以与其他生育力保存方式同时使用。
2.2 患者生育策略
2.2.1 妊娠时间的选择 根据最新的文献和指南[27-28,41],乳腺癌患者的生育方案建议如下:⑴ 乳腺原位癌患者手术和放疗结束后;⑵ 淋巴结阴性的乳腺浸润性癌患者手术后2年;⑶ 淋巴结阳性的乳腺浸润性癌患者手术后5年;⑷ 需要辅助内分泌治疗的患者,在受孕前3个月停止内分泌治疗[例如诺雷得、三苯氧胺或其他雌激素受体调节剂(selective estrogen receptor modulators,SERM)],直至生育后哺乳结束,再继续内分泌治疗。
2.2.2 生育力保存患者妊娠策略的选择
2.2.2.1 自然妊娠 GnRH药物卵巢保护的患者可在停止治疗3个月后接受生育力评估和追踪,尝试自然妊娠。接受卵巢组织冷冻的患者应根据卵巢组织回移相关指南,在乳腺、内分泌、生殖专家的指导下,选择合适的回移时机。若进行原位移植,则有机会尝试自然妊娠,卵巢组织回移后恢复卵巢功能以及卵巢功能维持的时间存在个体差异,主要依赖于卵巢组织冷冻时卵泡的密度。据报道[35],卵巢组织回移后恢复内分泌所需的时间在6周至9个月不等,卵巢功能维持时间平均在4~5年。上述两种情况下,若尝试期>6个月未能妊娠,建议在辅助生殖技术的帮助下妊娠。
2.2.2.2 辅助生殖技术妊娠 根据不育人群现有数据,35岁以下的不育妇女解冻的胚胎的活产率为38.7%,卵母细胞冻存活产率约34%,胚胎冷冻时间不影响活产率。乳腺癌患者卵子/胚胎冷冻后,采用辅助生殖技术可获得与不育症女性相似的活产率[31]。卵巢组织回移妊娠率波动于30%左右,活产率介于25%左右。对于年龄<35岁,卵巢功能较好的癌症患者,如果采取卵子/胚胎冷冻,并联合卵巢组织冷冻,累积活产率有望提高到50%~60%[35]。
2.2.2.3 遗传性乳腺癌的生殖干预 BRCA1/2基因突变(或者其他致病基因突变)的乳腺癌患者以及家族中的突变携带者应在妊娠时与生殖遗传医生讨论生育方案。目前,在辅助生殖技术的基础上,采用胚胎植入前遗传学检测,能够有效的筛选胚胎[42-43],从而避免遗传学缺陷向子代的传递[44],真正实现孕前优生[45]。该技术的首次成功应用在1990年[46],2001年出生了世界首例排除肿瘤易感基因突变的婴儿[47],在伦理上也已经被广泛认可[36]。近年来,我国在该领域发展迅猛,其应用在已经走在了世界前列,2015年我国首例排除癌症易感基因突变的“无癌宝宝”出生[48]。
3 乳腺癌生育力保存患者的介入时机、患者筛选原则
3.1 生育力保存介入的时机
根据ESO-ESMO[17]、ASCO[33]指南的建议,最佳的生育力保存介入时间是在癌症治疗之前询问患者的意愿,并开始生育力保存的相关准备。然而在许多情况下,患者可能已经接受了部分的治疗(手术、化疗等),这不应该成为患者接受生育力保存咨询的禁忌,笔者的建议是医务人员尽可能早地了解年轻乳腺癌患者(≤40岁)的生育需求,在充分评估预后经患者知情同意下考虑实施生育力保存,并推荐至生殖科进行后续的生育评估和讨论可能的方案及获益。在实施过程中,建议区域内应有专业的生育力保存医务小组来实现患者在不同科室间的快速转诊、记录、沟通和追踪[34]。
3.2 生育力保存及卵巢功能保护的患者初筛标准
⑴ 年龄≤40岁(可视卵巢储备和个人情况适当放宽),卵巢储备功能评级次低反应及以上(低反应慎重考虑)(表3);⑵ 低-中度复发风险患者(高风险慎重考虑)(表4);⑶ 乳腺癌治疗方案,有造成卵巢功能衰竭风险,或对生育有不利影响;⑷ 患者能够耐受辅助生殖技术或卵巢组织活检手术;⑸ 距化疗开始有1~3周左右时间窗口(参见特殊病情);⑹ 患者本人或其监护人的知情同意。
3.3 禁忌证和风险
3.3.1 禁忌证 ⑴ 肿瘤远处转移;⑵ 患者预后和远期生存率差(相对禁忌);⑶ 存在辅助生殖技术的禁忌证。
3.3.2 风险 ⑴ BRCA1/2胚系基因突变患者由于存在卵巢癌易感性,卵巢组织冷冻回移存在风险;⑵ 因为患者的生育还受到多方面的影响,任何生育力保存方式并不能保证正常健康生育;⑶ 前期临床研究和相关指南中都提到AI类药物的使用是乳腺癌患者可以使用的较安全、有效的促排卵方式[50],但仍不可避免的导致患者雌、孕激素水平短期升高。

表3 卵巢储备功能预估表Table3 Ovarian function estimation table

表4 肿瘤预后及复发风险评估表Table4 Assessment form for tumor prognosis and recurrence risk
4 实施跨学科领域就诊的临床流程
4.1 跨学科实施体外生育力保存的具体流程(图1)
4.1.1 患者初筛 乳腺科临床医生根据患者的肿瘤分期、病理学类型、淋巴结转移数目、盆腔MRI(推荐)、CT(注意:CT可能损害发育中的卵泡,应尽量避免)等进行疾病转移、复发风险及预后的评估并记录,推荐有生育需求、低-中度复发风险、卵巢转移风险低且疾病预后较好的患者转诊至生殖科,并通知区域内生育力保存医疗小组记录和追踪。尽管,在实际操作过程中无法在治疗前就获取患者所有的病情情况,但考虑到尽早的转诊可为患者争取更多的时间,并且在后续的方案制定中,可以进一步复核患者病情,因此治疗开始前的转诊仍旧是推荐的。乳腺肿瘤切除的手术时间不应受到影响,但放、化疗开始前需充分考虑对生育力保存的影响。
4.1.2 形成初步生育力保存意见 生殖科根据患者的年龄,病情严重程度及预期生存时间(初筛时的记录)、家族史(建议年轻乳腺癌患者常规进行生殖遗传咨询和相关基因检测)、卵巢功能及生育意愿等与患者及家属进行充分的沟通,给予合适的生育力保存方式建议,预计所需要的时间、药物、手术等,并记录,情况及时反馈给乳腺科。
4.1.3 生育力保存方案确认 乳腺科进一步确定患者病情,综合考虑生育力保存方案对于治疗的影响,与患者及家属进行充分的沟通,配合需求调整化疗时间。研究显示,>91 d的化疗推迟将影响患者生存率,>61 d以上的推迟可能影响II~III期及三阴性乳腺癌患者生存率,<61 d的各组患者间未见统计学差异[51]。复杂病例建议进行相关多学科会诊,共同确定方案。
4.1.4 生育力保存方案的实施 GnRH用药方案由乳腺科医生制定和实施,其他生育力保存方式由生殖科实施。患者及家属签署知情同意是非常重要的。无论患者最终是否实施生育力保存或尝试妊娠,生育力保存医务小组均应给予长期的追踪和记录。
4.2 特殊病情
⑴ 患者已经经历≤2次化疗,再要求生育力保存,可考虑重新进行生育力评估。若生育力尚可,在第3次化疗开始之前行卵巢组织冷冻。不推荐冻卵、冻胚。⑵ 患者为特殊类型乳腺癌(妊娠期乳腺癌),建议妇产科、生殖科与乳腺科医生针对个案进行多学科会诊。⑶ 患者若携带BRCA1/2胚系突变,首选冻卵/冻胚,因为卵巢组织冷冻回移存在卵巢癌发生的风险。⑷ 患者已经接受CT检查、骨扫描,仅建议行卵巢组织冷冻。不推荐冻卵、冻胚。
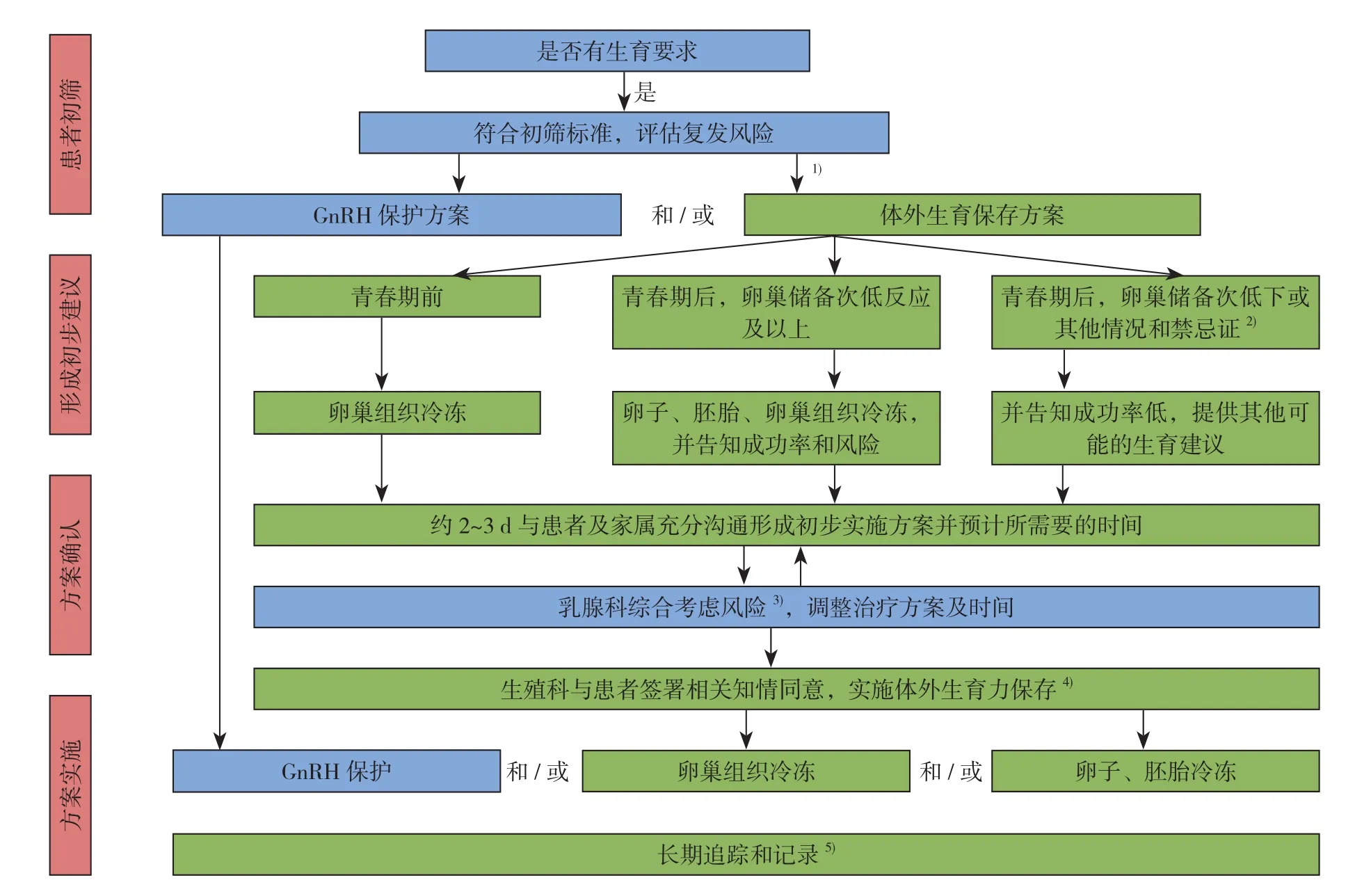
图1 乳腺癌患者跨学科实施体外生育力保存流程(图中蓝色框内事宜在乳腺科完成,绿色框内事宜在生殖科完成,在任何阶段出现疑问时,应考虑进行多学科会诊)注:1)患者进入流程的最佳时机应该是在病情基本确定,化疗开始前。进入流程需要完善生育力评估,一般需1~2 d时间,无论患者何时入组,均应通知生育力保存医务小组[34]给予绿色通道服务;2)生殖科医生在生育力评估中诊断患者卵巢功能不全,宫腔条件不符合妊娠等情况不适合考虑生育力保存的,或者乳腺科医生术中即发现患者为预后不良高危类型的(炎性乳腺癌、远处转移等)时,应就特殊情况进行沟通记录,由乳腺科医生与患者谈话,建议疾病治疗完成后再至生殖中心寻求其他可能的生育帮助;3)若进一步复核病情显示患者为复发高风险,建议停止生育力保存实施流程,由乳腺科医生与患者谈话,疾病治疗完成后再至生殖中心寻求其他可能的生育帮助;4)患者至生殖科确定生育力保存方案;5)生育力保存小组记录患者病情沟通的过程,完善生育力保存追踪治疗记录,并定期随访Figure1 Interdisciplinary fertility preservation process for breast cancer patients (the blue box in the picture is completed in the department of breast surgery, and the green box is completed in the department of reproductive medicine. In case of doubtat any stage, multidisciplinary consultation should be considered)Note: 1) The best time for patients to enter the process should be determined before the initiation of chemotherapy, it always takes 1–2 d to complete the fertility evaluation before entering the process, and regardless of when the patient is enrolled, the fertility conservation medical team[34] should be notified to give green channel services; 2) Doctors should communicate and record special situations when their patients with ovarian dysfunction, uterine cavity, poor prognosis and in high-risk cancer types (inflammatory breast cancer, distant metastasis, etc.), and these patients should be advised to seek other possible fertility assistance after completing cancer treatment; 3) If the patient is in a high risk of tumor recurrence, it is recommended to stop the process of fertility preservation, and these patients should be advised to seek other possible fertility assistance after completing cancer treatment; 4) Fertility preservation plan decision making in the department reproductive medicine; 5) Communication process with the patients should be kept, and tracking record and regular follow-up should be conducted by the fertility preservation group
5 结 语
近年来,肿瘤患者的治疗已经远远不再满足于生存。对于乳腺癌这类预后良好的恶性肿瘤,在谋求患者获得更长生存期的同时,也需要关注她们对于生育的要求、生活质量的提高、以及家人和子代的疾病预防。此共识希望通过形成跨学科科室之间的临床诊疗指导方案和流程,建立患者快速的转诊途径,为年轻乳腺癌患者生育力保存提供解决方案。
参与编写共识专家:卢光琇、林戈、龚斐、陈辉、胡亮(中信湘雅生殖与遗传专科医院) ,王守满、邬玉辉(中南大学湘雅医院乳腺科),欧阳取长(湖南省肿瘤医院乳腺内科),易文君、周恩相(中南大学湘雅二医院乳甲外科),钱立元、丁波泥(中南大学湘雅三医院乳甲外科),范培芝(湖南省人民医院乳甲外科)
参与撰写成员(按姓氏字母排名):戴聪伶,杜娟,郭静,郭磊,黄隽,胡煜,吴晖,王宇,杨晓祎,钟灿翔,张克兢,张磊屹,曾思聪,郑伟

