miR-23b-3p在皮肌炎血清中的表达与临床意义
叶利芳 ,舒晓明 ,左 瑜 ,杨阚波 ,陈 贺 ,张亚妹 ,王国春 ,⋆
(1.北京大学中日友好临床医学院,北京 100029;2.中日友好医院 风湿免疫科,北京 100029;3.中国医学科学院北京协和医学院 研究生院,北京 100730)
皮肌炎(dermatomyositis,DM)是一组病因尚不明确、临床上以四肢近端肌无力、肌痛及皮肤病变为特征,以骨骼肌炎症浸润为特征性病理改变的自身免疫性疾病,也可伴发严重的呼吸、消化、循环等多系统损害[1]。肌肉病变为DM的主要病变之一,目前DM肌肉病变的确切病因和发病机制仍不清楚。
大量研究表明miRNA参与各种疾病的发病机制,如自身免疫性疾病[2]。新近发现的miR-23b-3p是一种炎症相关的miRNA,可调节许多炎性细胞因子,例如NF-κB,肿瘤坏死因子(tumor necrosis factor,TNF)-α,白细胞介素(interleukin,IL)-1β和IL-17,参与多种自身免疫性疾病[6]。Zhu等[7]研究发现,miR-23b-3p在类风湿关节炎(rheumatoid arthritis,RA)和系统性红斑狼疮(systemic lupus erythematosus,SLE)患者中表达下调,通过靶向TGF-β激活的激酶1/MAP3K7结合蛋白 2 (TGF-β-activated kinase 1/MAP3K7 binding protein2,TAB2)、TAB3 和核因子 κ-B 激酶亚基抑制剂 α(inhibitor of nuclear factor κ-B kinase subunit α,IKK-α)抑制IL-17水平进而参与疾病发病。但迄今为止,miR-23b-3p在DM中的作用尚未研究。本研究采用实时荧光定量PCR检测DM患者中的miR-23b-3p的表达水平,并分析其和临床特征的相关性,初步探讨其在DM中的临床意义。
1 对象与方法
1.1 研究对象
选择2011年3月~2016年2月于中日友好医院风湿免疫科住院治疗的活动期DM患者49例,其中男16例、女33例;全部患者均符合1975年Bohan/Peter的诊断标准。所有入选病例均排除合并感染及其他自身免疫性疾病。收集同期在我院体检的经年龄、性别匹配的健康体检人群血清作为对照。所有血清采集分离之后均于-80°C冻存直至检测时使用。本研究已通过我院伦理委员会(2016117)批准,所有受试者签署知情同意书。
1.2 临床指标检测
常规实验室评估包括确定血清肌酸激酶(CK),乳酸脱氢酶(LDH),红细胞沉降率(ESR),C-反应蛋白(CRP),均在中日友好医院检验科完成。采用蛋白质印迹法检测血清中抗Jo-1、PL-7、PL-12、EJ、OJ、Mi2、SRP、MDA5、NXP2、TIFl-1 和SAE抗体 (试剂盒购自德国欧蒙公司),采用ELISA法检测血清中抗HMGCR抗体 (试剂盒购自美国Inova Diagnostics公司)。根据国际肌炎预后评估协作组 (international myositis outcome assessment co11aboration study,IMACS)推荐使用视觉模拟评分 (physician's global assessment,PGA)(范围0~10cm)评估DM患者的疾病活动性。
1.3 血清总RNA提取
根据制造商的说明书使用TRIzol试剂(美国Invitrogen公司)从1ml血清中提取总RNA,并最终溶解于20μl无RNase的水中;采用紫外分光光度计K5500(中国)对获得的总miRNA进行纯度和浓度检测,合格样品的吸光度A260/280在1:8~2:1之间;然后进行凝胶电泳检测RNA的完整性。
1.4 实时荧光定量PCR检测
采用TIANGEN逆转录试剂盒(天根,中国)对血清提取的总RNA逆转录成cDNA;设计并合成相应引物(锐博,中国),颈环法检测,以celmiR-39-3p为内参基因,采用miRNA qPCR Starter Kit(锐博,中国)行实时荧光定量PCR,然后采用CFX96 RTPCR仪(Bio-Rad公司,美国)上进行qPCR扩增,检测各样本Ct值。每种样品采用相同体系及条件同时进行3次PCR扩增。为验证预期PCR产物的准确性和特异性,进行解链曲线分析。△CT=目的基因平均 CT值-内参平均CT值,计算2-△△Ct作为miRNA的相对表达水平。
1.5 统计学方法
统计学分析均采用SPSS 19.0软件;计量资料组间比较采用χ2检验,计数资料的比较采用Mann-Whitney U检验,采用Spearman相关系数进行相关性评估。
2 结果
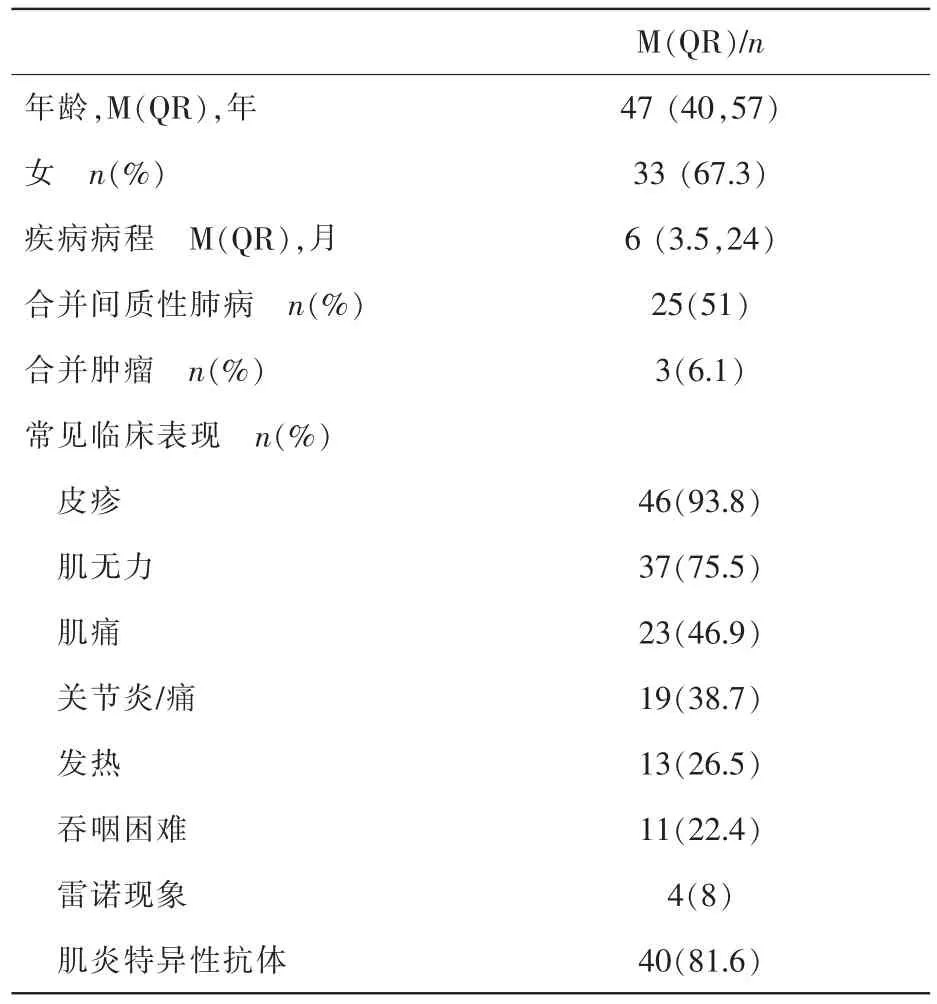
表1 DM患者临床资料
2.1 DM患者的临床资料
表1示,49例DM患者年龄47±10岁,常见的临床症状为皮疹(93.8%)、肌无力(75.5%)、肌痛(46.9%)、关节炎/痛(38.7%)、发热(26.5%)等,肌炎特异性抗体(myositis specific autoantibodies,MSAs)阳性率为 81.6%(40/49),约有 51%(25 例)的患者合并有肺间质病变 (interstitial lung disease,ILD),合并食管受累者有 11例 (22.4%),4例(8%)患者有雷诺现象。
2.2 miR-23b-3p在DM患者血清中的表达
DM患者血清中miR-23b-3p相对表达量为1.98±0.86,健康对照组miR-23b-3p相对表达量为 3.02±1.13,2 组具有显著性差异 (P<0.01),结果见图1。
2.3 DM患者血清miR-23b-3p表达水平与临床特征的相关性
我们进一步分析常见临床症状和实验室指标,结果表明,DM患者血清miR-23b-3p相对表达量与“技工手”[1.20 (0.93,1.93)]的发生相关(Z=-2.302,P=0.021);miR-23-3p 与肌痛、 肌无力、吞咽困难、关节疼痛、雷诺现象和肺间质病变等常见临床症状的出现不相关。实验室结果表明,miR-23b-3p与CK水平呈负相关 (r=-0.286,P<0.05);与血沉(ESR)、C 反应蛋白(CRP)、乳酸脱氢酶 (LDH)、谷草转氨酶 (AST)、谷丙转氨酶(ALT)以及疾病活动度水平均无相关性,详见表2及表3。
2.4 不同CK水平的miR-23b-3p表达水平比较
为进一步明确DM患者血清miR-23b-3p与CK的相关性,将实验组分为CK正常组(35例)与CK升高组(14例),并比较其miR-23b-3p表达水平,结果显示CK升高组miR-23b-3p(1.61±0.19)显著低于 CK 正常组(2.15±0.15,P<0.05),见图2。
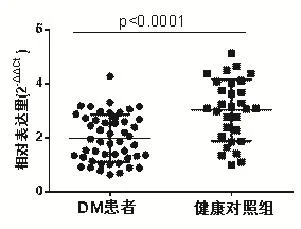
图1 DM患者血清中miR-23b-3p表达水平下调
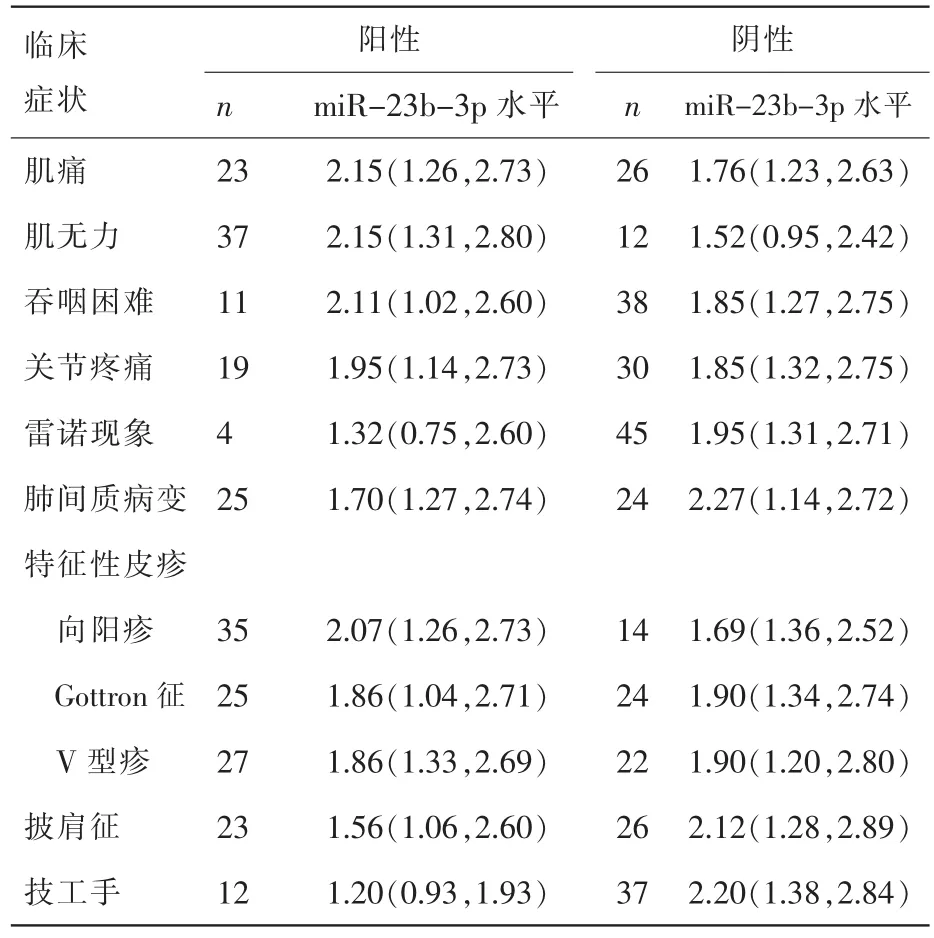
表2 DM患者血清中miR-23b-3p表达水平与临床症状的比较
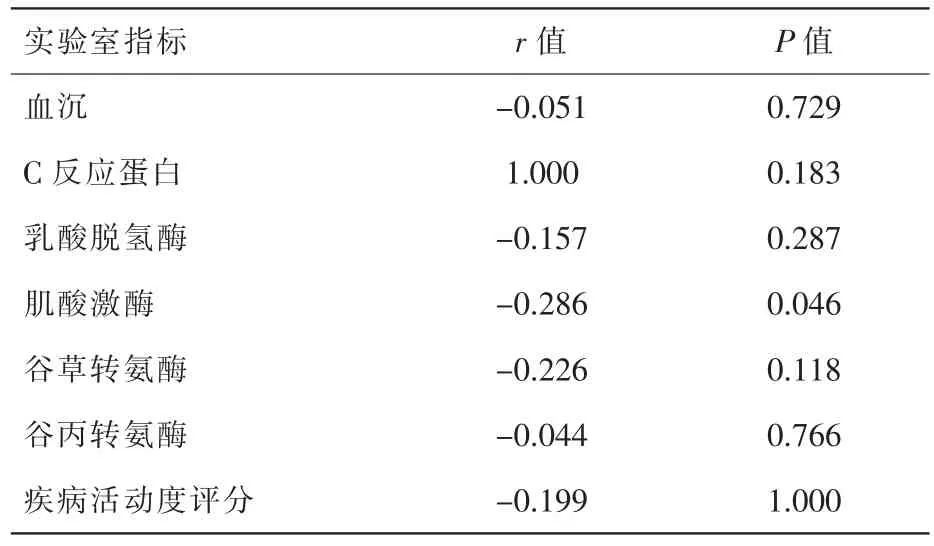
表3 DM患者血清中miR-23b-3p表达水平与实验室指标的比较
3 讨论

图2 不同CK水平的miR-23b-3p的表达水平比较
已有研究表明miRNA参与各种疾病的发病机制,如miRNA参与系统性红斑狼疮,类风湿性关节炎等自身免疫性疾病的发病机制[8]。有报道多个miRNA在皮肌炎中的表达差异,如Inoue K等研究发现miR-223在DM皮肤和血清中表达下调并参与蛋白激酶C水平调节[3],Oshikawa Y等研究表明在DM血清和皮肤中表达下调的miR-7与Gottron’s皮疹的发生呈负相关[4],有部分miRNA参与肌肉损伤过程,Yin等研究表明DM患者肌肉组织中表达下调的miR-146a通过靶向TRAF6和影响IL-17/ICAM-1途径调节炎性巨噬细胞浸润进而参与肌肉炎性损伤[5]。这些研究均表明miRNA参与DM的发病。
在炎性疾病患者的血清样品中存在循环的细胞外miRNA,可能由炎性细胞或组织产生,因此血清miRNA的变化可以反映疾病状态[9]。近年来miRNA在DM发病中的调控机制越来越受到重视。研究显示,miR-23b通过调节多种不同的免疫细胞和炎症因子参与自身免疫性发病机制[6]。在DM患者的血液和炎症肌肉损伤中发现的免疫细胞和炎症因子直接参与肌纤维损伤[10],故推测miR-23b-3p在DM肌肉损伤发病过程中起作用。
本研究首次证实DM患者血清miR-23b-3p表达下调,与CK水平负相关,与技工手的发生有关,提示miR-23b-3p可能是参与DM肌肉损伤的重要分子。Martina等研究显示,与健康对照组相比,miR-23b-3p的表达在IIM患者的外周血单个核细胞(PBMC)中未发现有显著差异。本研究DM患者血清miR-23b-3p表达下调,推断miR-23b-3p在皮肌炎致病机制中的调节作用可能不在PMBC中发生[11]。新近研究显示,miR-23b-3p在肌营养不良患者中表达显著下调,该研究为miR-23b-3p参与皮肌炎患者肌肉损伤过程提供了有力的证据[11]。但确切机制尚不清楚,miR-23b可能通过调节多种不同的免疫细胞和炎症因子共同参与皮肌炎肌肉损伤过程。Zhu等[7]研究显示,在RA或SLE中下调的miR-23b-3p靶向TAB2、TAB3和IKK-α mRNA转录物,通过限制关键促炎性细胞因子IL-17,IL-1β和TNF的作用来抑制自身免疫症状。IL-17在DM中的发病机理也有报道[13]。因此推测,miR-23b-3p可能通过靶向调控IL-17的表达,从而介导DM的肌肉损伤。
Oshikawa等研究发现,皮肌炎患者中皮肤与血清中miR-7的表达显著下调,并认为血清miR-7可能是诊断皮肌炎的分子标记物[14]。本研究同样发现,miR-23b-3p在DM中有技工手患者中的表达水平显著低于无技工手患者,其原因尚不清楚,是否可以作为区分皮肌炎患者有无技工手的分子标记物也有待进一步的研究。
——脂溢性皮炎样皮肌炎

